血管緊張素(1-7)對氧化低密度脂蛋白誘導大鼠主動脈內皮細胞損傷的作用機制
杜寧輝,楊志明,楊慧宇
山西醫科大學附屬第二臨床醫學院(太原 030001)
?
血管緊張素(1-7)對氧化低密度脂蛋白誘導大鼠主動脈內皮細胞損傷的作用機制
杜寧輝,楊志明,楊慧宇
山西醫科大學附屬第二臨床醫學院(太原 030001)
摘要:目的觀察血管緊張素(1-7)[Ang(1-7)]對氧化低密度脂蛋白(ox-LDL)誘導的大鼠主動脈內皮細胞(SVAREC)血凝素樣氧化型低密度脂蛋白受體1(LOX-1)、細胞間黏附分子-1(ICAM-1)、血管細胞黏附分子-1(VCAM-1)表達水平的影響,探討其可能作用機制。方法將大鼠隨機分為ox-LDL組和ox-LDL+Ang(1-7)組。實驗通過Cell Counting Kit-8(簡稱CCK-8)檢測細胞增殖情況。通過熒光實時定量PCR法檢測LOX-1、VCAM-1、ICAM-1mRNA的表達水平。結果ox-LDL可以抑制SVAREC細胞的增殖,并呈劑量依賴性,與對照組比較有統計學意義(P<0.05)。ox-LDL+Ang(1-7)組可以使SVAREC細胞生長抑制率降低,并呈劑量依賴性,與對照組比較有統計學意義(P<0.05)。隨著ox-LDL濃度的升高,LOX-1、ICAM-1及VCAM-1 mRNA表達量上升,并呈劑量依賴性,與對照組比較有統計學意義(P<0.05),加入Ang(1-7),隨著Ang(1-7)的濃度升高,LOX-1、ICAM-1及VCAM-1mRNA表達量下降。結論ox-LDL可以損傷SVAREC細胞,并使LOX-1、ICAM-1及VCAM-1mRNA表達量上升,Ang(1-7)抑制ox-LDL的上述反應,并且可能通過LOX-1、ICAM-1及VCAM-1mRNA發揮作用。
關鍵詞:血管緊張素 (1-7);氧化低密度脂蛋白;氧化低密度脂蛋白受體1;主動脈內皮細胞;血管細胞黏附分子-1;細胞間黏附分子-1
動脈粥樣硬化(atherosclerosis,AS)是許多心血管疾病的病理基礎,目前公認血管內皮細胞的損傷和功能障礙是AS發生和發展的始動因素和中心環節之一。血凝素樣氧化低密度脂蛋白受體1(lectin like oxidized low-density lipoprotein receptor 1,LOX-1)是近年發現的新型氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)特異受體,是內皮細胞攝取和代謝ox-LDL的主要受體,其介導血管內皮細胞攝取ox-LDL并引起內皮損傷及功能改變[1-2]。血管緊張素(1-7)[Ang(1-7)]具有降血壓,保護心肌細胞等作用[3]。細胞間黏附分子-1(ICAM-1)又稱 CD54,是目前已知的最廣泛的細胞間黏附分子,正常情況下它呈現低表達狀態,某些炎癥刺激后其表達明顯增加。ICAM-1廣泛分布于血管內皮細胞、樹突狀細胞、各類上皮細胞、激活的淋巴細胞、巨噬細胞和纖維母細胞等表面,不但參與炎癥反應、誘導新生血管生成、免疫反應,而且與動脈粥樣硬化的形成等有關[4]。血管細胞黏附分子-1(VCAM-1)是免疫球蛋白超基因家族,主要由血管內皮組胞表達,在高血脂刺激AS形成過程中,能促進免疫細胞浸潤,使單核細胞和淋巴細胞黏附于血管內皮[5]。本實驗觀察Ang(1-7)對ox-LDL誘導大鼠主動脈內皮細胞(SVAREC)LOX-1、ICAM-1、VCAM-1的表達水平的影響,探討其可能作用機制。
1材料與方法
1.1材料與試劑大鼠主動脈內皮細胞SVAREC(上海滬震生物科技公司);Ang(1-7)、ox-LDL購自美國Sigma公司;胎牛血清購自杭州四季青生物有限公司;DMEM培養液為美國Gibco公司產品;CCK-8為美國Sigma公司產品;TrizolRNA提取試劑、反轉錄試劑盒、FastStart Universal SYBR Green Mastel(ROX)試劑盒均為羅氏公司產品;引物由上海生工生物工程技術服務有限公司合成;酶標儀為美國Becton Dickinson公司產品。
1.2大鼠內皮細胞的培養大鼠內皮細胞SVAREC懸浮于含20%胎牛血清(FBS)、100 U/mL青霉素、100 U/mL鏈霉素的DMEM培養基中,置于體積分數5% CO2培養箱中37 ℃保存,用0.25%胰蛋白酶進行消化、傳代。取2代~3代細胞進行試驗,給予干預措施時培養液改為含3%胎牛血清的DMEM。
1.3實驗分組① ox-LDL組,分為空白對照組及實驗組(ox-LDL濃度分別為10 mg/L、20 mg/L、50 mg/L、100 mg/L);②ox-LDL+Ang(1-7)組,分為對照組(ox-LDL終濃度為100 mg/L)及實驗組[(Ang(1-7)濃度分別為10-9mol/L~10-6mol/L)]。
1.4CCK-8法檢測大鼠細胞增殖情況收集2代~3代SVAREC細胞處于對數生長期的細胞消化、重懸、計數,以5×104/mL密度每孔100 μL,接種細胞至96孔板。對照孔加入不含藥物的新鮮培養液100 μL,給藥組每孔加入不同濃度的含藥培養液100 μL,設5個復孔,于37 ℃、5% CO2培養箱中繼續培養24 h,每孔加入CCK-8試劑10 μL,于CO2培養箱中孵育1 h后,用酶標儀于450 nm波長下測定吸光度值,采用雙波長進行測定吸光度值(A值)。按照公式計算細胞的生長抑制率,上述實驗重復3次后取平均值,用SPSS17.0軟件計算。 細胞生長抑制率=(1-實驗組的平均A值/陰性對照組的平均A值)×100%
1.5實時定量PCR檢測LOX-1、ICAM-1、VCAM-1 mRNA收集經ox-LDL組、ox-LDL+Ang(1-7)組處理24 h的細胞,用TRIzol試劑提取總RNA,采用紫外可見光分光光度計測定260 nm/280 nm OD值,測定RNA純度。以Ol-igo dT為引物,按照逆轉錄試劑盒說明書進行操作,得到對應的cDNA,置于-20 ℃保存備用。以cDNA為模板LOX-1、ICAM-1、
VCAM-1引物進行擴增,用GAPDH做內參照。LOX-1上游引物5′-ACCACCAGAATCTGAATCTCCAA-3′,下游引物5′-TTGCGGACAAGGAGCTGAAC-3′,擴增片段長度為68 bp;ICAM-1上游引物5′-AAACGGGAGATGAATGGT-3′,下游引物5′-TCTGGCGGTAATAGGTGTA-3′,擴增片段長度為184bp;VCAM-1上游引物5′-CCCTTGACCGGCTGGAGATT-3′,下游引物5′-CTGGGGGCAACATTGACATAAAGTG-3′,擴增片段長度為241 bp;GAPDH上游引物5-′CTCTGCTCCTCCTGTTCGAC-3′,下游引物5′-TAAAAAGCAGCCCTGGTGAC-3′,擴增片段長度為151 bp。反應條件設定:94 ℃預變性10 min;然后94 ℃15 s,60 ℃ 60 s,45個循環結束。溶解程序:95 ℃15 s,60 ℃60 s,95 ℃15 s,然后RT-PCR SYBR Green檢測。處理組均設3個復管,取其CT值的均值。CT值代表反應管內熒光信號達到預設域值時所經歷的循環數,2-△△CT代表初始cDNA的相對量。
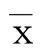
2結果
2.1CCK-8法檢測大鼠細胞增殖情況不同濃度ox-LDL(10 mg/L、20 mg/L、50 mg/L、100 mg/L)作用于SVAREC細胞24 h后,SVAREC細胞隨著ox-LDL濃度升高,細胞生長抑制率升高,呈劑量依賴性,在相同時間下,與對照組比較,不同濃度的ox-LDL組間差異有統計學意義(P<0.05)。詳見表1、圖1。ox-LDL在終濃度為100 mg/L基礎上,分別加入不同濃度的Ang(1-7)(10-9mol/L~10-6mol/L)作用細胞24 h后,隨著Ang(1-7)濃度升高,細胞生長抑制率升高,呈劑量依賴性,不同濃度的ox-LDL組間差異有統計學差異(P<0.05)。詳見表2、圖2。
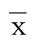
表1 不同濃度ox-LDL作用細胞24 h細胞增殖情況(±s)
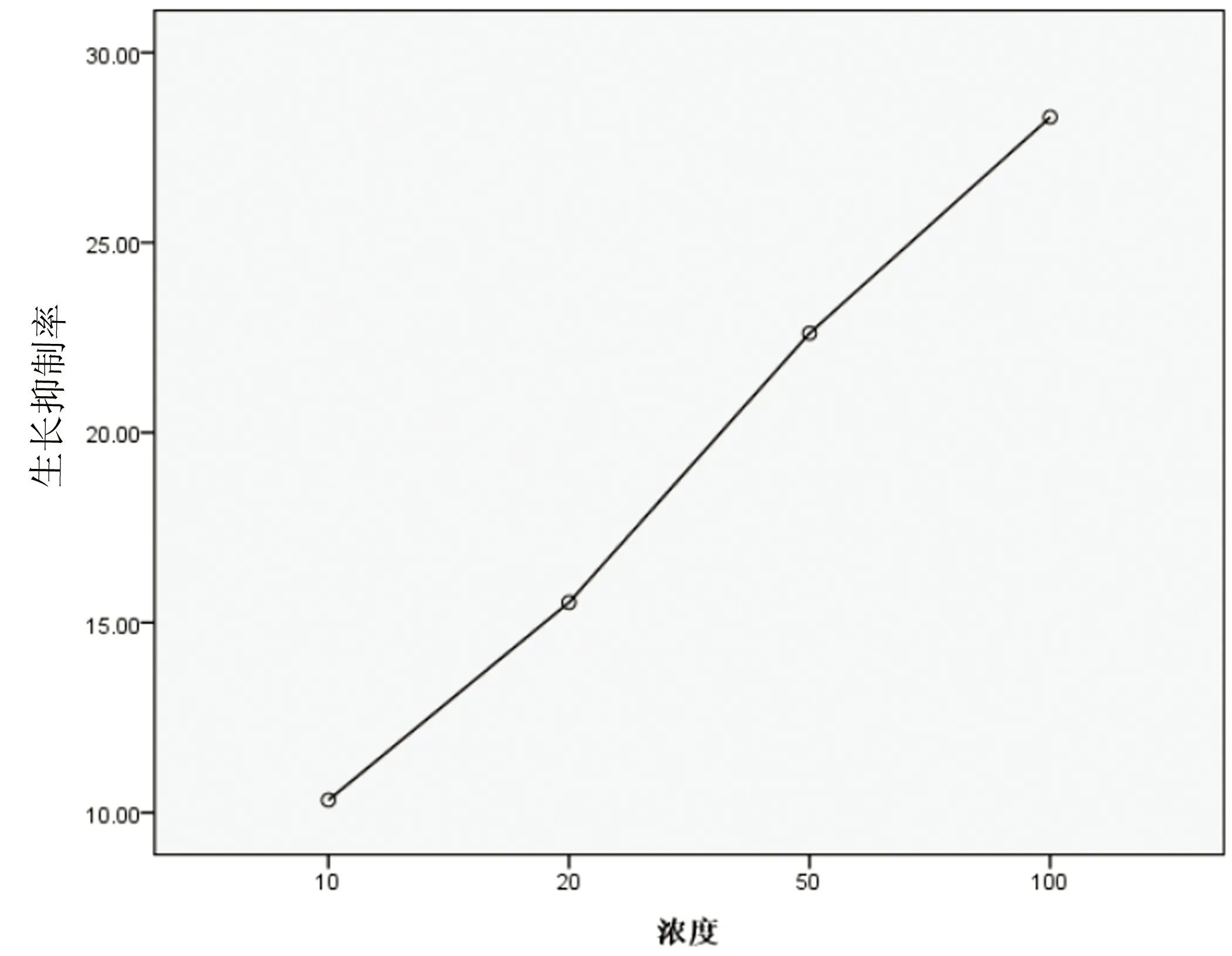
圖1 不同濃度ox-LDL作用細胞24 h細胞增殖情況

組別劑量生長抑制率(%)對照組oxLDL(100mg/L)28.30±0.73實驗組oxLDL+Ang(17)(10-9mol/L)22.55±0.821)oxLDL+Ang(17)(10-8mol/L)18.29±0.691)oxLDL+Ang(17)(10-7mol/L)13.23±0.601)oxLDL+Ang(17)(10-6mol/L)9.47±1.011) 與對照組比較,1)P<0.05。

注:1.ox-LDL;2.ox-LDL+Ang(1-7)(10-9mol/L);3.ox-LDL+Ang(1-7)(10-8mol/L);4.ox-LDL+Ang(1-7)(10-7mol/L);5.ox-LDL+Ang(1-7)(10-6mol/L)
圖2不同濃度Ang(1-7)作用細胞24 h細胞增殖情況
2.2實時定量PCR檢測LOX-1、ICAM-1、VCAM-1 mRNA SVAREC細胞經ox-LDL組(10 mg/L、20 mg/L、50 mg/L、100 mg/L)和ox-LDL(100 mg/L)+Ang(1-7)(10-9mol/L~10-6mol/L)組處理24 h后,用Real-time PCR檢測基因LOX-1、ICAM-1、VCAM-1mRNA的表達水平。溶解曲線分析結果顯示LOX-1、ICAM-1、VCAM-1mRNA引物均可以擴增出單一的產物,且未出現其他明顯異常的波形,波形銳利,提示特異性較好(見圖3~圖5)。ox-LDL組處理SVAREC細胞24 h后,LOX-1、ICAM-1及VCAM-1
mRNA表達量上升,與同時間對照組比較,差異有統計學意義(P<0.05)(見表3)。ox-LDL(100 mg/L)+Ang(1-7)(10-9mol/L~10-6mol/L)組處理24 h后,Ang(1-7)抑制ox-LDL的上述反應,LOX-1、ICAM-1及VCAM-1mRNA表達量下降(見表4)。
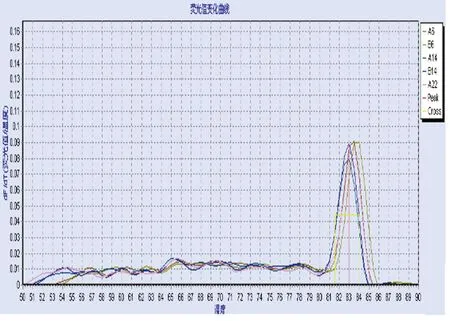
圖3 LOX-1溶解曲線

圖4 ICAM-1溶解曲線

圖5 VCAM-1溶解曲線
表3 ox-LDL組作用SVAREC細胞24 h基因表達水平(±s)
表4 ox-LDL(100 mg/L)+Ang(1-7)組處理SVAREC細胞24 h基因表達量(±s)
3討論
動脈粥樣硬化的發生機制十分復雜,但目前公認內皮細胞的損傷和功能障礙是AS發生的始動因素和中心環節。血管內皮受多種因素的影響,尤其是氧化低密度脂蛋白、腎素-血管緊張素系統、氧化應激、同型半胱氨酸等。近年來,愈來愈多的研究提示ox-LDL誘發的內皮功能障礙加速AS的形成,增加了心肌缺血再灌注損傷和急性心肌梗死,成為目前心血管疾病領域的一個研究熱點。
LOX-1是主要存在于血管內皮細胞上的ox-LDL特異受體。在氧化應激的作用下,形成了比LDL具有更高細胞毒性的ox-LDL,與內皮細胞表面的受體LOX-1特異性結合后,經過內吞作用而損傷細胞,導致其內皮功能失調,使血管內皮細胞(VEC)生成一氧化氮合酶(NOS)減少,分泌的NO量減少,血管收縮,血小板和白細胞在內膜損傷處黏附、聚集和啟動,VSMC增殖和內膜異常增生。VEC受損后,脆性增加,滲透性和黏附性增強,大量LDL進入內膜下沉積,經氧化形成ox-LDL,導致惡性循環。研究發現,內皮細胞與ox-LDL一起培養24 h后,內皮細胞參與構成細胞骨架微絲的破壞、斷裂,這一作用導致內皮細胞間隙增大,通透性增加,有利于脂粒分子穿過內皮層進入內皮下,這也是導致AS形成機制之一。ox-LDL可通過降低內皮合成和釋放NO使AS中內皮細胞對凋亡敏感。LOX-1的激活與內皮細胞、巨噬細胞和平滑肌細胞的凋亡均有關系,此過程是導致斑塊不穩定和急性冠脈綜合征發生的重要機制之一[6]。已有研究認為,ox-LDL與VEC間的是通過受體介導的。日本學者Swamura等1997年首先于牛主動脈內皮細胞上發現了LOX-1,它主要表達在及血管豐富組織的ox-LDL特異受體。在生理條件下LOX-1可以結合或吞噬已凋亡的細胞或者細菌等,發揮清道夫受體的功能;而在病理條件下,促炎因子、氧化應激、NO缺乏、流體剪切應力等多種刺激都可以誘導LOX-1介導內皮細胞對ox-LDL的吞納、降解及損傷作用[7]。
腎素-血管緊張素系統的過度激活在心血管病的發生、發展過程中有著十分重要的作用。目前研究發現Ang(1-7)具有擴張血管、降低血壓作用,抗血管再狹窄作用、抑制平滑肌細胞增殖,抗心肌肥厚、抑制心肌細胞肥大的作用,減輕心肌再灌流損傷和改善心肌梗死后心室重構,抗增殖以及利鈉、利尿,調節水、鹽及電解質平衡等作用。Loot等[8]對心力衰竭大鼠持續注射Ang(1-7)后發現,8周后就可以改善主動脈內皮功能,明顯增加了冠狀動脈血流量改善心臟功能。目前大量的循證醫學證明,ACEI具有保護血管內皮功能和心肌功能的作用,已經成為了治療心血管病的重要手段,它的作用可能是通過Ang(1-7)來實現,提示Ang(1-7)具有心肌和血管內皮的保護作用[9-10]。
本研究采用CCK-8和實時定量RT-PCR法從細胞和基因水平,觀察Ang(1-7)對ox-LDL誘導的大鼠主動脈內皮細胞LOX-1mRNA表達的影響。研究結果顯示隨著ox-LDL濃度的升高,ox-LDL可以呈劑量依賴性抑制SVAREC細胞的增殖,LOX-1、ICAM-1及VCAM-1mRNA表達量上升,并呈劑量依賴性,給予不同濃度的Ang(1-7)干預后,隨著Ang(1-7)的濃度升高,LOX-1、ICAM-1及VCAM-1mRNA表達量下降。本實驗從細胞和基因水平分別證實,Ang(1-7)可抑制內皮細胞LOX-1的表達,從而對內皮細胞可能起到保護作用。
本研究結果表明Ang(1-7)可抑制ox-LDL,從而顯示出其對血管內皮細胞可能具有保護作用,然而具體的作用機制有待進一步研究。
參考文獻:
[1]朱惠蓮,侯孟君,李燕,等.氧化型低密度脂蛋白經血凝素樣氧化型低密度脂蛋白受體1途徑誘導血管內皮細胞損傷[J].中國動脈硬化雜志,2004,12(4):383-386.
[2]Li DY,Zhang YC,Philipe I,et al.Upregulation of endothelial receptor for oxidized low-density lipoprotein (LOX-1) in cultured human artery endothelial cells by angiotensin Ⅱ type receptor activation[J].Circ Res,1999,84(9):1043-1049.
[3]Kucharewicr I,Pawlak R,Matys T,et al.Angiotensin(1-7):an active member of the rennin-angiotensin system[J].J Physiol Pharmacol,2002,53:533-540.
[4]Greenwood J,Heasman SJ,Alvarez JI,et al.Review: leucocyte-endothelial cell crosstalk at the blood-brain barrier: a prerequisite for successful immune cell entry to the brain [J].Neuropathology and Applied Neurobiology,2011,37(1):24-39.
[5]Mestas J,Ley K.Monocyte-endothelial cell interactions in the development of atherosclerosis[J].Trends Cardiovasc Med,2008,18:228-232.
[6]Grelli S,Spitalieri P,Filesi I,et al.Invivo and invitro studies support that a new splicing isoform of OLR1 gene is protective against acute myocardial infarction [J].Circ Res,2005,97(2):152-158.
[7]Sakurai K,Sawamura T.Stress and vascular response: endothelial dysfunction via lectin-like oxidized low-density lipoprotein receptor-1: close relationships with oxidative stress [J].J Pharmacol Sci,2003,91(3):182-186.
[8]Loot AE,Roks AJM,Henning RH,et al.Angiotensin1-7(1-7) attenuates the development of heart failure after myocardial infarction in rats [J].Circulation,2002,105(13): 1548-1550.
[9]馬虹.血管緊張素(1-7)的心血管調節作用[J].中華心血管雜志,2004,32(6):32-36.
[10]邊云飛,楊慧宇,楊志明.氧化型低密度脂蛋白對人臍靜脈內皮細胞Fraetalkine表達的影響及機制分析[J].中國動脈硬化雜志,2009,17(10):802-807.
(本文編輯薛妮)
Mechanisms of Angiotensin(1-7) on Aortic Endothelial Cell Injury Induced by Oxidized Low Density Lipoprotein in Rats
Du Ninghui,Yang Zhiming,Yang Huiyu
The Second Affiliated Clinical College,ShanXi Medical University,Taiyuan 030001,Shanxi,China
Abstract:Objective To investigate the effects of angiotensin (1-7) [Ang (1-7)] on expression levels of lectin like oxidized low-density lipoprotein receptor 1 (LOX-1), intercellular adhesion molecule-1(ICAM-1) and vascular cell adhesion molecule-1(VCAM-1) in SV40-transformed aortic rat endothelial cells (SVAREC) induced by oxidized low density lipoprotein(ox-LDL), and to explore its possible mechanism.MethodsCultured endothelial cells of rats were randomly divided into ox-LDL group and the ox-LDL+Ang-(1-7) group.The cell proliferation was detected by experimental Cell Counting Kit (CCK 8).The expression levels of LOX-1, ICAM-1, VCAM-1 mRNA were detected by fluorescent quantitative reverse transcription-polymerase chain reaction (RT-PCR) method.ResultsOx-LDL could inhibit SVAREC cell proliferation in a dose-dependent manner, and there was statistically significant compared with the control group (P<0.05).Compared with control group,SVAREC cell growth inhibition rate was reduced in Ox-LDL+Ang(1-7) group.With the increase of ox-LDL concentration, LOX-1, ICAM-1 and VCAM-1 mRNA expression increased, and in a dose-dependent manner, and there was statistically significant compared with the control group(P<0.05).With the increase of Ang(1-7), LOX-1, ICAM-1 and VCAM-1 mRNA expression decreased in Ox-LDL+Ang(1-7) group.ConclusionSVAREC ox-LDL can damage cells and LOX-1, ICAM-1 and increased VCAM-1mRNA expression and Ang(1-7) inhibition of ox-LDL of the reaction, and through the LOX-1, ICAM-1 and VCAM-1mRNA play a role.
Key words:angiotensin-(1-7);oxidized low density lipoprotein; lectin like oxidized low-density lipoprotein receptor 1; SV40-transformed aortic rat endothelial cells; vascular cell adhesion molecule-1; intercellular adhesion molecule-1
通訊作者:楊志明,E-mail: duyu56@126.com
中圖分類號:R543.5R256.2.
文獻標識碼:A
doi:10.3969/j.issn.1672-1349.2016.08.011
文章編號:1672-1349(2016)08-0833-05
Corresponding Author:Yang Zhiming
(收稿日期:2015-09-12)

