沉默NOX1表達對A549細胞增殖的影響>*
徐小艷,王曉衛,闕菡雅,王 娜,夏艷秋,薛 騰,燕 貞,周 舫#
1)鄭州大學公共衛生學院勞動衛生學教研室 鄭州 450001 2)周口職業技術學院衛生保健教研室 周口 466000 3)鄭州市疾病預防控制中心公共衛生科 鄭州 450000
沉默NOX1表達對A549細胞增殖的影響>*
徐小艷1),王曉衛2),闕菡雅3),王娜1),夏艷秋1),薛騰1),燕貞1),周舫1)#
1)鄭州大學公共衛生學院勞動衛生學教研室 鄭州 4500012)周口職業技術學院衛生保健教研室 周口 4660003)鄭州市疾病預防控制中心公共衛生科 鄭州 450000
關鍵詞A549細胞;ROS;NOX1;凋亡
摘要目的:探討NOX1對肺癌A549細胞凋亡和增殖的影響。方法:通過瞬時轉染技術轉染特異性的NOX1小干擾RNA(siRNA),按轉染情況分為Mock組、NC組、FAM-NC-NOX1 siRNA組,轉染12 h后采用Western blot檢測NOX1蛋白的表達,通過熒光探針DCFH-DA檢測細胞ROS水平,流式細胞儀檢測細胞增殖活性和凋亡率。結果:siRNA轉染12 h以上,轉染率穩定在80%以上,NOX1蛋白的表達量與Mock組相比下降(P<0.05);與Mock組相比, FAM-NC-NOX1 siRNA組細胞在24、36、48 h的增殖活性均下降,ROS水平也下降(P<0.05)。結論:NOX1 siRNA轉染A549細胞能有效抑制細胞的增殖。
國際癌癥研究中心報告[1]顯示:世界范圍內發病率和病死率最高的癌癥依然是肺癌,僅僅2012年全球新增肺癌患者約180萬,約159萬人死亡,中國所占的比例為1/3以上。腫瘤發生時,機體發生一系列的改變,腫瘤細胞的生長均需要活性氧(reactive oxygen species,ROS)的參與[2],一些腫瘤的治療手段也是通過改變ROS水平來達到治療目的[3]。NADPH氧化酶NOX家族是ROS的主要來源[4-5]。肺組織中NOX家族成員有不同程度的表達,其中NOX1的表達量在肺癌組織中高于正常組織[6]。A549細胞為人肺腺癌細胞,可以以穩定的形式傳代培養[7-8],因此選取A549細胞用于該研究,通過觀察NOX1在A549細胞增殖與凋亡中的作用,為肺癌的治療提供理論依據。
1材料與方法
1.1材料A549細胞購自中科院上海細胞生物研究所,NOX1小干擾RNA(siRNA)為上海吉瑪制藥有限公司提供,Sunriseremote酶標儀購于奧地利TECAN公司,DYCZ-24DN電泳儀購于北京市六一儀器廠,流式細胞儀購于美國BD公司,細胞凋亡檢測試劑盒購于德國美天妮公司,無支原體胎牛血清購于美國Gemini公司,RPMI 1640培養基購于北京索萊寶科技有限公司。所使用的siRNA核苷酸序列見表1。

表1 siRNA核苷酸序列
1.2NOX1 siRNA的轉染選取生長狀態良好的細胞進行NOX1 siRNA的轉染,轉染前24 h將細胞密度調整到0.8×105~1.0×105mL-1后接種至6孔板,每孔加2 mL 細胞懸液,采用Lipofectamine2000轉染試劑轉染NOX1 siRNA至A549細胞中。設置Mock組、NC組和FAM-NC-NOX1 siRNA組,其中Mock組只加轉染試劑,NC組轉染NC-NOX1 siRNA,FAM-NC-NOX1 siRNA組轉染FAM-NC-NOX1 siRNA。嚴格按照說明書轉染步驟操作。重復測定3次,確定轉染條件使其轉染率能穩定在80%以上。
1.3Western blot檢測NOX1蛋白的表達轉染24 h后,提取各組總蛋白,調整上樣量為每組25 μg,按比例稀釋蛋白樣品和上樣緩沖液后95 ℃ 5 min。進行聚丙烯酰胺凝膠電泳,轉膜后用50 g/L脫脂奶液37 ℃封閉2 h,TBST洗3次,每次10 min,一抗過夜后TBST洗3次,然后加二抗37 ℃孵育2 h,再次TBST洗3次后,加入適量ECL發光液,用Image600進行曝光、測定。實驗重復3次。
1.4細胞增殖活性測定調整A549細胞密度至5×104mL-1,接種至96孔板,每組5個復孔,每孔加細胞懸液200 μL,放入CO2恒溫培養箱中培養。轉染后12、24、36、48 h,加入20 μL稀釋好的MTT 溶液,CO2恒溫培養箱中繼續孵育4 h,小心吸去上清液,每孔加150 μL的DMSO,勻速搖晃10 min,用酶標儀檢測492 nm處各孔吸光度值。
1.5DCFH-DA法檢測細胞內ROS水平利用熒光探針DCFH-DA進行A549細胞ROS的檢測。調整細胞密度為1.0×105mL-1,按照實驗分組將A549細胞培養于6孔板中,轉染48 h后,按DCFH-DA終濃度為10 μmol/L加樣;把細胞清洗并消化后,用稀釋好的探針重懸細胞,置于37 ℃細胞培養箱中孵育30 min,每隔3~5 min顛倒混勻一次,使探針與細胞充分接觸;用PBS洗滌細胞3次,以除去未進入細胞的DCFH-DA;用0.5 mL 的PBS重懸細胞,用流式細胞儀488 nm激發波長、525 nm發射波長,FL1收集DCF的熒光信號,根據收集的熒光信號所在的峰位置及大小表示ROS表達的水平。實驗重復3次。
1.6流式細胞儀檢測細胞凋亡率各組細胞轉染48 h后,將細胞消化,加入Binding Buffer 1 mL,1 000 r/min離心,重復1次。加入Binding Buffer 100 μL吹打混勻,加入10 μL Annexin V-FITC避光混勻后放置15 min。用500 μL Binding Buffer重懸細胞后加入5 μL PI,立即上流式細胞儀檢測各組細胞凋亡率。實驗重復3次。
1.7統計學處理采用SPSS 21.0對數據進行統計學分析。不同組間NOX1相對表達量和ROS水平以及凋亡率的比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
2結果
2.1A549細胞轉染NOX1 siRNA的轉染率轉染12 h后,在熒光顯微鏡下觀察轉染FAM-NC-NOX1 siRNA的A549細胞,結果見圖1。

A:Mock組;B:NC組;C:FAM-NC-NOX1 siRNA組。圖1 瞬時轉染12 h后熒光顯微鏡下的A549細胞(×200)
2.2抑制NOX1表達后A549細胞增殖活性的改變結果見圖2。
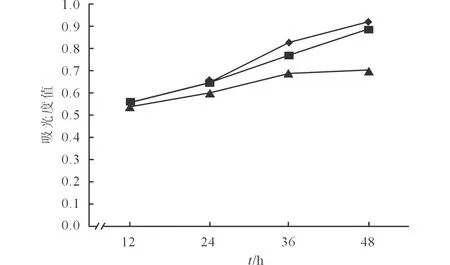
-◆-:Mock組;-■-:NC組;-▲-:FAM-NC-NOX1 siRNA組。圖2 轉染后不同時間各組細胞的吸光度值
2.3不同處理組A549細胞ROS水平、NOX1相對表達量及凋亡率的比較結果顯示,FAM-NC-NOX1 siRNA組NOX1蛋白表達低于Mock組和NC組;與Mock組和NC組相比, FAM-NC-NOX1 siRNA組ROS水平下降;3組之間凋亡率比較,差異無統計學意義。見圖3、表2。

1:Mock組;2:NC組;3:FAM-NC-NOX1 siRNA組。圖3 Western blot檢測各組A549細胞NOX1蛋白的表達

組別ROS水平NOX1相對表達量凋亡率/%Mock組524.00±31.651.00±0.023.57±0.26NC組472.33±29.860.92±0.052.90±0.17FAM-NC-NOX1siRNA組180.16±25.60*0.28±0.03*3.90±0.35F48.089350.9523.756P<0.001<0.0010.110
*:與Mock組和NC組相比,P<0.05。
3討論
隨著人們生活水平的提高,環境污染的加劇,生活壓力的加大,腫瘤的發病率也在上升,其中肺癌尤為明顯。研究[2,9-11]表明,肺癌的發生發展過程與ROS有著密切的聯系,且目前已經明確的化學致癌物、電離和紫外輻射均能使細胞內的ROS水平升高,許多原發性腫瘤和細胞系的ROS水平均高于正常組織的表達水平。
研究[12]表明,NOX1和腫瘤的發生密切相關。Suh等[13]首次將NOX1質粒轉染至無胸腺的小鼠后小鼠表皮形成了腫瘤,這就表明其具有促進腫瘤生成的可能,所以該實驗選擇觀察NOX1抑制對A549細胞凋亡和增殖的影響。結果顯示,細胞轉染率穩定在80%以上,說明NOX1 siRNA成功導入到了A549細胞中;另外,FAM-NC-NOX1 siRNA組NOX1蛋白的表達水平明顯下降,說明實驗選取的NOX1干擾序列沉默效果良好,可以有效抑制NOX1的表達。
NOX1 siRNA成功抑制A549細胞NOX1的表達后,用MTT法檢測細胞的增殖活性,發現NOX1被抑制24、36、48 h后細胞的增殖活性均下降,但是在12 h時增殖活性并無變化,說明在24 h后才能抑制A549細胞的增殖活性,所以之后的實驗中選擇了NOX1 siRNA轉染24 h后觀察細胞。ROS在肺部腫瘤的各個階段均發揮作用,在腫瘤的形成階段,ROS可能激活了原癌基因如c-Jun和c-Fos,而c-Jun的過表達與肺癌有著直接的關系[14]。為了觀察NOX是否通過產生ROS來影響A549細胞的增殖活性,作者選用DCFH-DA法檢測ROS水平,從結果可以看出ROS水平和細胞增殖活性的變化趨勢是一致的,說明NOX1可能通過調節ROS水平來調節A549細胞的增殖活性。
為了探討NOX1抑制對A549細胞凋亡的影響,作者采用流式細胞儀來檢測細胞凋亡率,從結果可以看出,細胞的凋亡并未發生變化。一般來說,細胞增殖活性的降低伴隨著凋亡的升高,但是該結果顯示NOX1表達量及ROS水平的下降使細胞增殖活性下降,但并未能促進A549細胞凋亡率的增加。這可能是由于ROS水平下降后,使其細胞周期受到阻滯,從而導致其增殖活性的下降,而降低后的ROS水平仍足以支持A549細胞的存活,且在A549細胞中NOX家族的其他成員均有表達,可能其之間存在交互作用,共同調控細胞的凋亡通路。
綜上所述,NOX1 siRNA可以有效抑制NOX1的表達,NOX1表達受抑制后,隨著A549細胞中ROS水平的下降,細胞的增殖活性也下降,但是細胞凋亡水平未發生改變,其機制尚未明確,需要進一步研究證實。
參考文獻
[1]International Agency for Research on Cancer.World cancer report 2014[R].Geneva:WHO,2014.
[2]JOHNSON B,CHANDRA J.EGFR-initated NADPH oxidase activity regulates Fyn expression in glioblastoma multiforme[J].Cancer Res,2014,74(19):511
[3]LU JM,RISBOOD P,KANE CT,et al.Development of potent NADPH oxidase inhibitors with significant activity against colon cancer[J].Cancer Res,2014,74(19):4750
[4]EL-NAGA RN.Pre-treatment with cardamonin protects against cisplatin-induced nephrotoxicity in rats: impact on NOX-1, inflammation and apoptosis[J].Toxicol Appl Pharmacol,2014,274(1):87
[5]BROWN DI,GRIENDLING KK.Nox proteins in signal transduction[J].Free Radic Biol Med,2009,47(9):1239
[6]JUHASZ A,GE Y,MARKEL S,et al.Expression of NADPH oxidase homologues and accessory genes in human cancer cell lines, tumours and adjacent normal tissues[J].Free Radic Res,2009,43(6):523
[7]王小龍,馮斐斐,孫鵬輝,等.HSP70、JNK和p38在放線菌素D誘導的A549細胞凋亡中的作用[J].鄭州大學學報(醫學版),2014,49(5):668
[8]闕菡雅,王小龍,李杰,等.沉默熱休克蛋白70基因對 A549細胞凋亡的影響[J].鄭州大學學報(醫學版),2015,50(5):641
[9]ROY K,WU Y,MEITZLER JL,et al.NADPH oxidases and cancer[J].Clin Sci (Lond),2015,128(12):863
[10]BAUER G,ZARKOVIC N.Revealing mechanisms of selective, concentration-dependent potentials of 4-hydroxy-2-nonenal to induce apoptosis in cancer cells through inactivation of membrane-associated catalase[J].Free Radic Biol Med,2015,81:128
[11]WU YZ,DOROSHOW JH.IL-4/IL-13 induce Duox2/DuoxA2 expression and reactive oxygen production in human pancreatic and colon cancer cells[J].Cancer Res,2014,74(19):5358
[12]LIU X,PEI C,YAN S,et al.NADPH oxidase 1-dependent ROS is crucial for TLR4 signaling to promote tumor metastasis of non-small cell lung cancer[J].Tumour Biol,2015,36(3):1493
[13]SUH YA,ARNOLD RS,LASSEGUE B,et al.Cell transformation by the superoxide-generating oxidase Mox1[J].Nature,1999,401(6748):79
[14]VAN DEN BERG MC,VAN GOGH IJ,SMITS AM,et al.The small GTPase RALA controls c-Jun N-terminal kinase-mediated FOXO activation by regulation of a JIP1 scaffold complex[J].J Biol Chem,2013,288(30):21729
Effect of silencing NOX1 on proliferation of A549 cells
XUXiaoyan1),WANGXiaowei2),QUEHanya3),WANGNa1),XIAYanqiu1),XUETeng1),YANZhen1),ZHOUFang1)
1)DepartmentofOccupationalHealth,CollegeofPublicHealth,ZhengzhouUniversity,Zhengzhou4500012)DepartmentofHygiene,ZhoukouVocationalandTechnicalCollege,Zhoukou4660003)DepartmentofPublicHealth,CenterforDiseasePreventionandControlofZhengzhou,Zhengzhou450000
Key wordsA549 cell;ROS;NOX1;apoptosis
AbstractAim: To explore the proliferation and apoptosis in A549 cells after down-regulating NOX1 expression.Methods: NOX1 interference in A549 cells was achieved by NOX1 small interference RNA(siRNA). A549 cells were allocated into Mock group, NC group, and FAM-NC-NOX1 siRNA group. Being transfected specifically through the transient transfection technology about 12 h,the expression of NOX1 protein was detected by Western blot,then the fluorescent probe DCFH-DA was used to detect the ROS levels of cells,the flow cytometry was used to detect the changes of cell proliferation activity and apoptosis.Results: The transfection efficiency of NOX1 siRNA was above 80% in A549 cells. Compared with the Mock group,NOX1 protein expression was decreased, the cell viability was decreased at 24, 36, 48 h after transfection,and the ROS level in FAM-NC-NOX1 siRNA group was decreased(P<0.05).Conclusion: NOX siRNA transfection could effectively inhibit the proliferation of A549 cells.
doi:10.13705/j.issn.1671-6825.2016.03.011
#通信作者,女,1974年7月生,博士,教授,研究方向:職業腫瘤和應激醫學,E-mail:zhoufang23@sina.com
中圖分類號R730.1
*河南省高等學校重點科研項目16A330008

