細胞穿透肽CCL融合蛋白的構(gòu)建與表達
劉 勇,安艷芳,王仲霞,楊建業(yè),吳 君
(1南方醫(yī)科大學深圳醫(yī)院,廣東 深圳 518101; 2 湖北醫(yī)藥學院附屬人民醫(yī)院,湖北 十堰 442000)
?
細胞穿透肽CCL融合蛋白的構(gòu)建與表達
劉勇1,2,安艷芳2,王仲霞2,楊建業(yè)2,吳君2
(1南方醫(yī)科大學深圳醫(yī)院,廣東 深圳518101; 2 湖北醫(yī)藥學院附屬人民醫(yī)院,湖北 十堰442000)
[摘要]目的評估細胞穿透肽CCL融合蛋白構(gòu)建的可能性。方法將CCL6-PEP-6XHis構(gòu)建至pABP質(zhì)粒,然后提取pABP-CCL6-PEP質(zhì)粒進行人胚腎HEK293細胞轉(zhuǎn)染表達,以及CCL6-PEP-6XHis 蛋白層析純化和檢測。結(jié)果成功構(gòu)建并純化細胞穿透肽CCL融合蛋白。將CCL6-PEP-6XHis Tag 基因經(jīng)PCR擴增、接入T 載體、克隆、培養(yǎng),并提取質(zhì)粒進行測序鑒定,所得序列與目的基因一致。成功將CCL6-PEP-6XHis基因構(gòu)建至哺乳動物細胞表達載體pABP 中,經(jīng)質(zhì)粒提取和酶切鑒定,電泳結(jié)果顯示,HindⅢ + XbaⅠ切出約430 bp的條帶,符合預期,酶切鑒定正確。蛋白質(zhì)印跡法(Western Blot)檢測結(jié)果陽性,表明純化得到的目標蛋白帶有hisx6標簽。結(jié)論細胞穿透肽CCL融合蛋白能夠人工構(gòu)建,并通過真核細胞進行表達。
[關鍵詞]細胞穿透肽; CCL; 基因表達; 重組融合蛋白質(zhì)
[Chin J Infect Control,2016,15(6):361-366]
由于多重耐藥菌傳播快,開發(fā)新的抗菌藥物迫在眉捷,是重要的醫(yī)學問題[1]。抗菌肽(antibacterial peptides)是廣泛存在于動植物體內(nèi),具有一定抗菌譜的小分子肽,是哺乳動物抗感染防御中的重要成分,可參與先天免疫和炎性應答諸多方面,具有保守的信號轉(zhuǎn)導通路[2-6]。CCL6是抗微生物肽(AMP)的重要一員,在腸道等器官大量分布,易于提取,是具有臨床潛力的藥物之一[7-8]。但CCL6由于分子小,易被蛋白酶降解,限制了其臨床應用。利用新型技術提高抗菌肽的穿透力,是抗菌肽研究的熱點和關鍵問題[7,9]。假設細胞穿透肽也可以促進抗菌肽的定位及提高局部濃度,從而可大幅度提高抗菌肽的體內(nèi)外抗菌活性。本研究評估構(gòu)建細胞穿透肽CCL6融合蛋白的可能性。
1材料與方法
1.1實驗材料人胚腎HEK293細胞(ATCC,Catalog #CRL21573) 為本研究室保存。大腸埃希菌DH5α、質(zhì)粒pSectagA、pEGFP2C1、哺乳動物細胞表達載體pABP、CD 293 TGE medium、(cat#CM-1156) BP fectin轉(zhuǎn)染試劑購自北京百普賽斯生物科技有限公司,其他試劑均為國產(chǎn)分析純。
1.2方法
1.2.1CCL6-PEP-6XHis基因密碼子優(yōu)化及合成在Pubmed上查詢CCL6及PEP蛋白基因序列,利用Premier Primer軟件進行密碼子優(yōu)化后,設計合成的CCL6-PEP-6XHis Tag基因,再根據(jù)目的基因設計引物進行聚合酶鏈反應(PCR)。切膠回收目的片段,將PCR 產(chǎn)物連入T 載體,挑取克隆進行培養(yǎng),提取質(zhì)粒進行測序鑒定。通過比對,獲得正確的CCL6-PEP-6XHis 基因序列。
1.2.2質(zhì)粒pABP-CCL6-PEP重組和酶切、測序鑒定CCL6-PEP基因片段以Hind Ⅲ和入XbaⅠ雙酶切,并與同樣酶切的pABP載體于14℃連接過夜, 連接產(chǎn)物轉(zhuǎn)入50 μL Top10 感受態(tài)細胞,挑取4個單菌落過夜振蕩培養(yǎng)后,提取質(zhì)粒并進行酶切鑒定。反應均按常規(guī)方法操作,利用Primer軟件設計添加含Hind Ⅲ和入XbaⅠ酶切位點的CCL6-PEP-6Xhis的產(chǎn)物引物,并利用所設計引物進行PCR。將PCR產(chǎn)物導入pABP HindⅢ + XbaⅠ酶切線性化載體,再將連接產(chǎn)物轉(zhuǎn)入50 μL Top10 感受態(tài)細胞,接種平板過夜培養(yǎng),挑取若干單菌落過夜振蕩培養(yǎng)后,提取質(zhì)粒;對所提質(zhì)粒進行Hind Ⅲ + XbaⅠ酶切鑒定,并進行測序鑒定。
1.2.3CCL6-PEP-6XHis質(zhì)粒制備與瞬時轉(zhuǎn)染將鑒定正確的質(zhì)粒轉(zhuǎn)化到DH5a菌中,接種平皿挑取單菌落放大培養(yǎng),并用DNA提取試劑盒制備轉(zhuǎn)染用質(zhì)粒DNA。將HEK293細胞以0.5×106cells/mL 接種密度接種至 3 L細胞培養(yǎng)反應器中,初始工作體積為1.2 L,培養(yǎng)溫度37℃攪拌轉(zhuǎn)速150 r/min。當活細胞密度達(1.5~2.0)×106cells/mL 時, 用0.8 L 的新鮮無血清/化學成分界定培養(yǎng)基(CD 293 TGE medium)稀釋至終體積為2.4 L。活細胞密度稀釋后15 h再度達到(1.5~2.0)×106cells/mL 時,用BP fectin作為轉(zhuǎn)染試劑,以3 μL轉(zhuǎn)染試劑/106細胞, 和1 μL DNA/106細胞的劑量轉(zhuǎn)染細胞。轉(zhuǎn)染復合物根據(jù)ACRO Biosystems 說明書進行,并在轉(zhuǎn)染24 h后,以5%/5% (V/V) 比例加入Feed X Supplement補料, 并在轉(zhuǎn)染24 h 和96 h后分別加入ACRO Biosystems 20 mmol/L 及4 mmol/L葡萄糖和谷氨酰胺濃縮液。整個細胞培養(yǎng)過程中,每天觀察計數(shù)細胞,并在轉(zhuǎn)染后收獲HEK293細胞培養(yǎng)液。
1.2.4CCL6-PEP-6XHis蛋白的層析純化和檢測收集無血清細胞培養(yǎng)液,經(jīng)低速離心去除細胞和細胞碎片,所得培養(yǎng)液上清采用0.45 μm濾膜過濾、澄清,去除細胞碎片顆粒,使用5 mL金屬螯合親和層析進行分離,依次采用40、100、250 和500 mmol/L咪唑階段梯度進行洗脫,對洗脫物進行SDS-PAGE 電泳檢測。然后使用Anti-hisx6 抗體對Peak4(峰4)進行蛋白質(zhì)印跡法(Western Blot)檢測。
2結(jié)果
2.1CCL6-PEP-6XHis基因密碼子優(yōu)化及合成經(jīng)過Primer軟件進行密碼子優(yōu)化后,需要合成的CCL6-PEP-6XHis Tag 基因見圖1~2。針對該序列共設計18條引物(CCL6-01、02……18 )進行PCR擴增,切膠回收目的片段,連接PCR產(chǎn)物入T 載體,挑取若干克隆進行培養(yǎng),并提取質(zhì)粒進行測序鑒定,所得序列符合目的基因。

藍色部分:mouse CCL6 序列;紅色部分:PEP1 序列;黃色部分:6XHis Tag 序列
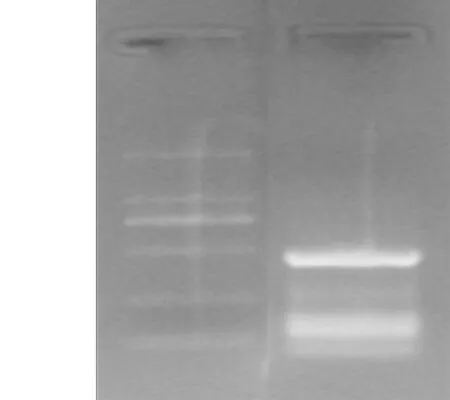
圖2 CCL6-PEP-6XHis基因PCR產(chǎn)物電泳圖
Figure 2Electrophoretogram of PCR product of CCL6-PEP-6XHis gene
2.2質(zhì)粒pABP-CCL6-PEP 重組成功將CCL6-PEP-6XHis基因構(gòu)建至哺乳動物細胞表達載體pABP 中。設計載體構(gòu)建引物,設計的引物進行PCR 擴增。見表1、圖3。
2.3細胞轉(zhuǎn)導PCR產(chǎn)物導入pABP Hind Ⅲ + XbaⅠ酶切線性化載體,再將連接產(chǎn)物轉(zhuǎn)入50 μL Top10 感受態(tài)細胞,接種平板過夜培養(yǎng)。隔夜培養(yǎng)平板培養(yǎng)出>100 個單菌落。見圖4。

表1 設計載體構(gòu)建引物
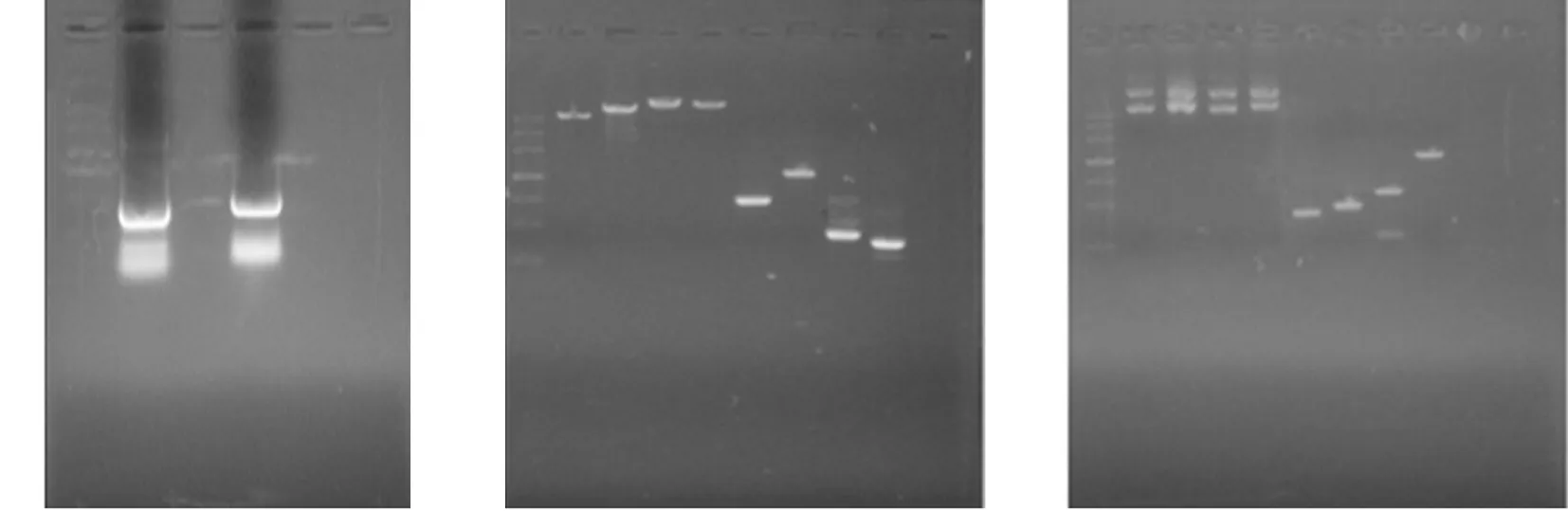
A:PCR粗產(chǎn)物;B:回收產(chǎn)物;C:酶切后產(chǎn)物
Figure 3Electrophoretogram of PCR product, extracted PCR product, and restriction enzyme-digested PCR product of pABP-CCL6-PEP gene
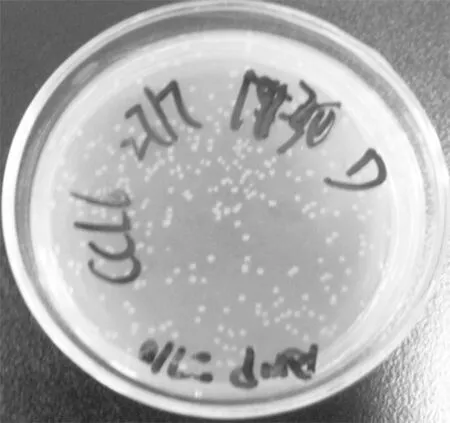
圖4 質(zhì)粒pABP-CCL6-PEP重組克隆隔夜培養(yǎng)平板
Figure 4Overnight incubated plates of recombinant clones of plasmid pABP-CCL6-PEP
2.3.1酶切鑒定挑取4 個單菌落過夜振蕩培養(yǎng)后,提取質(zhì)粒,對所提的4 管質(zhì)粒進行酶切鑒定,電泳結(jié)果顯示,HindⅢ + XbaⅠ切出約430 bp的條帶,符合預期,表明酶切鑒定正確。見圖5。
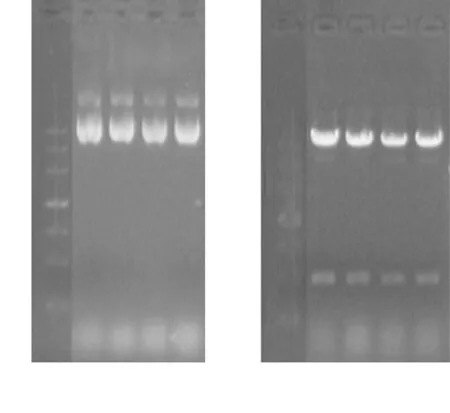
圖5 質(zhì)粒pABP-CCL6-PEP及其酶切鑒定電泳圖
Figure 5Electrophoretogram of plasmid pABP-CCL6-PEP and restriction enzyme digestion
2.3.2表達載體測序結(jié)果對表達載體pABP-CCL6-PEP進行測序鑒定,比對結(jié)果表明,測序完全正確,符合設計。見圖6。
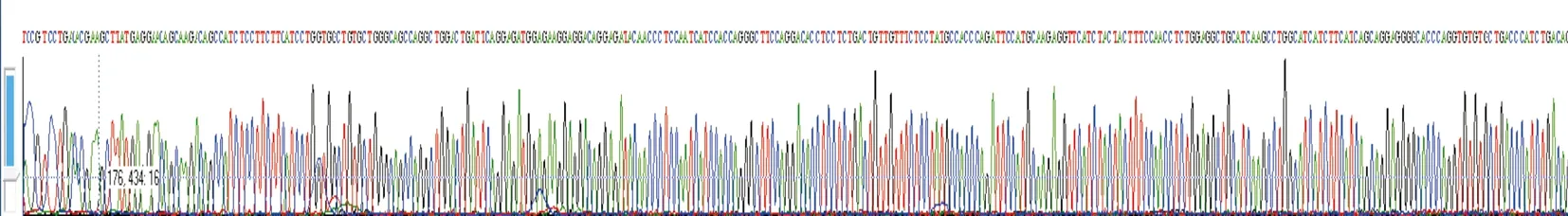
圖6 pABP-CCL6-PEP基因測序圖
2.4CCL6-PEP-6XHis質(zhì)粒制備與瞬時轉(zhuǎn)染
2.4.1CCL6-PEP-6XHis質(zhì)粒制備將鑒定正確的質(zhì)粒轉(zhuǎn)化到DH5a菌中,接種平皿培養(yǎng)后挑取單菌落放大培養(yǎng),并用DNA提取試劑盒制備轉(zhuǎn)染用質(zhì)粒DNA。提取質(zhì)粒名稱CCL6-PEP-6XHis,DNA比光度為1.82,數(shù)量為13.2,轉(zhuǎn)染DNA為3.8 mg。
2.4.2細胞培養(yǎng)與瞬時轉(zhuǎn)染細胞培養(yǎng)進行轉(zhuǎn)染后的生長曲線見圖7。細胞峰活細胞密度(Peak VCD)達4.8 million/mL,總細胞密度(TCD)達7.66 million/mL,活細胞比VCD/TCD為63%。
2.5CCL6-PEP-6XHis蛋白的層析純化和檢測
2.5.1CCL6-PEP-6XHis蛋白層析純化約2.8 L無血清細胞培養(yǎng)液經(jīng)過15 min低速離心(4 000 r/min)去除細胞和細胞碎片,依次采用不同濃度咪唑階段梯度進行洗脫,層析分離圖譜見圖8。以上金屬螯合親和層析收集各洗脫峰,SDS-PAGE還原電泳檢測。峰4(P4)為500 mmol/L咪唑洗脫后所得目標蛋白。總細胞上清液為2 650 mL,目標蛋白約43 mL,根據(jù)紫外分光儀波長280 nm檢測,目標蛋白低于最低檢測閾值。
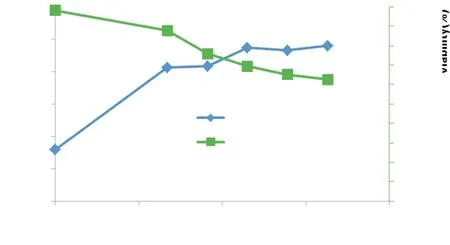
圖7CCL6-PEP-6XHis質(zhì)粒在HEK293細胞中瞬時表達生長曲線
Figure 7Growth curve of transient expression of plasmid CCL6-PEP-6XHis in HEK293 cell
2.5.2目標蛋白SDS-PAGE電泳分析根據(jù)SDS-PAGE電泳分析(見圖9),目標蛋白(約15 kD)與金屬螯合填料(IMAC)結(jié)合較強,需使用500 mmol/L 咪唑洗脫(P4)。根據(jù)電泳條帶估計,純化得到0.05~0.1 mg痕量目標蛋白,當前方案的表達量較低。
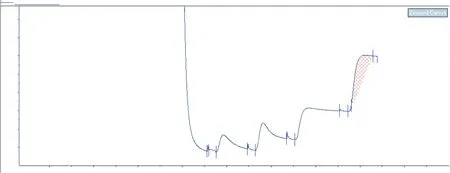
圖8 CCL6-PEP-6XHis蛋白金屬螯合親和層析分離純化層析圖譜
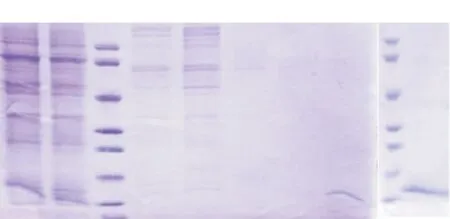
柱M:蛋白Marker;柱1:細胞培養(yǎng)上清液;柱2:未洗脫前離心液;柱3—5: 分別為40、100、250 mmol/L 咪唑洗脫后;柱6:第三峰(P3)尾峰的250 mmol/L咪唑洗脫后;柱7—8: 500 mmol/L 咪唑洗脫后 (CCL-PEP-6XHis),其中柱8采用20倍濃縮
圖9CCL6-PEP-6XHis蛋白層析分離純化還原電泳分析圖
Figure 9Electrophoretogram of chromatographic separation and purification of CCL6-PEP-6XHis protein
2.6CCL6-PEP-6XHis蛋白Western Blot檢測使用Anti-hisx6抗體對P4進行Western Blot檢測,結(jié)果確定為陽性,表明純化得到的目標蛋白帶有hisx6標簽,但由于濃度較低,顯色條帶肉眼觀察較淺。見圖10。

1泳道:陽性對照;2泳道:空白對照; 3泳道:Marker; 4泳道:洗脫后的P4
圖10CCL6-PEP-6XHis蛋白Western Blot 檢測結(jié)果
Figure 10Western Blot analysis on CCL6-PEP-6XHis protein
3討論
多重耐藥菌是臨床期待解決的問題。腸道分泌的CCL6具有廣泛抗病原體作用,且對人體無害,是一種理想的候選抗菌藥物[7,10-12]。但CCL6由于分子小,易被蛋白酶降解,限制了其臨床應用。利用新型技術提高抗菌肽的穿透力,是抗菌肽研究的熱點和關鍵問題。本研究成功構(gòu)建了細胞穿透肽CCL6融合蛋白,為進一步高表達目的蛋白及體內(nèi)外實驗奠定了基礎。
研究[13]表明,HEK293細胞是比較理想的宿主細胞。本課題中的CCL6由于具有殺菌作用,不宜于采用傳統(tǒng)的大腸埃希菌培養(yǎng)。初試中載體細菌起初濃度呈指數(shù)增加,但隨時間進展,尤其3 d后數(shù)量又呈指數(shù)下降,大腸埃希菌表達的CCL6由于自身的殺傷作用導致產(chǎn)量低下。表明CCL6具有強大的殺菌作用,且與濃度呈正相關,大腸埃希菌并非其理想表達系統(tǒng)。由于CCL6機制主要為破壞細菌細胞壁,因而對細胞無損傷[10]。本組研究采用HEK 293細胞作為宿主細胞,避免了對宿主的破壞,提高了蛋白的產(chǎn)出率。
CCL6的最低抑菌濃度值較高,達到理想殺菌效果的濃度需100 nmoL左右,表明CCL6的細胞壁穿透能力有待進一步提高。該濃度的CCL6價格昂貴,限制了其在臨床廣泛使用。因而增強CCL6的透壁能力十分必要。PEP-1是一種穿透蛋白,能夠增強靶分子的細胞壁穿透能力。既往研究[14-15]表明,PEP-1能夠增強靶蛋白的穿透能力,提高生物活性,如SOD,EGFP和過氧化氫酶等。理論上PEP-1可以提高CCL6的穿壁能力,但能夠提高CCL6的穿壁能力是否一定提高殺菌能力尚需要進一步研究。本研究為進一步評估CCL6的殺菌機制,開發(fā)新一代抗菌素奠定了技術基礎。本研究的限制之處為靶蛋白的濃度和產(chǎn)量還不夠高,未來實驗中需要予以進一步改良和優(yōu)化。
[參 考 文 獻]
[1]Wittekamp BH, Bonten MJ. Antibiotic prophylaxis in the era of multidrug-resistant bacteria [J]. Expert Opin Investig Drugs, 2012,21(6):767-772.
[2]Vila-Farrés X, Giralt E, Vila J. Update of peptides with antibacterial activity [J]. Curr Med Chem, 2012,19 (36):6188-6198.
[3]Liao Z, Wang XC, Liu HH, et al. Molecular characterization of a novel antimicrobial peptide from Mytilus coruscus [J]. Fish Shellfish Immunol, 2013, 34 (2):610-616.
[4]Gottschalk S, Gottlieb CT, Vestergaard M, et al. Amphibian antimicrobial peptide fallaxin analogue FL9 affects virulence gene expression and DNA replication inStaphylococcusaureus[J]. J Med Microbiol, 2015, 64(12): 1504- 1513.
[5]Chen B, Fan DQ, Zhu KX, et al. Mechanism study on a new antimicrobial peptide Sphistin derived from the N-terminus of crab histone H2A identified in haemolymphs of Scylla paramamosain [J]. Fish Shellfish Immunol, 2015,47(2): 833-846.
[6]Goh HF, Philip K. Purification and characterization of bacteriocin produced by weissella confusa A3 of dairy origin [J]. PloS one, 2015,10(10):e0140434.
[7]Kotarsky K, Sitnik KM, Stenstad H, et al. A novel role for constitutively expressed epithelial-derived chemokines as antibacterial peptides in the intestinal mucosa [J]. Mucosal Immunol, 2010,3(1):40-48.
[8]Liu JY, Li F, Wang LP, et al. CTL-vs Treg lymphocyte-attracting chemokines, CCL4 and CCL20, are strong reciprocal predictive markers for survival of patients with oesophageal squamous cell carcinoma [J]. Br J Cancer, 2015,113(5):747-755.
[9]Zhang YE, Wang JN, Tang JM, et al. In vivo protein transduction: delivery of PEP-1-SOD1 fusion protein into myocardium efficiently protects against ischemic insult [J]. Mol Cells, 2009,27(2):159-166.
[10] Bukharin OV, Valyshev AV. mechanisms of resistance ofenterococcito antimicrobial proteins and peptides [J]. Zh Mikrobiol Epidemiol Immunobiol, 2012,5:89-94.
[11] Corrales-Garcia L, Ortiz E, Castaeda-Delgado J, et al. Bacterial expression and activities of recombinant variants of human β-defensins on pathogenic bacteria andM.tuberculosis[J]. Protein Expr Purif, 2013,89 (1):33-43.
[12] Hu H, Wang C, Guo X, et al. Broad activity against porcine bacterial pathogens displayed by two insect antimicrobial peptides moricin and cecropin B [J]. Mol Cells, 2013,35(2):106-114.
[13] Chumanov RS, Kuhn PA, Xu W, et al. Expression and purification of full-length mouse CARM1 from transiently transfected HEK293T cells using Halo Tag technology [J]. Protein Expr Purif, 2011,76(2):145-153.
[14] 黃光慶,王家寧, 唐俊明,等. 細胞穿透肽 PEP-1介導過氧化氫酶轉(zhuǎn)導大鼠心肌H9C2細胞 [J]. 鄖陽醫(yī)學院學報, 2010,29(2):103-107.
[15] 張永軍,王家寧,唐俊明,等. PEP-1-CAT融合蛋白預處理對在體大鼠心肌缺血再灌注損傷的保護作用 [J]. 南方醫(yī)科大學學報, 2009,29(12):2429-2432.
(本文編輯:左雙燕)
Construction and expression of cell-penetrating peptide CCL fusion protein expression vector
LIUYong1,2,ANYan-fang2,WANGZhong-xia2,YANGJian-ye2,WUJun2
(1ShenzhenHospitalofSouthernMedicalUniversity,Shenzhen518101,China; 2RenminHospitalAffiliatedtoHubeiUniversityofMedicine,Shiyan442000,China)
[Abstract]ObjectiveTo evaluate the construction of expression vector for fusion protein of cell-penetrating peptide CCL (PEP-CCL). MethodsCCL6-PEP-6XHis was inserted into plasmid pABP, pABP-CCL6-PEP plasmid was extracted and then transfected into HEK293 cells, CCL6-PEP-6XHis was expressed and purified by chromatography and detected with Western Blot. ResultsPEP-CCL express vector was successfully constructed and purified. PCR product of CCL6-PEP-6XHis Tag was ligated with T vector, recombinant was transferred into the host cells, then host cells were cultured, plasmid was extracted and sequenced, the sequence was identical to targeted gene. CCL6-PEP-6XHis was successfully inserted into the eukaryotic expression vector pABP, plasmid was extracted and digested, electrophoresis results revealed that a fragment with 430bp was digested by Hind Ⅲ+XbaⅠ, which was identical to the expected value. Western Blot revealed that CCL6-PEP fusion protein could be recognized by His monoclonal antibody. ConclusionPEP-CCL express vector can be constructed and expressed in eukaryotic cells.
[Key words]cell-penetrating peptide; CCL; gene expression; recombinant fusion protein
[收稿日期]2015-08-23
[基金項目]湖北省教育廳重點項目支持(D20112101)
[作者簡介]劉勇(1973-),湖北省十堰市人,男(漢族),副主任醫(yī)師,主要從事危重病研究。 [通信作者]吳君E-mail:1091372776@qq.com
DOI:10.3969/j.issn.1671-9638.2016.06.001
[中圖分類號]R3Q2-33
[文獻標識碼]A
[文章編號]1671-9638(2016)06-0361-06
·論著·

