注射用丹參多酚酸鹽的穩定性再評價
黃鐵英,石蘇英,周黎琴
(諸暨市人民醫院 藥劑科,浙江 諸暨 311800)
注射用丹參多酚酸鹽的穩定性再評價
黃鐵英Δ,石蘇英,周黎琴
(諸暨市人民醫院 藥劑科,浙江 諸暨 311800)
目的 建立丹參多酚酸鹽中丹酚酸B含量測定方法,并補充丹參多酚酸鹽與2種溶劑配伍后的穩定性數據。方法 HPLC法測定丹酚酸B的含量,色譜柱為YMC-ODS C18(250 mm×4.6 mm ,5 μm),流動相為乙腈-0.03%磷酸,流速為1.0 mL/min,檢測波長為280 nm。同時將注射用丹參多酚酸鹽與0.9%氯化鈉溶液及5%葡萄糖溶液2種溶劑模擬臨床用藥比例配伍,進行丹參多酚酸鹽穩定性考察。結果 在濃度6.18~61.80 μg/mL的范圍內,丹酚酸B濃度與峰面積呈良好的線性關系,該方法的精密度、穩定性、重復性、準確度良好。樣品中所含丹酚酸B含量在751.82~791.83 mg/g范圍內波動,較穩定。室溫狀態下各配伍液的外觀,pH值,穩定性和吸收度均無明顯變化。配伍液在6 h內測得10 μm以上的微粒95粒,25 μm以下的微粒18粒,符合藥典規定。結論 以HPLC法測定丹酚酸B含量靈敏度高、重現性好,能夠滿足注射用丹參多酚酸鹽的分析要求;注射用丹參多酚酸鹽與溶劑配伍后6 h內穩定,可安全用于臨床。
丹參多酚酸鹽;丹酚酸B;含量測定;穩定性研究
中藥注射劑是指藥材經提取、純化后制成的供注入人體內的溶液、乳狀液及供臨用前配制成溶液的粉末或濃溶液的無菌制劑[1]。2005年SFDA頒發的注射用丹參多酚酸鹽是從單味中藥丹參中提取的以丹參乙酸(丹酚酸B,salvianolic acid B,Sal B)鎂為主要成分的丹參多酚酸鹽類化合物,為淺棕色疏松塊狀物,味微苦,微澀[2]。活血、化瘀、通脈,用于冠心病穩定型心絞痛,癥見胸痛、胸悶、心悸,其藥品說明書中用法用量為“200 mg用5%葡萄糖注射液或0.9%氯化鈉注射液250 mL~500 mL溶解后靜脈滴注”,注意事項為“謹慎聯合用藥,如確需聯合使用其他藥品時,因謹慎考慮與本品的間隔是時間以及藥物相互作用等問題,目前尚無藥物相互作用研究資料”。本項目研究建立注射用丹參多酚酸鹽中丹酚酸B含量測定方法,完成注射用丹參多酚酸鹽與0.9%氯化鈉溶液以及5%葡萄糖溶液2種溶劑配伍后的穩定性研究,為臨床使用注射用丹參多酚酸鹽提供更多參考。
1 材料與方法
1.1 儀器與試劑 Prostar系列高效液相色譜儀(美國 Varian);JK-300DB超聲波清洗器(合肥金尼克機械制造有限公司);紫外-可見分光光度計(美國 Varian);精密pH計(上海雷磁儀器廠)。
注射用丹參多酚酸鹽(上海綠谷制藥有限公司,批號1303312);5%葡萄糖注射液(廣州百特醫療用品有限公司,批號GS1309053);0.9%氯化鈉注射液(杭州民生藥業有限公司 F1406103);丹酚酸B對照品(中國藥品生物制品檢定所,111562-200807),甲醇、乙腈為色譜純,其余試劑均為分析純。
1.2 方法
1.2.1 色譜條件:色譜柱:YMC-ODS C18(250 mm×4.6 mm,5 μm);流動相:乙腈-0.03%磷酸(30:70);流速:1.0 mL/min;檢測波長:280 nm;柱溫:30 ℃;進樣量:10 μL;對照品溶液及供試品溶液的色譜圖,見圖1。
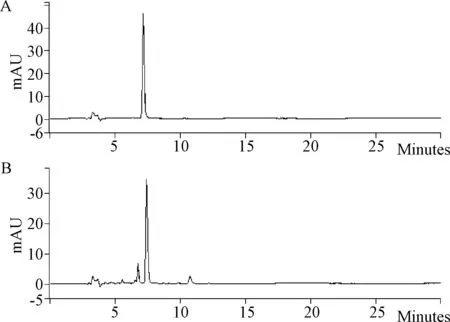
圖1 丹酚酸B對照品和供試品溶液的液相色譜圖A:對照品;B:供試品Fig.1 Chromatogram of Sal B of reference and test samplesA: reference sample;B:test sample
1.2.2 供試品溶液的制備:取裝量差異項下的內容物,混勻,取20 mg,精密稱定,置50 mL 量瓶中,用流動相溶解并稀釋至刻度,搖勻,精密量取1 mL,置10 mL量瓶中,用流動相稀釋至刻度,搖勻,濾過,即得。
1.2.3 對照品溶液的制備:取丹酚酸B對照品適量,精密稱定,加甲醇制成每1 mL 含 309 μg的溶液,即得。
1.2.4 線性關系考察:精密吸取對照品溶液(0.309 mg/mL)0.1、0.2 、0.4、0.6、0.8、1.0 mL置5 mL量瓶中,加甲醇稀釋至刻度,搖勻,即得。分別精密吸取各對照品溶液10 μL,注入液相色譜儀,測定并記錄峰面積。
1.2.5 精密度試驗:分別精密吸取對照品溶液(37.08 μg/mL)和供試品溶液各10 μL,進樣6次,記錄峰面積并計算。
1.2.6 穩定性試驗:分別精密吸取對照品溶液(37.08 μg/mL)和供試品溶液各10 μL,分別于5天進樣,記錄峰面積并計算。
1.2.7 重復性試驗:取本品20 mg,共5份,精密稱定,置50 mL量瓶中,按供試品溶液的制備方法處理,分別精密吸取10 μL,進樣,記錄峰面積并計算。
1.2.8 加樣回收率試驗:取本品10 mg,共9份,精密稱定,分別加入不同量的對照品溶液,按供試品溶液的制備方法處理,分別精密吸取10 μL,注入液相色譜儀,記錄峰面積并計算。
1.2.9 樣品測定:取不同批次的樣品各20 mg,精密稱定,置50 mL量瓶中,按供試品溶液的制備方法處理樣品,測定并計算含量。
1.3 注射用丹參多酚酸鹽的穩定性研究
1.3.1 配伍溶液的制備:模擬臨床用藥比例,精密取注射用丹參多酚酸鹽200 mg,加0.9%氯化鈉溶液使其溶解,定容至250 mL,作為供試品溶液1(簡稱:供試品1)。精密取注射用丹參多酚酸鹽200 mg,加5%葡萄糖溶液使溶解,定容至250 mL,作為供試品溶液2(供試品2)。
1.3.2 外觀觀察:室溫下將供試品1、供試品2放置6 h,按0、1、2、4、6 h進行觀察,觀察配伍液有無渾濁、沉淀生成和氣泡產生。
1.3.3 吸收度測定:將供試品1、供試品2在310 nm處進行測定,分別在0、1、2、4、6 h內讀取吸收度,考察其吸收度變化情況。
1.3.4 pH考察:室溫下將供試品1、供試品2放置6 h,按0、1、2、4、6 h分別測定配伍液的pH值。
1.3.5 不溶性微粒考察:室溫下將供試品1、供試品2放置6 h,按0、1、2、4、6 h進行觀察,測得10 μm以上的微粒和25 μm以下的微粒。
2 結果
2.1 線性關系考察 以對照品溶液的濃度x(μg/mL)為橫坐標,峰面積y為縱坐標,繪制標準曲線,y=61213x-80985,r=0.9998,在濃度6.18~61.80 μg/mL的范圍內,丹酚酸B濃度與峰面積呈良好的線性關系。見表1、圖2。
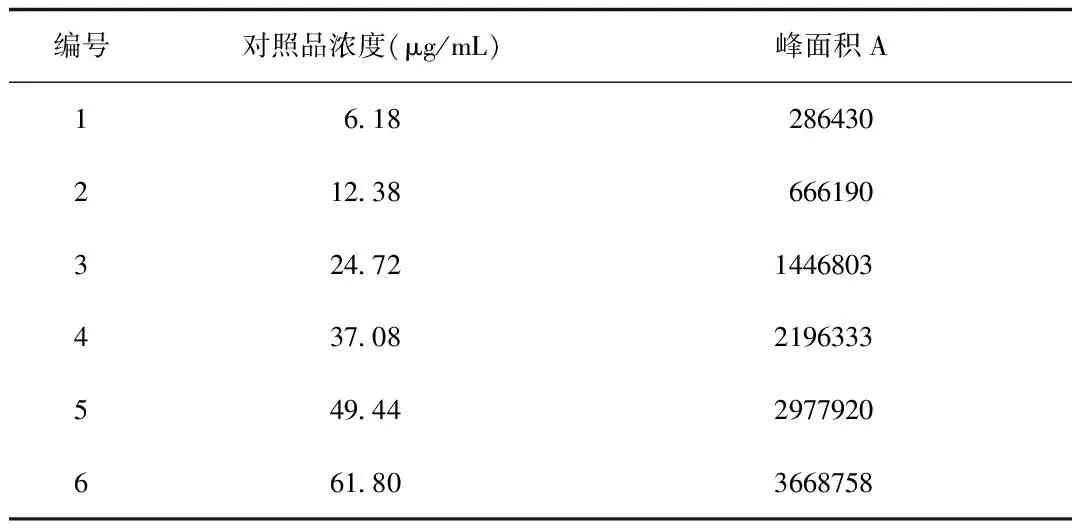
表1 線性關系考察

圖2 丹酚酸B標準曲線Fig.2 The standard curve of Sal B
2.2 精密度試驗 結果顯示對照品的RSD為1.17%,供試品的RSD為0.99%,表明該方法的精密度良好,見表2。

表2 精密度考察結果
2.3 穩定性試驗 結果顯示對照品的RSD為1.70%,供試品的RSD為2.71%,表明該方法的穩定性良好,見表3。

表3 穩定性考察結果
2.4 重復性試驗 結果顯示本品中丹酚酸B的平均含量為771.94 mg/g,RSD為2.40%,表明該方法的重復性良好,見表4。

表4 重復性試驗結果
2.5 加樣回收率試驗 結果顯示平均加樣回收率為99.63%,RSD為1.55%,表明本方法的準確度良好,見表5。
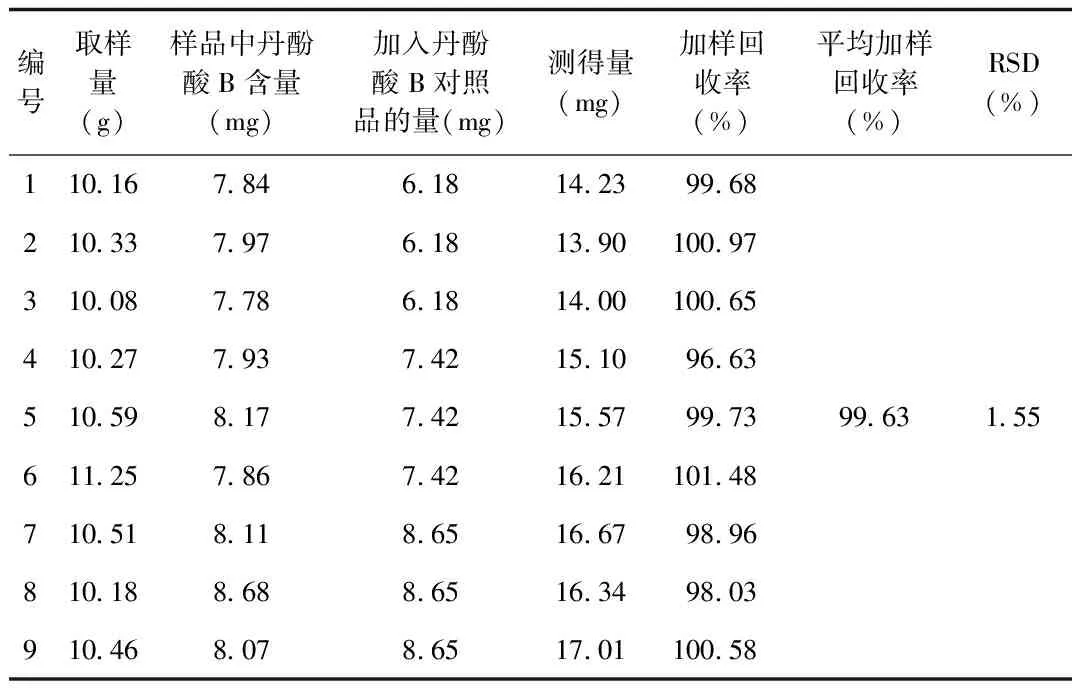
表5 加樣回收率考察結果
2.6 樣品測定 結果顯示樣品中所含丹酚酸B含量在751.82~791.83 mg/g范圍內波動,較穩定。見表6。

表6 不同批次樣品中丹酚酸B的含量
2.7 配伍液的外觀觀察 室溫下將配伍液放置6 h,按0、1、2、4、6 h進行觀察,配伍液無渾濁沉淀生成,無氣泡產生。
2.8 配伍液的吸收度、pH值及含量變化 結果顯示配伍液在6 h內其吸收度A,pH值以及丹酚酸B含量基本保持穩定,表明按照臨床使用劑量配伍后在6 h內可安全使用,穩定性較好。見表7。
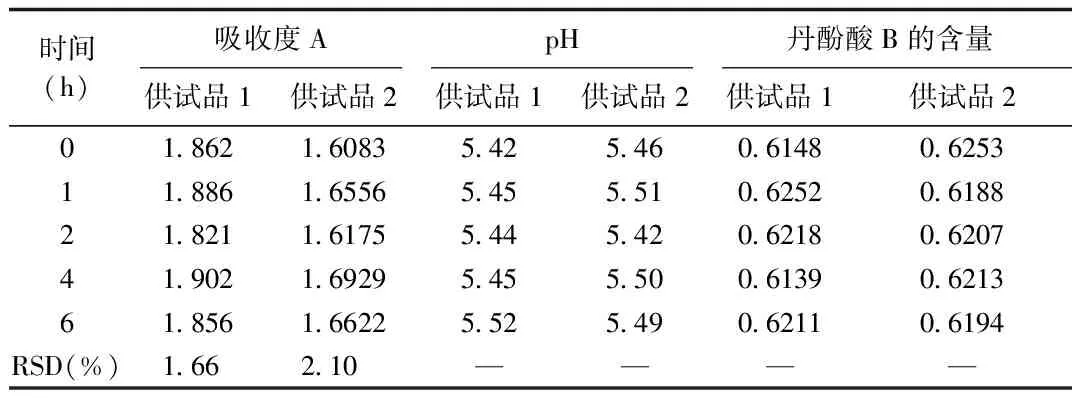
表7 配伍液的吸收度、pH值及含量變化結果
2.9 配伍液的微粒考察 室溫下將上述配伍液放置6 h,按0、1、2、4、6 h進行觀察,6 h內測得10 μm以上的微粒95粒,25 μm以下的微粒18粒。
3 討論
中藥注射劑是當代中藥劑型的突破性創新,具有重要的學術意義和現實意義。但它尚未進入成熟的發展階段,難免存在諸多問題。中藥注射劑的不良反應在整個中藥的臨床使用過程中所占比例較高[3-5],有些中藥注射劑與溶媒配伍后穩定性發生變化,甚至一些中藥注射劑與按藥品說明書上規定的溶媒配伍,不溶性微粒明顯多于空白劑[6]。同時,由于各種原因制約,中藥注射劑說明書存在各種缺點[7],絕大部分中藥注射劑說明書中“藥物相互作用” 項均為“目前尚無充分的藥物相互作用研究資料”,這些都不能滿足中藥注射劑的臨床使用需要。因此為完善中藥注射劑的安全信息,推行中藥注射劑上市后安全性再評價迫在眉睫。丹酚酸B又稱為丹參酸乙或丹參乙酸(salianic acid B)或紫草酸B(lithospermic acid B),是丹參中治療心血管疾病最重要、最有效的活性成分[8-9],已成為丹參類制劑的質控標準。本研究以注射用丹參多酚酸鹽為研究對象,以丹酚酸B為指標性成分運用HPLC技術,建立了注射用丹參多酚酸鹽中丹酚酸B含量的測定方法[10-11]。實驗中分別比較了甲醇-乙腈-甲酸-水、乙腈-0.03%磷酸溶液、甲醇-0.8%乙酸等流動相系統,最后確定色譜條件為:以乙腈-0.03%磷酸(30:70)為流動相,流速為1.0 mL/min,檢測波長為280 nm,柱溫為30 ℃。在此條件下,丹酚酸B色譜峰與相鄰色譜峰的分離度為4.2,理論塔板數為108732。通過對指標成分的含量監測在某種程度上反映藥物組分的變化。結果表明,該方法靈敏度高、重現性好,能夠滿足注射用丹參多酚酸鹽的分析要求,為控制制劑的質量打下良好的基礎。同時與藥品說明書中規定的5%葡萄糖注射液及0.9%氯化鈉注射液兩種溶劑進行配伍考察[12],考察其各項配伍指標的變化,結果表明注射用丹參多酚酸鹽分別與0.9%氯化鈉溶液和5%葡萄糖溶液配伍后配伍液均無渾濁沉淀生成,pH值在6 h基本穩定;通過注射用丹參多酚酸鹽分別與0.9%氯化鈉溶液和5%葡萄糖溶液配伍后溶液的微粒考察,測得微粒均符合藥典所規定;通過對配伍液的丹酚酸B含量測定,表明其在6 h內基本穩定。
本項目研究作為注射用丹參多酚酸鹽臨床再評價試驗中的一部分,有針對性的補充注射用丹參多酚酸鹽在注射配伍時的穩定性數據,為配置中心配置藥物,臨床合理安排工作流程提供參考;同時,探索上市后藥品安全性再評價的新方法。
[1] 國家藥典委員會.中華人民共和國藥典(二部).北京:中國醫藥科技出版社.2010:附錄13.
[2]王俠,李小慶,吳煥林.丹參多酚酸鹽治療心絞痛的非隨機、同期對照臨床研究[J].實用醫學雜志,2010,26(1):111-113.
[3]王愛梅.300例中藥不良反應報告的分析[J]. 中國醫藥指南, 2013, 11(9): 17-18.
[4]趙娜萍, 嚴天虹, 王晶, 等. 我院136中藥不良反應分析[J]. 實用藥物與臨床, 2011,14(4):328-330.
[5]馮艷霜. 187例中藥致過敏反應文獻分析[J]. 藥物不良反應雜志, 2002, 4(2): 81-83.
[6]李湘萍,朱敏文,朱小艷,等. 丹參多酚酸注射液使用情況分析[J]. 中南藥學,2010,8(8):633-635.
[7]劉鳴義,焦立紅,謝雁鳴,等. 中藥注射劑說明書解讀與分析[J]. 中國中藥雜志,2012,37(18):2707-2709.
[8]Kasimu R, Tanaka K, Tezuka Y,et al.Comparative study of seventeen salvia plants: aldose reductase inhibitory activity of water and MEOH extracts and liquid chromatography-mass spectrometry (LC-MS) analysis of water extracts [J].Chem Pharm Bull, 1998, 46(3):500-504.
[9]周長新, 丹羽正武. 丹參中水溶性成分的研究 [J]. 中國藥科大學學報, 1999(30):
[10]柳麗,張洪泉.丹參活性成分的現代中藥藥理研究進展[J].中國野生植物資源,2003,22(6):1-4.
[11]密靜英,崔金國,魏慧珍等.不同廠家復方丹參片中丹參酸B的含量比較[J].江西中醫學院學報,2006,18(5):40.
[12]張彬,周學興,吳建國.參附注射液與果糖注射液、氯化鈉注射液配伍穩定性研究[J].中國中醫急癥,2008,17(12):1737-1739.
(編校:王儼儼)
Reevaluation of stability of the salvianolate for injection
HUANG Tie-yingΔ, SHI Su-ying, ZHOU Li-qin
(Department of Pharmacy,People’s Hospital of Zhuji, Zhuji 311800, China)
ObjectiveTo establish the method of content determination of Sal B in salvianolate for injection, and supply the stability data of salvianolate for injection after the compatibility with 2 solvents.MethodsThe content of Sal B was determined by HPLC.The HPLC procedure was performed on the chromatographic column of YMC-ODS C18(250 mm×4.6 mm, 5 μm), and the mobile phase was acetonitrile - 0.03%phosphoric acid solution.The flow velocity was 1.0 mL/min and the detection wavelength was 280 nm.At the same time, by simuating clinical medication, salvianolate for injection was mixed with 0.9%sodium chloride solution and 5%glucose solution in order to investigate the stability of salvianolate.ResultsWithin the range of concentration of 6.18~61.80 μg/mL, Sal B concentration and peak area showed a good linear relationship, the method was good in precision, stability, repeatability and accuracy.The content of Sal B fluctuated from 751.82 mg/g to 791.83 mg/g.At the room temperature, there was no significant change in appearance, pH value, stability and the absorbance.The mixed solution was measured 95 particles above 10 μm, 18 particles below 25 μm within 6 h.ConclusionThe Sal B content determined by HPLC has high sensitivity, good reproducibility, and could meet the analysis requirements of salvianolic for injection, it is stabilized within 6h after mixing, it could be safely used in clinical.
salvianolic acid; Sal B; content determination; stability
黃鐵英,通信作者,女,本科,副主任藥師,研究方向:醫院藥學,E-mail:13857515600@163.com。
R942
A
10.3969/j.issn.1005-1678.2016.03.52

