煙草黑脛病生防菌的篩選鑒定及發(fā)酵條件優(yōu)化
劉暢++許家來++郭凱
摘要:從山東煙田土壤中篩選對山東煙草黑脛病(Phytophthora parasitica var.nicotianae)具有較強拮抗作用的生防菌株。通過稀釋涂布法初篩后,用平板對峙法復(fù)篩到拮抗效果較好的菌株YCG-2,根據(jù)菌株形態(tài)與培養(yǎng)特征、ITS序列分析進行鑒定,該菌株與哈茨木霉(Trichoderma harzianum)的親緣關(guān)系較近,且形態(tài)與培養(yǎng)特征與哈茨木霉基本相符,因此鑒定為哈茨木霉。通過單因素試驗和正交試驗優(yōu)化培養(yǎng)基組分及發(fā)酵條件,最優(yōu)發(fā)酵條件為每500 mL瓶 20 g 菇渣,料水比為1 g ∶3.0 mL,種子液接種量1×107 CFU/g,pH值7.0,最適溫度28 ℃,恒溫恒濕培養(yǎng)箱中培養(yǎng)6 d。
關(guān)鍵詞:煙草黑脛病;哈茨木霉;發(fā)酵條件;正交試驗
中圖分類號: S435.72文獻標(biāo)志碼: A文章編號:1002-1302(2016)05-0167-04
煙草黑脛病的病原菌為煙草疫霉菌(Phytophthora nicotianae Breda或P. parastica var. nicotianae Tucker)[1],隸屬于藻物界(Chromista)、卵菌門(Oomycota)、卵菌綱(Oomycetes)、腐霉目(Pythiales)、腐霉科(Pythiaceae)、疫霉屬(Phytophthora)[2]。煙草黑脛病是世界性的嚴(yán)重病害,在我國發(fā)生較為普遍,特別在河南和山東黃淮煙區(qū)嚴(yán)重影響煙草產(chǎn)量和質(zhì)量[3]。山東省是老重病區(qū),曾因推廣抗病品種在生產(chǎn)上起到較好的作用,但年發(fā)病率仍在5%~20%,如1981年安丘縣曾因此病絕產(chǎn)667 hm2以上[4]。在不采取防治措施情形下,會出現(xiàn)毀滅性災(zāi)害[5]。目前煙草生產(chǎn)上抗黑脛病品種效果有限,黑脛病的防治主要依賴甲霜靈等苯基酰胺類殺菌劑,且防治藥物品種單一[6]。
隨著煙草和煙草制品逐步向無公害方向發(fā)展,生物防治方法應(yīng)運而生,能夠有效克服農(nóng)藥殘留和病菌抗藥性的問題,生防菌通過與病原真菌的拮抗作用來防治煙草黑脛病。近年來,國內(nèi)已有不少關(guān)于煙草黑脛病生防菌方面的研究。如普城沙雷菌、綠針假單胞菌、黏類芽孢桿菌等細(xì)菌都對煙草疫霉有較強的拮抗作用[7-8]。喻會平等篩選出的復(fù)配細(xì)菌菌株對煙草黑脛病有很好的防治效果[9]。張良等研究顯示,長柄木霉(Trichoderma longbrachitum)和涇陽鏈霉菌(Streptomyces jingyangensis)是具有較高親和性的增效組合,2個菌株復(fù)配后可有效促進煙苗生長和防治煙草黑脛病[10]。但目前為止,篩選出煙草疫霉菌的拮抗菌以細(xì)菌居多,真菌較少,且在實際生產(chǎn)中的應(yīng)用很少。本研究擬從山東省濰坊市洛莊煙草實驗站煙田的土壤中分離、純化、篩選拮抗菌,并對拮抗效果較好的真菌菌株進行了發(fā)酵條件的優(yōu)化,為后期驗證該菌株在田間的防治效果,利用該菌株制作菌肥,并應(yīng)用于煙田奠定基礎(chǔ)。
1材料和方法
1.1材料
1.1.1樣品來源2014年6月從山東省濰坊市洛莊煙草實驗站附近煙草黑脛病發(fā)生較為嚴(yán)重的煙田采集土壤5份。采集土壤時,選取病煙株集中地塊附近無病煙株,收集煙株根周圍土壤,每塊煙田取3株,3株煙的根周圍土等量混為1份樣品,分裝入無菌50 mL刻度塑料試管內(nèi),貼上標(biāo)簽后帶回實驗室分離拮抗菌。
1.1.2主要試劑和儀器引物(ITS 1、ITS 4)、Taq mix 購自上海生工生物有限公司,Marker購自Takara公司,其余試劑均為國產(chǎn)分析純試劑。電泳儀、PCR為Bio-Rad,顯微鏡為Nikon eclipse E100 。
1.1.3培養(yǎng)基及發(fā)酵材料PDA培養(yǎng)基(培養(yǎng)篩選出的拮抗真菌)購自北京奧博星生物技術(shù)有限公司,LB培養(yǎng)基(培養(yǎng)篩選出的拮抗細(xì)菌,含胰蛋白胨10.0 g/L,酵母提取物 5.0 g/L,NaCl 5.0 g/L,瓊脂 15.0 g/L,pH值 7.0),燕麥培養(yǎng)基(OA,燕麥 60.0 g/L,瓊脂18.0 g/L),發(fā)酵材料為蘑菇渣(蘑菇渣為主要發(fā)酵材料,來自山東省棗莊冠宇食用菌有限公司)。
1.2拮抗菌的初篩
5份土壤每份取10 g于盛有90 mL無菌水的三角瓶中,搖床150 r/min振蕩30 min,記作1×10-1。取1 mL懸濁液至含有9 mL無菌水的試管中,渦旋60 s,記作1×10-2,依次稀釋至1×10-5。取1×10-4和1×10-5這2個濃度上清液各100 μL涂板,3次重復(fù),板中央接病原菌煙草黑脛病WZL-072(由筆者所在實驗室分離獲得)。28 ℃下培養(yǎng)3~5 d,挑取周圍無病原菌絲生長的菌株進行分離純化。
1.3拮抗菌的復(fù)篩
采用平板對峙法,將初篩出來的拮抗菌與煙草黑脛病原菌株WZL-072進行對峙。
1.3.1拮抗細(xì)菌與WZL-072對峙試驗將5 mm打孔器打孔的WZL-072菌塊置于OA培養(yǎng)基上,4個大小相同無菌濾紙片等距離放于WZL-072四周,吸取5 μL 180 r/min、28 ℃培養(yǎng)12 h的拮抗細(xì)菌菌液滴于濾紙片上,以等量無菌水為對照,各3次重復(fù)。28 ℃下培養(yǎng)5~7 d,每天測量WZL-072菌落直徑。
1.3.2拮抗真菌與WZL-072對峙試驗利用5 mm打孔器分別打孔拮抗真菌與WZL-072,各取1塊置于OA培養(yǎng)基上進行對峙培養(yǎng),各3次重復(fù)。28 ℃下培養(yǎng)5~7 d,每天測量WZL-072菌落直徑。
1.3.3抑菌率的計算
抑菌率=對照病原菌菌落直徑-處理病原菌菌落直徑對照病原菌菌落直徑×100%。
1.4菌株的鑒定
1.4.1形態(tài)學(xué)鑒定滴1滴乳酸酚棉蘭染色液于載玻片中央,膠帶粘取一點轉(zhuǎn)接3 d的YCG-2 菌絲放于染色液上,濾紙吸去多余的染色液,在10×40、10×100倍的光學(xué)顯微鏡下觀察菌絲形態(tài)、孢子的大小及形狀。參照喻璋等的方法[11]進行形態(tài)學(xué)鑒定。
1.4.2分子生物學(xué)鑒定樣品DNA的提取按照艾德萊生物公司的“真菌基因組DNA快速提取試劑盒”中的方法進行,用真菌通用引物(ITS 1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS 4:5′-TCCTCCGCTTATTGATATGC-3′)進行擴增[12],測定其序列。通過Blast程序,從NCBI公共數(shù)據(jù)庫中進行相似性搜索,選取相似性最高且是有效發(fā)表的典型菌株的序列,用clusta lX 進行序列比對,用MEGA 4.0的Neighbor-Joining 法選取前250個最好的比對結(jié)果構(gòu)建系統(tǒng)進化樹,確定 YCG-2菌株的分類地位。
1.5發(fā)酵條件的優(yōu)化
1.5.1種子液的制備及種子液孢子濃度檢測種子液的制備:稱20 g菇渣于500 mL三角瓶中,加蒸餾水50 mL,料水比為1 g ∶2.5 mL,121 ℃滅菌40 min,接種5-10塊菌塊,28 ℃培養(yǎng)6 d。加150 mL無菌水,搖勻后用2層無菌紗布過濾,濾液 5 000 r/min 離心10 min,倒掉上清液,加30%甘油重懸孢子液,混勻后分裝入凍存管中,-80 ℃保存。采用活菌計數(shù)法檢測種子液孢子濃度:取1 mL種子液,梯度稀釋后進行平板培養(yǎng)(培養(yǎng)基內(nèi)加入曲通抑制菌絲生長)。培養(yǎng)溫度 28 ℃,時間48 h,3次重復(fù)。
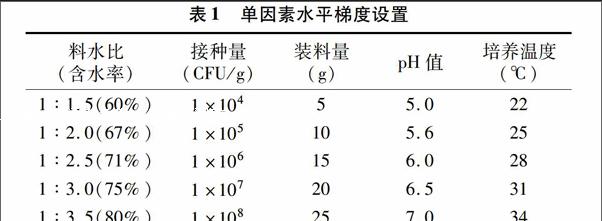
1.5.2單因素試驗選擇裝料量、溫度、料水比、接種量、pH值作為影響YCG-2菌株生長的主要因素,通過單因素試驗選取正交試驗的因素和水平。基本條件為裝料量20 g蘑菇渣,料水比為1 g ∶2.5 mL,pH值自然,接種1 mL濃度1×107 CFU/g 的孢子液,28 ℃培養(yǎng)6 d后取出計算活菌數(shù)。在基本條件基礎(chǔ)上,按照表1所列指標(biāo)逐項進行單因素試驗。每個處理3次重復(fù)。
表1單因素水平梯度設(shè)置
料水比
(含水率)接種量
(CFU/g)裝料量
(g)pH值培養(yǎng)溫度
(℃)1 ∶1.5(60%)1×10455.0221 ∶2.0(67%)1×105105.6251 ∶2.5(71%)1×106156.0281 ∶3.0(75%)1×107206.5311 ∶3.5(80%)1×108257.034
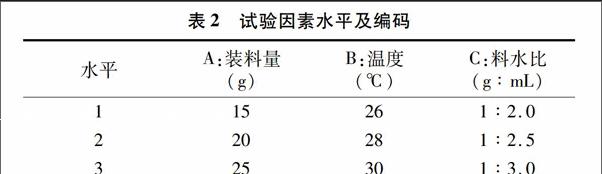
1.5.3正交試驗設(shè)計根據(jù)單因素試驗結(jié)果,選取料水比(X1)、裝料量(X2)、培養(yǎng)溫度(X3)3個因素為考察對象,以活菌數(shù)量為評價指標(biāo),進行正交試驗,3次重復(fù),試驗因素水平及編碼見表2。
1.6數(shù)據(jù)處理與分析
采用STATA方差分析軟件及 Microsoft Excel 2003統(tǒng)計軟件進行單因素方差分析和差異顯著性分析,采用SPSS 16.0軟件進行正交分析。
2結(jié)果
2.1拮抗菌的初篩
從采集到的5份土樣中初篩得到26株純培養(yǎng)拮抗細(xì)菌,編號為YCG-B1至YCG-B26,8株純培養(yǎng)拮抗真菌,編號為YCG-1至YCG-8。
2.2拮抗菌的復(fù)篩
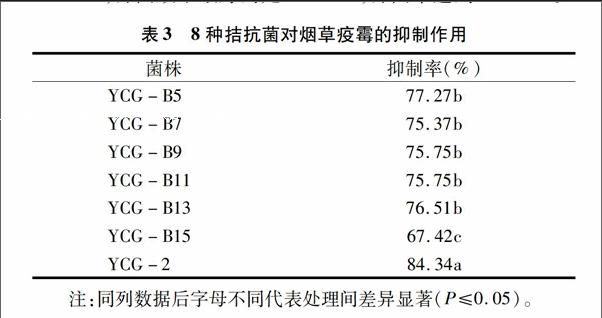
如表3所示,采用對峙培養(yǎng)法進一步篩選,共篩選到7株菌株有抑制效果,其中6株細(xì)菌、1株真菌,抑菌率67.42%~84.34%,抑菌效果最好的是YCG-2,抑菌率達到84.34%。
2.3經(jīng)典分類學(xué)特征
觀察發(fā)現(xiàn):在PDA培養(yǎng)基上,YCG-2菌株菌落開始為白色絮狀,逐漸變?yōu)榫G色,后期變?yōu)榘稻G色,顏色由淺變深,狀態(tài)由絮狀逐漸變得緊而密。通過光學(xué)顯微鏡觀察發(fā)現(xiàn):YCG-2菌株的菌絲纖細(xì)無色,具分隔,多分枝,分枝間夾角呈銳角。分生孢子梗從菌絲的側(cè)枝上生出,對生或互生,一般有2~3次分枝,著生分生孢子的小梗瓶形或錐形。分生孢子多為球形(圖1)。
2.4系統(tǒng)發(fā)育學(xué)特征
用真菌通用引物ITS 1和ITS 4擴增菌株YCG-2的核糖體DNA,得到595 bp的 ITS DNA序列,利用Blast程序與NCBI中已登錄的基因序列進行比對,選取與其同源性較高且已定名的菌株的相關(guān)序列信息,進行系統(tǒng)發(fā)育分析,取前250個最好的比對結(jié)果建樹(圖2),可以看出,菌株YCG-2的序列與哈茨木霉的序列相似性較高。
2.5拮抗菌株YCG-2發(fā)酵條件優(yōu)化單因素試驗結(jié)果
2.5.1料水比變化對YCG-2孢子產(chǎn)量的影響由圖3可見,料水比對菌株YCG-2的生長有很大影響,料水比為
1 g ∶1.5 mL時,YCG-2菌株的孢子產(chǎn)量最少,孢子數(shù)為8.00×108 CFU/g;料水比為1 g ∶3.0 mL時YCG-2產(chǎn)生的孢子最多,達到29.00×108 CFU/g,所以1 g ∶3.0 mL為菌株YCG-2產(chǎn)生孢子的最佳料水比。
2.5.2接種量變化對YCG-2孢子產(chǎn)量的影響由圖4可知,接種量對YCG-2菌株的生長有一定影響,在裝料20 g蘑菇渣,料水比為1 g ∶3.0 mL,自然pH值,28 ℃條件下,隨著接種量的增大,YCG-2孢子產(chǎn)量也會增加,接種量為1×107 CFU/g 時YCG-2孢子產(chǎn)量最大,孢子數(shù)達到29.50×108 CFU/g,當(dāng)接種量繼續(xù)增大,YCG-2菌株的活菌數(shù)則急劇降低,這可能是因為蘑菇渣中的菌體過多,導(dǎo)致營養(yǎng)成分不能滿足過量菌體的生長,從而影響活菌數(shù)。
2.5.3裝料量變化對YCG-2孢子產(chǎn)量的影響由圖5可見,YCG-2菌株的孢子產(chǎn)量隨著裝料量的增加,孢子產(chǎn)量越高,此時料水比為1 g ∶3.0 mL,自然pH值,接種1 mL濃度 1×107 CFU/g 的孢子液,溫度28 ℃。在每瓶20 g裝料量情況下菌株的生長狀況最好,孢子產(chǎn)量達到最高值29.01×108 CFU/g。當(dāng)裝料量達到每瓶25 g時,孢子產(chǎn)量有所降低,這可能與物料堆積過多造成透氣量下降有關(guān)。
2.5.4初始pH值變化對YCG-2菌株生長的影響用氫氧化鈉溶液調(diào)節(jié)物料pH值。從圖6可以看出,在試驗所設(shè)置的pH值梯度區(qū)間內(nèi)(5.5~7.5),YCG-2菌株都能生長,且在pH值為7.0時孢子產(chǎn)量達到最高值。在pH值為7.0時YCG-2的產(chǎn)孢量最多,達到40.11×108 CFU/g。物料pH值偏大或偏小,孢子產(chǎn)量均減少。
2.5.5溫度變化對YCG-2菌株生長的影響分別在22、25、28、31、34 ℃下進行培養(yǎng),測定不同溫度下的活菌數(shù),結(jié)果(圖7)表明,溫度變化對YCG-2菌株的生長影響很大。在28 ℃下孢子產(chǎn)量達到最高值39.60×108 CFU/g。隨著溫度的升高,YCG-2孢子產(chǎn)量越來越低,34 ℃時孢子產(chǎn)量降低到6.0×104 CFU/g。
2.6孢子產(chǎn)生條件優(yōu)化正交試驗
為了驗證單因素試驗結(jié)果,通過SPSS統(tǒng)計軟件設(shè)計正交試驗。本試驗選取裝料量、培養(yǎng)溫度、料水比3個因素為考察對象,進行正交試驗設(shè)計。每個試驗重復(fù)3次,取其平均值,正交試驗結(jié)果與分析見表4,方差分析見表5。
由表5可知,3個因素對YCG-2菌株生長的影響作用大小依次為A>B>C,即裝料量>溫度>料水比。通過該正交試驗結(jié)果確定最佳組合水平為A2B2C2。在裝料量為20 g、培養(yǎng)溫度為28 ℃、料水比為1 g ∶3.0 mL的最佳條件下進行驗證試驗,重復(fù)3次,平均產(chǎn)孢量為40.18×108 CFU/g。
3小結(jié)與討論
煙草黑脛病是煙草生產(chǎn)中危害最嚴(yán)重的土傳病害之一,山東省是受害比較嚴(yán)重的產(chǎn)煙省,每年經(jīng)濟損失高達億元,僅次于煙草病毒病[1]。由于生物防治對環(huán)境無污染及不容易產(chǎn)生抗藥性等特點成為病害防治研究的熱點,需要研究和開發(fā)環(huán)境友好的土傳病害生物防治技術(shù)。
本研究從山東省煙草黑脛病發(fā)生嚴(yán)重的煙田里選擇長勢良好無病煙株,取其根際土,經(jīng)過初篩和復(fù)篩,獲得1株對對煙草疫霉具有較強抑制作用的真菌菌株YCG-2,該菌株的抑菌率最高可達到84.34%。鑒于此,選擇YCG-2菌株作為后期的主要研究對象,利用傳統(tǒng)分類方法和18S rDNA 序列測定法對菌株YCG-2 進行了鑒定,確定菌株YCG-2為哈茨木霉。采用單因素和正交設(shè)計試驗對菌株YCG-2進行發(fā)酵條件的優(yōu)化,得到其最佳發(fā)酵配方和最適發(fā)酵條件。最適培養(yǎng)溫度為28 ℃,pH值為7.0,這與莊敬華等[13]、于曉丹等[14]的關(guān)于木霉發(fā)酵條件研究結(jié)果相似,但張愛華等[15]關(guān)于哈茨木霉發(fā)酵條件的初步研究結(jié)果顯示最適培養(yǎng)溫度為 22 ℃,本研究結(jié)果與之相差較大,可能是因為哈茨木霉菌株不同、所用培養(yǎng)基不同等。
為了能降低菌種擴大生產(chǎn)成本,本試驗以廢棄菇渣為培養(yǎng)基質(zhì),并以孢子產(chǎn)生量為指標(biāo),優(yōu)化了相應(yīng)的發(fā)酵條件,為推廣應(yīng)用打下了基礎(chǔ)。Harman研究認(rèn)為,木霉的生防作用與其根際定殖能力密切相關(guān)[16-17],因此YCG-2菌株的根際定殖能力有待于進一步研究,以期能盡快將其推向大田應(yīng)用。
參考文獻:
[1]方中達,陸家云,葉鐘音,等. 中國農(nóng)業(yè)百科全書:植物病理學(xué)卷[M]. 北京:農(nóng)業(yè)出版社,1996:534-535.
[2]Hawksworth D L,Sutton B C. Ainsworth and bisbys dictionary of the fungi [M]. 8th ed. CAB International,1995.
[3]周嘉平,王寶華. 煙草黑脛病田間動態(tài)研究[J]. 植物病理學(xué)報,1984,14(1):39-45.
[4]王智發(fā),劉延榮,謝成頌,等. 山東省煙草黑脛病菌生理小種初步鑒定[J]. 植物保護學(xué)報,1985,12(1):51-55.
[5]Shew H D,Lucas G B. Compendium of tobacco diseases[M]. Saint Paul,Minnesota:American Phytopathological Society Press,1991:17-20.
[6]李梅云,祝明亮. 煙草黑脛病菌對甲霜靈的抗性測定[J]. 中國農(nóng)學(xué)通報,2006,22(9):377-379.
[7]王晶晶,蔣士君,常淑嫻,等. 兩株生防菌對煙草黑脛病的抑制活性及其鑒定[J]. 中國煙草學(xué)報,2011,17(6):89-92.
[8]曹明慧,冉煒,楊興明,等. 煙草黑脛病拮抗菌的篩選及其生物效應(yīng)[J]. 土壤學(xué)報,2011,48(1):151-155.
[9]喻會平,羅定棋,代園鳳,等. 煙草黑脛病拮抗菌復(fù)合菌株的篩選與防治效果評價[J]. 中國農(nóng)學(xué)通報,2015,31(8):102-107.
[10]張良,劉好寶,顧金剛,等. 長柄木霉和涇陽鏈霉菌復(fù)配對煙苗生長及其抗病性的影響[J]. 應(yīng)用生態(tài)學(xué)報,2013,24(10):43-45.
[11]喻璋,張猛. 半知菌分屬圖冊[M]. 北京:科學(xué)出版社,2009.
[12]Kamel A A,Ibrahim N A,Mohmed A A,et al. PCR identification of Fusarium genus based on nuclear ribosomal-DNA sequence data[J]. African Journal of Biotechnology,2003,2(4):82-85.
[13]莊敬華,高增貴,劉限,等. 不同發(fā)酵條件對木霉產(chǎn)孢類型的影響[J]. 中國生物防治,2005,21(1):37-40.
[14]于曉丹,張彩霞,林英,等. 拮抗木霉菌株T21發(fā)酵條件的研究[J]. 安徽農(nóng)業(yè)科學(xué),2005,33(2):215-216.
[15]張愛華,白石,周國興,等. 哈茨木霉發(fā)酵條件的初步研究[J]. 安徽農(nóng)業(yè)科學(xué),2008,36(23):9821-9822.
[16]Harman G E. Development and benefits of rhizosphere competent fungi for biological control of plant pathogens[J]. Plant Nutrition,1992,15(6):835-843.
[17]Harman G E. Myths and dogmas of biocontrol:changes in peiceptions derived from research on Trichoderma harzianum T-22[J]. Plant Diseases,2000,84(4):377-393.辛蓓,鄭雅楠,劉佩旋. 寄生蜂毒液的功能與其主要作用成分[J]. 江蘇農(nóng)業(yè)科學(xué),2016,44(5):171-174.

