鈣和硼對菊花品種金陵豐收花粉萌發及花粉管生長的影響
韓霜
摘要:以國慶小菊金陵豐收為試驗材料,使用的培養基是ME3+150 g/L PEG4000)+100 g/L 蔗糖),添加不同濃度鈣和硼酸,研究不同濃度的鈣和硼酸對國慶菊花粉萌發和花粉管生長的影響,旨在獲得菊花花粉離體萌發最佳培養基。結果發現:硼酸對花粉萌發率影響明顯,當硼酸濃度是100 mg/L時,花粉培養2 h時花粉萌發率達到最高,為1005%。外源鈣能促進花粉的萌發,并影響花粉管的生長速度和生長質量,一定濃度的鈣使花粉管生長筆直,在鈣濃度為400 mg/L時金陵豐收花粉管生長狀況最佳。外源鈣濃度過高和培養時間過長時,花粉管生長出現細弱、畸形,而且容易斷落。
關鍵詞:菊花;離體培養;花粉萌發率;花粉管生長
中圖分類號:S682.1+10.4+3文獻標志碼: A文章編號:1002-1302(2016)05-0258-03
菊花(Chrysanthemum morifolium)是我國十大傳統名花和世界四大切花之一,具有很高的觀賞價值。我國是菊花的起源中心,擁有3 000余個菊花品種[1]。菊花是異花授粉植物,具有自交不親和特性,花粉生活力是決定雜交結實的重要因素之一,因此研究花粉活力對指導菊花育種具有重要理論和現實意義[2]。花粉的萌發與生長[3]要通過吸漲、停滯、花粉管發端、花粉管迅速伸長這4個階段。研究報道,許多植物的花粉可以在培養基上萌發,如杜紀紅等[3]、杜玉虎等[4]、儲立明等[5]分別對桃、榆葉梅、絲瓜等花粉進行了離體培養研究。
國慶菊是菊花中的一種栽培類型,不僅具有生長繁盛、開花期長、分枝性強的優點,而且營造景觀效果好、耐鹽堿、成活率高[6]。花粉萌發和花粉管生長是植物受精的一個重要組成部分,不少研究表明,花粉萌發時引發的群體效應可由外源鈣離子來替代,這種作用對花粉萌發和花粉管生長過程很重要[7-8]。花粉管萌發和生長需要硼的作用,花粉管頂端聚集的酯化果膠[9],是由細胞壁上聚集了細胞中多數的硼,與果膠類物質RG-Ⅱ(鼠李半乳糖醛酸-Ⅱ)結合形成的,這種酸性果膠物質有利于頂端的延展,整個花粉管內遍布這種酸性的果膠物質,使細胞壁機械強度增大[10],從而推測,硼酸可能與RG-Ⅱ結合形成果膠網絡的結構,這種結構能調節細胞壁結構和性質,硼酸可防止酚類物質的積累,促進花粉管的生長[11]。本研究對國慶小菊金陵豐收花粉離體萌發培養基成分及其濃度和萌發時間進行研究,以期獲得菊花最適宜的離體培養條件,為花粉萌發和活力測定提供高效、簡便的方法。
1材料與方法
1.1試驗材料
供試材料為菊花品種金陵豐收,該品種初花期在9月下旬,盛花期在10月中旬,該材料由南京農業大學菊花種質資源中心提供。
1.2試驗方法
1.2.1花粉采集于晴天中午12:00,采取金陵豐收盛開花朵的花粉,裝到離心管中,避光,備用。
1.2.2花粉萌發培養基的確定
1.2.2.1培養基成分以 ME3+150 g/L PEG4000)+100 g/L 蔗糖為培養基[1],培養基中ME3[12]的基本成分包含大量元素:370 mg/L MgSO4·7H2O、950 mg/L KNO3、412.5 mg/L NH4NO3、175 mg/L KCl、85 mg/L KH2PO4;微量元素:0.83 mg/L KI、7.45 mg/L Na2 EDTA、0.25 mg/L Na2MoO4·2H2O、0.025 mg/L CuSO4·5H2O、0.025 mg/L FeSO4·7H2O、0.025 mg/L CoCl2·6H2O;維生素B1、維生素B6各1 mg/L。
1.2.2.2 培養基設置在ME3+150 g/L PEG4000+100g/L 蔗糖的培養基[1]中加入不同濃度的鈣和硼酸,其中硼酸濃度分別為5、50、100、200 mg/L,鈣濃度分別為0、200、400、800 mg/L,以ME3+150 g/L PEG4000+100 g/L 蔗糖+ 0 mg/L 硼酸的培養基為對照(CKⅠ),再分別加入上述濃度的硼酸,得出最適的硼酸濃度A;再加入上述濃度的外源鈣,以ME3+150 g/L PEG4000+100 g/L蔗糖+A濃度硼酸的培養基為對照(CKⅡ),從而得出最適的鈣濃度B。
1.2.3花粉萌發與花粉管長度檢測
1.2.3.1花粉萌發方法花粉萌發方法參照趙宏波等的方法[13加以修改,將采集來的菊花花粉,從離心管里倒出,放于玻璃紙上,然后用毛筆蘸取,輕撒適量的花粉到凹形載玻片的凹槽中,用膠頭滴管吸取培養液2~3滴,滴在盛有花粉的載玻片凹槽中。將培養皿底部墊上1層吸水的濾紙,將載玻片放上,并在兩旁放上吸水的脫脂棉球,用以保濕,蓋上培養皿蓋后放入恒溫箱內20 ℃進行培養,定時取出,在顯微鏡下(10×10)觀察統計花粉的萌發率并用顯微測微尺測量花粉管的長度。
1.2.3.2花粉萌發率將花粉放于不同濃度培養基中,分別培養0.5、1、2 、4 h后從恒溫培養箱里取出凹形載玻片在顯微鏡下觀察。每種試驗處理重復3次,每次重復隨機觀察3個視野,每個視野觀察的花粉總數不少于60粒,以花粉管的長度大于花粉粒的直徑為花粉萌發的標準[1],以花粉萌發率=萌發花粉粒數/花粉粒總數×100%為計算方法,最后將花粉的萌發率進行統計。
1.2.3.3顯微測微尺的使用顯微測微尺包括鏡臺測微尺和目鏡測微尺,測量前,要先進行校正,鏡臺測微尺的中央有1個全長1 mm的刻度標尺,等分成100個小格,每小格的長度為0.01 mm,可以用它來矯正目鏡測微尺每小格的長度。校正后的目鏡測微尺以每小格所代表的實際長度作為測量的尺度。
1.2.3.4花粉管長度檢測將花粉放于不同濃度培養基中,分別培養0.5、1.0、2.0、4.0 h后從恒溫培養箱里取出凹形載玻片在顯微鏡下觀察。每種試驗處理重復3次,每個視野隨機測量20個花粉管的長度,用顯微鏡的測微尺測量花粉管長度,計算隨機測量的20個花粉管長度的平均值。
1.3統計分析
結果用“平均值±標準誤”表示,用SPSS v17.0 (SPSS Inc.,Chicago,IL,USA)進行統計分析,處理之間差異顯著水平用單因素鄧肯檢驗,P<0.05。
2結果與分析
2.1硼酸對花粉萌發的影響
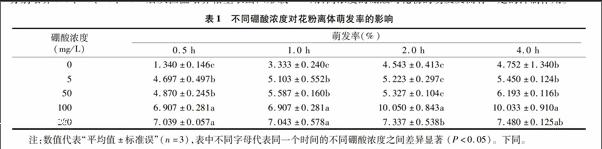
金陵豐收花粉萌發率隨著硼酸濃度的升高而增加,與對照相比,在培養時間0~1 h內,5、50 mg/L處理中的花粉萌發率增加最顯著。不同硼酸濃度處理的花粉萌發率差異顯著,其中100 mg/L 2 h時的花粉萌發率達到10.050%,比50、5 mg/L花粉萌發率分別增加了89%、92%。當硼酸濃度升高到200 mg/L時,每個時間段的萌發率基本相同,而且與 100 mg/L 硼酸濃度相比,花粉萌發率有所下降(表1)。說明硼酸只有在適宜的濃度下,才會對花粉萌發率有一定促進作用,高濃度的硼酸對花粉的萌發反而有一定的抑制作用。
2.2硼酸對花粉管生長的影響
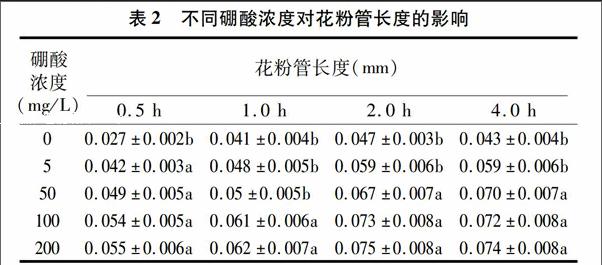
硼酸對花粉管生長具有明顯影響(圖1)。在無硼酸的培養基上,花粉管細長且彎曲(圖1-d),加上硼酸之后,花粉管生長變粗而且直(圖1-h)。不同濃度硼酸對金陵豐收花粉管生長的影響達到顯著水平,在2 h之內,增加硼酸濃度金陵豐收花粉管有伸長的趨勢,但2 h以后,花粉管的伸長速度明顯緩慢。硼酸200 mg/L時的每個時間段的平均花粉長度與100 mg/L的相比無明顯的變化。試驗中發現在無硼酸和有硼酸的條件下都出現了1個花粉粒長出2根花粉管的現象(圖1-d,圖1-h,紅色箭頭)。在無硼條件下,隨著時間的延長花粉管有伸長趨勢,但添加硼之后能促進金陵豐收花粉管的生長(表2)。
2.3鈣對花粉萌發的影響
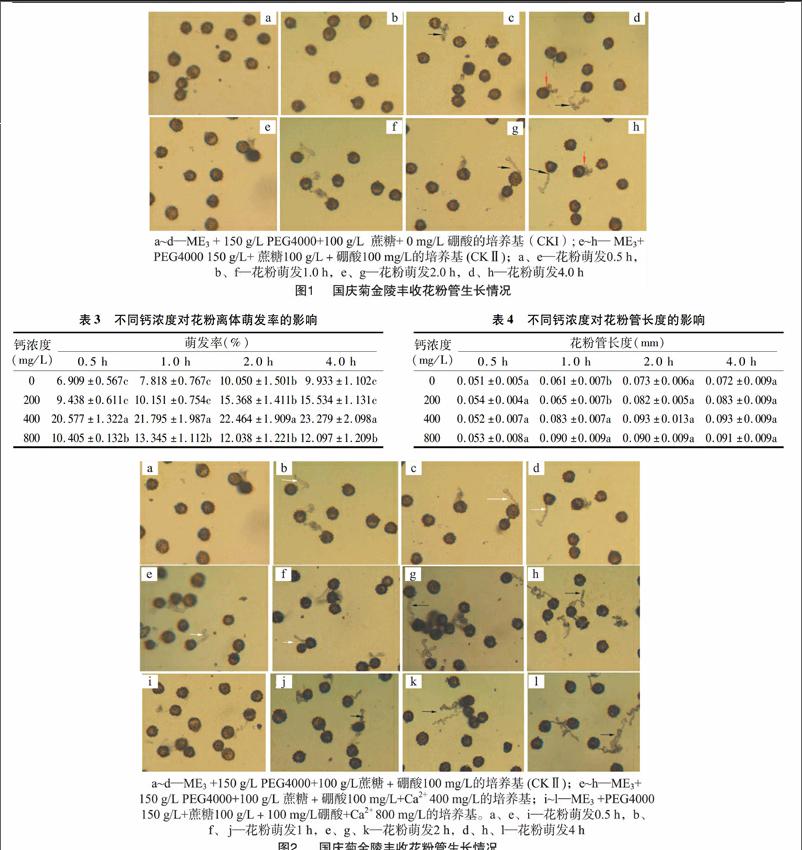
鈣顯著提高了金陵豐收花粉萌發率,隨著鈣濃度的升高花粉萌發率顯著增加,以鈣濃度為400 mg/L處理中的花粉萌發率最高,當其濃度增加到800 mg/L時,花粉的萌發率反而下降(表3)。
2.4鈣對花粉形態和花粉管生長的影響
培養基中添加Ca2+對花粉管生長的影響不顯著(表4),對花粉管品質的影響較大,外源鈣濃度過高以及離體培養時間過長都不適合金陵豐收花粉管生長,當外源Ca2+達到400 mg/L時,在0~1 h期間花粉管生長正常(圖2-e,圖2-f),2 h后花粉生長出現異常(圖2-g,圖2-h);當外源Ca2+達到800 mg/L時花粉管末端細弱、畸形(圖2-j至圖2-l)。
3討論
硼在植物體內含量低,分布不均勻,以花中含量最高,參與果膠物質的合成,有利于花粉管壁的形成,因此有利于花粉管的生長[14]。迄今有關硼酸對花粉萌發和花粉管生長的研究報道較多,均認為一定濃度的硼酸有利于花粉萌發和花粉管生長[15]。趙宏波等研究認為菊花花粉在離體培養0.5~2.0內,萌發率呈直線上升趨勢,2 h之后花粉的萌發率增加不顯著,外源硼和鈣對金陵豐收花粉萌發都是必需的[13],本研究得出以上相同的結論。本研究還發現,一定濃度的鈣能顯著提供花粉萌發率并使生長健壯,但濃度過高或培養時間過長時花粉萌發率反而受到抑制,2 h后花粉細弱畸形。不同植物種類的花粉萌發和花粉管生長所需的最適硼酸濃度不同,杜紀紅等研究表明,0.1%的硼酸可提高大多數桃品種花粉萌發率[3],本研究發現100 mg/L)硼酸對金陵豐收萌發最有利。
參考文獻:
[1]李辛雷,陳發棣.菊花二倍體野生種與栽培種間雜種的幼胚拯救[J]. 林業科學,2006,42(11):42-46.
[2]龔明,曹宗巽. 鈣和鈣調素對花粉萌發和花粉管生長的調控[J]. 植物生理學通訊,1995,31(5):321-328.
[3]杜紀紅,葉正文,蘇明申,等. 桃花粉離體萌發和花粉管生長特性研究[J]. 西北植物學報,2011,31(1):64-71.
[4]杜玉虎,綦影,蔣錦標,等. 蔗糖、鈣和硼對榆葉梅花粉離體萌發及花粉管生長的影響[J]. 北方園藝,2008(8):106-109.
[5]儲立民,金愛紅,徐冬青,等. 鈣離子濃度對絲瓜花粉萌發和花粉管生長的影響[J]. 河南農業科學,2005(4):56-58.
[6]陳俊愉,崔嬌鵬.地被菊培育與造景[M]. 北京:中國林業出版社,2006:6-36.
[7]龔明,楊中漢,曹宗巽.鈣對花粉萌發的啟動產效應和對花粉管生長的調節作用[J]. 北京大學學報:自然科學版,1995,31(2):249,238-249.
[8]胡適宜.被子植物胚胎學[M]. 北京:人民教育出版社,1982:103-136.
[9]Blevins D G,Lukaszewski K M. Boronin plantstructure and function[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1998,49:481-500.
[10]Li Y Q,Chen F,Linskens H F. Distribution of unesterified and esterified pectins in cell walls of pollen tubes of flowering plants[J]. Sexual Plant Reproduction,1994,7(3):145-152.
[11]楊曉東,孫素琴,李一勤.硼缺乏導致花粉管細胞壁多糖分布的改變[J]. 植物學報,1999,41(11):1169.
[12]Leduc N,Monnier M,Douglas G C. Germination of trinucleated pollen:formu lation of a new medium for Capsella bursa-pastoris[J]. Sexual Plant Reproduction,1990,3(4):228-235.
[13]趙宏波,陳發棣,房偉民.栽培小菊和幾種菊屬植物花粉離體萌發研究[J]. 南京農業大學學報,2005,28(2):22-27.
[14]Jackson J F. Borate control of energy driven protein secretion from pollen and interaction of borate with auxin or herbicide a possible role for boron in membrane events[J]. Plant Physiology and Biochemistry,1991,10:221-229.
[15]符碧. 尿素和硼及生長調節劑對荔枝花粉萌發與生長的影響[J]. 云南師范大學學報:自然科學版,2001,21(3):62-65.田慧敏,文靜,任芳. 色釘菇(Chroogomphus rutilus)形態學和ITS測序鑒定 [J]. 江蘇農業科學,2016,44(5):261-263.
doi:10.15889/j.issn.1002-1302.2016.05.075

