黃河流域農田土壤有機氯農藥殘留污染特征研究
范釗
摘要:采用現場采樣與室內分析相結合的方法,利用氣相色譜儀測定了黃河流域農田土壤有機氯農藥(OCPs)殘留物組成。結果表明:黃河流域農田土壤中殘留有機氯農藥主要是六六六(HCHs)、滴滴涕(DDTs)和六氯苯(HCB),其中HCHs是土壤殘留有機氯農藥類的主要成分。氯丹(TC+CC)、九氯(TN+CN)、硫丹(α-End+β-End)殘留量較低,是黃河流域農田土壤中普遍存在的一類持久性有機污染物。土壤OCPs農藥均隨土層深度的增加而急劇降低,并且隨深度的增加其降低幅度逐漸增加,垂直分布表現出明顯的“表聚性”;不同土地利用類型OCPs農藥含量基本為水田>菜地>耕地>林地,并且相同土層OCPs農藥含量基本表現為水田>菜地>耕地>林地,其中CC和β-End在不同類型農田土壤中差異均不顯著。土壤DDTs含量平均值順序基本表現為o,p′-DDT>p,p′-DDT>p,p′-DDD,o,p′-DDT是DDT類污染物的主體物質;DDT/(DDD+DDE)均大于1,說明黃河流域農田土壤的DDT降解程度低。土壤HCH含量基本表現為β-HCH>γ-HCH> α-HCH>δ-HCH,其中α-HCH和β-HCH所占比例相對較高,具有較高的潛在危害性;菜地和耕地土壤α-HCH/γ-HCH比值小于1,說明菜地和耕地土壤中HCH同系物之間發生相互轉化,存在較多的γ-HCH殘留。主成分分析結果顯示α-HCH、β-HCH、γ-HCH和δ-HCH在第1主成分上有較高載荷;DDTs類物質在第2主成分上有較高載荷;TC和CC、α-End和β-End、TN和CN在第3主成分上有較高載荷。Pearson相關分析表明,TOC與HCHs、HCB、OCPs呈極顯著正相關(P<0.01),與α-End和β-End呈顯著正相關(P<0.05),與DDTs相關性不顯著,說明黃河流域農田土壤HCHs、HCB含量在很大程度上受TOC影響,HCHs與HCB、DDTs,HCB、DDTs與九氯(TN+CN)類農藥的分布機制和輸入來源可能相一致,在決定有機氯農藥含量和分布上起著重要的作用。
關鍵詞:黃河流域;農田;土壤;有機氯農藥;殘留
中圖分類號: X53文獻標志碼: A文章編號:1002-1302(2016)05-0414-06
有機氯農藥(organochlorine pesticides,OCPs)是一類環境中廣泛存在的持久性有機污染物(POPs),其化學性質異常穩定(持久性、脂溶性、毒性和生物累積性)[1-2]。它們可以通過土壤與大氣的交換和食物鏈進入生物體內,對生態環境和人體的健康造成潛在風險[3-5]。土壤是環境中有機氯農藥巨大的匯集體,它不僅可以承接來自其他環境介質的污染物,還是其他環境介質的污染源[6-7]。我國是OCPs生產和使用大國,OCPs在土壤中的殘留非常普遍,盡管我國從1983年起已禁止使用,但從目前的研究來看,我國各地區土壤等環境中仍有不同程度的檢出[8-10]。據不完全統計,我國生產的滴滴涕(DDTs)和六六六(HCHs)分別占全球生產總量的33%和20%[11];20世紀40年代,OCPs由于具有較好的殺蟲效果,加上其價格低廉和生產成本低的特點,在全球得到廣泛的應用[12-13];由于高毒性、脂溶性、穩定性以及高殘留等原因,20世紀70年代OCPs在全球范圍內被禁用,盡管大部分有機氯農藥已經禁用20~30 年,但其在土壤環境中仍有廣泛的殘留,我國在1983年5月全面禁止使用OCPs,但由于其難降解的性質,危害一直留存至今難以消除[12,14];《關于持久性有機污染物的斯德哥爾摩公約》中首批列入受控名單的12種持久性有機污染物中,有9種是有機氯農藥,包括艾氏劑(Aldrin)、狄氏劑、(Dieldrin)、異狄氏劑(Endrin)、滴滴涕(DDT)、氯丹(Chlordane)、滅蟻靈(Mirex)、毒殺芬(Toxaphene)、七氯(Heptachelor)和六氯苯(Hexachlorbenzene)[15-16]。作為備受關注的環境污染物之一,大量學者對OCPs的研究涉及到大氣、土壤、沉積物等,我國各地也發現OCPs在土壤中的殘留非常普遍[8-10],但前人所研究的OCPs大多集中在HCH和DDT上,對其他類型OCPs的研究則鮮見報道,同時也不能較為全面地反映出OCPs在環境中的殘留狀況。為了研究和對比OCPs在黃河流域農田土壤中的分布狀況,筆者在2014年開展了對黃河流域農田土壤有機氯農藥的監測工作,并結合以往的研究進行對比分析,以期為改善黃河流域農田土壤環境提供參考。
1材料與方法
1.1樣品采集與預處理
2014年6—8月沿黃河流域河南段農田生態系統(水田、菜地、耕地和林地)共布設20個采樣點(每個生態系統5個重復),每個樣點重復取樣3次,用土鉆將土壤分為0~10、10~20、20~30 cm土層,由采樣中心點及附近的4個點組成1個采樣單位,每個代表樣最終取樣1 kg,多出的部分采用四分法棄去,采樣點的設置考慮土地利用類型和土壤類型的代表性,并兼顧歷史上有機氯農藥使用的特點,樣品采集后保存于潔凈、密封的聚四氟乙烯塑料瓶中,帶回實驗室-18 ℃保存備用。
1.2試驗材料與儀器
1.2.1試劑色譜標準物(100 μg/mL):p,p′-DDT,o,p′-DDT,p,p′-DDE,o,p′- DDE,p,p′-DDD,o,p′-DDD,Aldrin,α-HCH,β-HCH,γ-HCH,δ-HCH,cis-chlordane,transchlordane,Dieldrin,α-End,β-End,Endosulfan sulfate,Endrin,Endrin aldehyde,Endrin Ketone,Heptachlor,Heptachlor epoxide,methoxychlor,cis-nonachlor,trans-nonachlor和hexach lorobenzene等有機氯農藥標準樣品,回收率指示物(100 μg/mL):2,4,5,6-四氯間二甲苯(TCMX)、多氯聯苯(PCB-209)和內標五氯硝基苯(PCNB)。
H2SO4(98%,分析純);無水Na2SO4(分析純),在馬福爐中以650 ℃烘4 h,待冷至常溫后,置于玻璃瓶中密封放置,供試驗用;以結晶Na2SO4(分析純)配制的6%Na2SO4水溶液;石油醚(沸程60~90 ℃,分析純),重蒸收集69~72 ℃餾分;丙酮(分析純);硅膠和中性氧化鋁用二氯甲烷索氏抽提 72 h,在180 ℃和250 ℃分別活化12 h,再在干燥器中冷卻平衡12 h,加3%的二次蒸餾水去活化,平衡12 h后浸于正己烷中待用,標準型氟羅里硅土小柱,高純氮氣(體積分數99.9%以上)用于樣品濃縮,高純氦氣(體積分數99.9%以上)用于GC載氣。
1.2.2儀器配自動進樣器氣相色譜儀(島津公司HP 6890A),旋轉蒸發儀(德國Heidolph 公司)及真空泵,氮吹儀,振蕩器,TDL-5型離心分離機和EYELA-FDU-830型凍干機(日本);所用器皿均經超聲波清洗器清洗,再經自來水蒸餾水沖洗,于烘箱中(180±2) ℃烘干,臨用前經有機溶劑淋洗。
1.3測定方法
1.3.1樣品處理與分析將土壤樣品低溫下風干,用瑪瑙研缽研磨后過0.3 mm篩。準確稱取土樣20 g于索氏抽濾筒中,在250 mL平底燒瓶中加入200 mL二氯甲烷和2 g經活化的銅片以及回收率指示物,在46 ℃恒溫水浴鍋上進行索氏抽提48 h,冷卻循環水溫調節為22 ℃,回流速度控制在5~6次/h。將提取液置于旋轉蒸發儀上濃縮至1 mL,加入10 mL 正己烷轉換劑,再濃縮至1~2 mL。層析柱為過硅膠/氧化鋁(2 ∶1),凈化柱為進口層析柱(內徑1 cm),采用正己烷濕法裝柱,由下至上依次為硅膠12 cm,氧化鋁6 cm,無水硫酸鈉 2 cm。先用15 mL正己烷淋洗出烷烴類化合物,再用70 mL二氯甲烷/正己烷(3 ∶7)淋洗出有機氯農藥組分。淋洗液經正己烷轉換溶劑后用高純氮氣吹至0.2 mL,加入內標物定量分析OCPs含量。
1.3.2色譜條件和工作條件采用SHIMADZU GC-2010 氣相色譜儀(日本島津公司)、ECD檢測器、DB-5彈性石英毛細管柱。載氣和補充氣均為高純N2。程序升溫:始溫 100 ℃ 保持1 min,再以4 ℃/min的速率升溫至290 ℃,保持10 min。采用內標法峰面積定量樣品中目標化合物的含量。進樣口溫度260 ℃,不分流進樣,進樣量為1 μL,檢測器溫度310 ℃,以峰高外標法定量。按照美國EPA要求,在每個樣品中都加入了回收率指示物,對整個分析流程的回收率進行監控。同時每18 個樣品做空白,加標空白,基質加標,以保證分析過程中的準確性。對所測化合物采用農藥標準樣品的保留時間進行定性。按照前述方法進行提取、凈化和測定,各異構體、代謝物最低檢出濃度(μg/kg),各化合物的平均回收率在90%以上,相對標準偏差在3%之內,所得數據均經回收率校正,方法具有較好的精密度,符合農藥殘留檢測要求。
元素分析儀(CHNSV arioEL Ⅲ)測定總有機碳(TOC),取5 g左右土壤樣品,加入1 mol/L的HCl,浸泡24 h,離心分離棄去酸洗液,于80 ℃條件下烘干,放入干燥器至恒質量,準確稱量10~20 mg,元素分析儀測定TOC含量。
2結果與分析
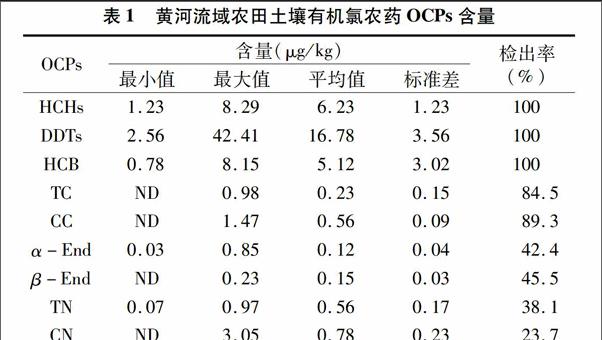
2.1黃河流域農田土壤有機氯農藥OCPs含量
OCPs的降解是個復雜的過程,受很多環境因素的影響,地理位置、植被特征、土壤理化性質、農藥使用量等都會影響其土壤殘留量[17],盡管有機氯農藥自1983年起已在我國禁用,本研究中黃河流域農田土壤中仍有不同程度的檢出。從黃河流域農田土壤OCPs含量的描述性統計可知,黃河流域農田土壤OCPs均有不同程度的檢出率。HCHs、HCB和DDTs的檢出率均為100%,平均值分別為6.23、16.78、5.12 μg/kg,三者占有機氯農藥殘留總量的90%以上,α-硫丹(α-End)、β-硫丹(β-End)、反式氯丹(TC)、順式氯丹(CC)、反式九氯(TN)和順式九氯(CN)類農藥的檢出率分別為84.5%、89.3%、42.4%、45.5%、38.1%和23.7%,硫丹硫酸鹽、狄氏劑、異狄氏劑、艾氏劑、七氯、外環氧七氯、異狄氏劑醛、滅蟻靈、異狄氏劑酮和甲氧滴滴涕檢出率為0,氯丹(TC+CC)殘留總量相當低,僅占總有機氯農藥類的2%左右,硫丹(α-End+β-End)占總有機氯農藥類的1%左右,這可能與OCPs本身的理化性質有關,農藥種類不同,性質各異,如農藥本身的蒸氣壓、擴散系數、水溶性等[18]。由于性質上的差異直接導致其環境行為不同,如七氯、艾氏劑等消失較快,而DDT和狄氏劑則消失較慢。表明黃河流域農田土壤歷史上曾使用過HCHs、HCB和DDTs,其中DDTs占總有機氯農藥類OCPs農藥的比例最高,而DDTs仍是黃河流域農田土壤中有機氯農藥類OCPs農藥污染的主要物質,并且使用量較大,而硫丹硫酸鹽、狄氏劑、異狄氏劑、艾氏劑、七氯、外環氧七氯、異狄氏劑醛、滅蟻靈、異狄氏劑酮和甲氧滴滴涕則未用或很少使用過。
DDTs是DDE、DDD和DDT含量之和,黃河流域農田土壤中DDTs檢出率為100%,最低值為2.56 μg/kg,最高值為42.41 μg/kg,平均值為16.78 μg/kg。在GB 15618—1995《土壤環境質量標準》中,一級土壤DDTs的標準限量為 50 μg/kg,在黃河流域農田所有土壤樣品中,沒有超過該質量標準,說明黃河流域農田土壤較為清潔。
HCB是普遍存在的一類持久性有機污染物,來源比較復雜,主要用作中間體生產五氯酚和五氯酚鈉,五氯酚鈉會向環境釋放HCB,加上HCB在土壤的半衰期(2.7~5.7年)較長,致使HCB在土壤中長期殘留[17,19]。參照加拿大環境質量指南,黃河流域農田土壤樣品中HCB含量較低,由表1可知,黃河流域農田土壤HCB殘留量平均值為5.12 μg/kg,最高值仍低于加拿大環境質量指南中農用土壤HCB的限量值 50 μg/kg,表明黃河流域農田土壤HCB殘留量較低。
氯丹類物質TC和CC檢出率分別為84.5%和89.3%,平均質量分數分別為0.23 μg/kg和0.56 μg/kg,根據美國土壤中氯丹初級修復目標,氯丹的質量分數分別270 μg/kg(居住區)和960 μg/kg(工業區),氯丹屬于高殘留農藥而較難降解,而黃河流域農田土壤氯丹殘留量并不高,說明歷史上該地區氯丹的使用范圍和使用量不是很大,氯丹并沒有造成危害。硫丹類農藥α-硫丹(α-End)和β-硫丹(β-End)檢出率分別為42.4%和45.5%,平均質量分數分別為0.12 μg/kg和0.15 μg/kg,均低于南亞熱帶土壤中硫丹類農藥的含量(6.1 μg/kg和28.8 μg/kg),說明歷史上使用量并不大。
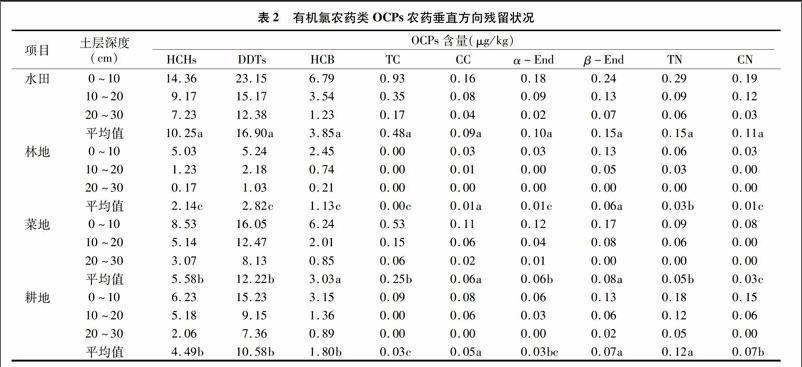
2.2黃河流域農田土壤有機氯農藥垂直方向殘留狀況
表2顯示了黃河流域農田土壤中OCPs垂直方向分布和殘留狀況。由表2可知,黃河流域農田土壤中OCPs農藥均隨土層深度的增加而急劇降低,并且隨深度的增加其降低幅度逐漸增加,由此可知,黃河流域農田土壤中OCPs農藥主要集中在土壤表層(0~10 cm),垂直分布表現出明顯的“表聚性”。從黃河流域不同類型農田土壤OCPs平均含量可知,不同OCPs組分在黃河流域農田土壤中含量有很大差異。HCHs、HCB、TC、CC、α-End、β-End、TN和CN含量在不同利用類型土壤中的趨勢為水田>菜地>耕地>林地,并且相同土層HCHs、HCB、TC、CC、α-End、β-End、TN和CN含量基本表現為水田>菜地>耕地>林地,其中CC和β-End在不同類型農田土壤中差異均不顯著。水田土壤的耕層中以小于 1 mm 的小團粒和微團粒為主,而土壤負電荷又多集中在這些小土壤顆粒上,因此水田土壤特殊的機械結構組成與OCPs高殘留有很大關系[17,19]。另外,水田土壤經常處于厭氧環境,有利于有機質累積,因此水田土壤有機質含量較高,而有機質對OCPs有很強的吸附作用,這是水田土壤OCPs殘留較高的又一重要原因[16-17]。
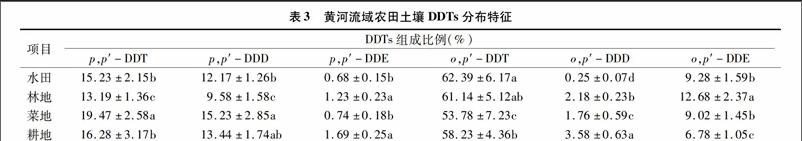
2.3黃河流域農田土壤DDTs分布特征
由表3可知,受DDT污染的土壤經過長期的風化后,p,p′-DDT,p,p′-DDD,p,p′-DDE,o,p′-DDT,o,p′-DDD和o,p′-DDE均有檢出;p,p′-DDT所占比例為13.19%~17.47%、p,p′-DDD所占比例為9.58%~15.23%、p,p′-DDE所占比例為0.68%~1.69%,o,p′-DDT所占比例為53.78%~62.39%,o,p′-DDD占0.25%~3.58%,o,p′-DDE占6.78%~12.68%,黃河流域農田土壤DDTs含量平均值順序基本表現為o,p′-DDT>p,p′-DDT >p,p′-DDD;而p,p′-DDE和o,p′-DDD所占比例微乎其微,由此可見在黃河流域農田土壤中o,p′-DDT是DDT類污染物的主體物質。DDE和DDD是DDT的降解產物,DDT在厭氧條件下通過微生物的作用轉化為DDD,在好氧條件下則轉化為DDE[20]。DDT在我國曾大量使用,采集的農田土壤均有DDT檢出,DDT、DDE和DDD類化合物檢出率均為100%,基本表現為DDE>DDT>DDD,DDTs的轉化產物主要是以DDE為主,而較低的DDD比例可以推斷本研究的農田土壤處于良好氣環境中,厭氣環境較少。
由圖1可知,通過DDT/(DDD+DDE)的比值,可以指示DDT的降解程度和輸入情況,DDT在土壤中經過長期的物理、化學及生物變化后,DDT/(DDE+DDD)應小于1,如果大于1,表明近期有DDTs輸入[12,14]。由圖1可知黃河流域農田土壤中DDT/(DDD+DDE)均大于1,說明黃河流域農田土壤的DDT降解程度低,屬于殘留污染,很可能有新的污染輸入,其中檢測出p,p′-DDT也可以說明存在新的污染源。
2.4黃河流域農田土壤HCHs分布特征
HCHs為α-HCH、β-HCH、γ-HCH和δ-HCH含量之和,由表4可知,HCHs檢出率為100%,在HCHs中,α-HCH所占比例為19.18%~26.89%、β-HCH所占比例為4623%~53.18%、γ-HCH所占比例為13.24%~28.79%、δ-HCH所占比例為1.31%~10.00%,土壤中平均含量基本表現為β-HCH>γ-HCH>α-HCH>δ-HCH,其中α-HCH和β-HCH所占比例相對較高,具有較高的潛在危害性。β-HCH具有致癌性,由于氯取代位置的特殊性,具有較強的吸附性,相對于其他3種同系物,是環境中最不容易降解的同系物,能持久存在環境中[21]。在本研究中β-HCH占有較高比例(46.23%~53.18%),表明了HCHs在環境中發生了較長時間的變化,大氣沉降也可能是土壤β-HCH來源之一。
一般而言,α-HCH/γ-HCH比值一般在4~7之間,超出這個范圍說明存在環境變化影響的因素[22];有研究認為,α-HCH/γ-HCH的比值接近于1,則意味著有新的γ-HCH輸入[12,14]。由圖2可知,黃河流域農田土壤α-HCH/γ-HCH比值均小于4,說明環境變化因素對黃河流域農田土壤HCH影響很大。另外,菜地和耕地土壤α-HCH/γ-HCH比值小于1,說明菜地和耕地土壤中HCH同系物之間發生相互轉化,土壤均有較多的γ-HCH殘留,說明菜地和耕地土壤HCHs除歷史長期殘留外,還有可能存在新的輸入來源。工業HCH和林丹是2種使用最廣泛的HCH產品,前者已被禁用,而后者目前仍被用作殺蟲劑。這2種農藥的組成有很大差異,工業HCH中γ-HCH含量為8%~15%,而林丹中γ-HCH 的含量在99%以上,因此α-HCH/γ-HCH的比值還能用于判斷土壤中HCH的來源,α-HCH/γ-HCH比值高則指示來源于工業HCH,反之則來源于林丹。本次研究顯示林地α-HCH/γ-HCH比值較高,可能源于林丹;另外,β-HCH 在HCH 4種異構體含量中所占比重最大,說明經過長期的降解作用,結構對稱、性質穩定的β-HCH含量逐漸增加。
2.5黃河流域農田土壤有機氯農藥主成分分析
主成分分析(principle component)是在1組變量中找出其方差和協方差矩陣的特征量,將多個變量通過降維轉化為少數幾個綜合變量的統計分析方法,能夠從多變量中選擇少數幾個綜合獨立的新變量,來反映原來的多變量所包含的大部分信息[23]。本研究采用SPSS軟件的相關分析模塊進行處理,以農田土壤有機氯農藥含量作為原變量,通過計算變量方差和協方差矩陣的特征量,將多個變量通過降維對有機氯農藥信息進行集中和提取,識別出起主導作用的有機氯農藥。表5是有機氯農藥含量的總方差分解表,根據特征值大于1的原則,選取了3個主成分PC1、PC2、PC3,前3個主成分對各變量的方差貢獻率分別為42.168%、68.580%、85.128%,其所含信息占總體信息的85.128%,即前3個主成分對17個變量所涵蓋的大部分信息進行了概括,能夠解釋原始信息。表6顯示原有17個變量在3個主成分上的載荷,其中α-HCH、β-HCH、γ-HCH和δ-HCH在第1主成分上有較高載荷;DDTs類物質在第2主成分上有較高載荷;TC和CC、α-End和β-End、TN和CN在第3主成分上有較高載荷,上述3個主成分所反映的信息很可能反映出黃河流域農藥的使用習慣及農藥化學組成的不同。如第1主成分主要包含了HCH的3種不同異構體,即主要代表HCH的使用;第2主成分包括了DDTs幾種異構體,主要代表DDTs的使用;第3主成分所包括的OCPs比較復雜,既包括以TC和CC為原料的OCPs,也包括了以環戊二烯為原料的OCPs,如α-End和β-End等,所以第3主成分可能主要反映了農藥的使用習慣。
2.6黃河流域農田土壤有機氯農藥與TOC之間的Pearson相關性分析
Pearson相關系數分析了黃河流域農田土壤中總有機碳(TOC)與OCPs之間的相關性(表7),并評估TOC對OCPs含量和分布的影響。結果表明,TOC與HCHs、HCB、OCPs呈極顯著正相關(P<0.01),相關系數分別為0.914、0.869和0873,與α-End和β-End呈顯著正相關(P<0.05),相關系數分別為0.623和0.617,與DDTs相關性不顯著,由此,我們可以推斷黃河流域農田土壤HCHs、HCB含量在很大程度上受TOC影響,并且土壤中TOC含量在決定OCPs含量上起著重要的作用。結果還顯示:HCHs、DDTs和HCB含量與OCPs總含量之間呈顯著正相關(P<0.05),HCHs與HCB和DDTs之間呈顯著正相關(P<0.05),HCB與九氯(TN+CN)類農藥之間呈顯著正相關(P<0.05),DDTs與九氯(TN+CN)類農藥之間呈顯著正相關(P<0.05),說明HCHs與HCB、DDTs,HCB、DDTs與九氯(TN+CN)類農藥的分布機制和輸入來源可能相一致。
3結論
(1)黃河流域農田土壤中殘留有機氯農藥種類較多,主要是六六六(HCHs)、滴滴涕(DDTs)和六氯苯(HCB),三者占有機氯農藥殘留總量的90%以上,其中HCHs所占比例較大,是黃河流域農田土壤殘留有機氯農藥類的主要成分,林地有機氯農藥所占比例較小,總體污染程度較輕;黃河流域農田土壤DDTs含量沒有超過國家標準,整體較為清潔。
(2)黃河流域農田土壤中氯丹(TC+CC)、九氯(TN+CN)、硫丹(α-End+β-End)殘留量較低,是黃河流域農田土壤中普遍存在的一類持久性有機污染物,并沒有造成危害,而硫丹硫酸鹽、狄氏劑、異狄氏劑、艾氏劑、七氯、外環氧七氯、異狄氏劑醛、滅蟻靈、異狄氏劑酮和甲氧滴滴涕則未用或很少使用過。
(3)黃河流域農田土壤中OCPs農藥均隨土層深度的增加而急劇降低,并且隨深度的增加其降低幅度逐漸增加,垂直分布表現出明顯的“表聚性”;不同OCPs組分在黃河流域農田土壤中含量有很大差異,不同利用類型基本為水田>菜地>耕地>林地,并且相同土層OCPs農藥含量基本表現為水田>菜地>耕地>林地,其中CC和β-End在不同類型農田土壤中差異均不顯著。
(4)黃河流域農田土壤DDTs含量平均值順序基本表現為o,p′-DDT>p,p′-DDT>p,p′-DDD,o,p′-DDT是DDT類污染物的主體物質;DDT/(DDD+DDE)均大于1,說明黃河流域農田土壤的DDT降解程度低。
(5)黃河流域農田土壤HCH含量基本表現為β-HCH>γ-HCH>α-HCH>δ-HCH,其中α-HCH和β-HCH所占比例相對較高,具有較高的潛在危害性;菜地和耕地土壤α-HCH/γ-HCH比值小于1,說明菜地和耕地土壤中HCH同系物之間發生相互轉化,存在較多的γ-HCH殘留。
(6)主成分分析結果顯示α-HCH、β-HCH、γ-HCH和δ-HCH在第1主成分上有較高載荷;DDTs類物質在第2主成分上有較高載荷;TC和CC、α-End和β-End、TN和CN在第3主成分上有較高載荷。Pearson相關分析表明,TOC與HCHs、HCB、OCPs呈極顯著正相關(P<0.01),與α-End和β-End呈顯著正相關(P<0.05),與DDTs相關性不顯著,由此,可以推斷黃河流域農田土壤HCHs、HCB含量在很大程度上受TOC影響,并且土壤中TOC含量在決定OCPs含量上起著重要的作用,HCHs與HCB、DDTs,HCB、DDTs與九氯(TN+CN)類農藥的分布機制和輸入來源可能相一致。
參考文獻:
[1]Zacharis C K,Rotsias I,Zachariadis P G,et al. Dispersive liquid-liquid microextraction for the determination of organochlorine pesticides residues in honey by gas chromatography-electron capture and ion trap mass spectrometric detection[J]. Food Chemistry,2012,134(3):1665-1672.
[2]Waliszewski S M,Caba M,Rodríguez Díaz S S,et al. Levels of organochlorine pesticides residues in human adipose tissue,data from Tabasco,Mexico[J]. Bulletin of Environmental Contamination and Toxicology,2012,89(5):1062-1067.
[3]Sojinu O S,Sonibare O O,Ekundayo Olusegun O,et al. Assessment of organochlorine pesticides residues in higher plants from oil exploration areas of Niger Delta,Nigeria[J]. Science of the Total Environment,2012,433:169-177.
[4]Bempah C K,Buah-Kwofie A,Enimil E,et al. Residues of organochlorine pesticides in vegetables marketed in Greater Accra Region of Ghana[J]. Food Control,2012,25(2):537-542.
[5]Choi J Y,Yang D B,Hong G H,et al. Distribution and bioaccumulation of polychlorinated biphenyls and organochlorine pesticides residues in sediments and Manila clams (Ruditapes philippinarum) from along the Mid-Western coast of Korea[J]. Marine Pollution Bulletin,2014,85(2):672-678.
[6]Wong F,Kurt-Karakus P,Bidleman T F. Fate of brominated flame retardants and organochlorine pesticides in urban soil:volatility and degradation[J]. Environmental Science & Technology,2012,46(5):2668-2674.
[7]Mishra K,Sharma R C,Kumar S. Contamination levels and spatial distribution of organochlorine pesticides in soils from India[J]. Ecotoxicology and Environmental Safety,2012,76(2):215-225.
[8]岳強,管玉峰,涂秀云,等. 廣東北江上游流域農田土壤有機氯農藥殘留及其分布特征[J]. 生態環境學報,2012,21(2):321-326.
[9]瞿程凱,祁士華,張莉,等. 福建戴云山脈土壤有機氯農藥殘留及空間分布特征[J]. 環境科學,2013,34(11):4427-4433.
[10]崔健,王曉光,都基眾,等. 沈陽郊區表層土壤有機氯農藥殘留特征及風險評價[J]. 中國地質,2014,41(5):1705-1715.
[11]迭慶杞,聶志強,黃啟飛,等. 珠江三角洲土壤中有機氯農藥的分布特征[J]. 農業環境科學學報,2014,33(2):298-304.
[12]岳強,管玉峰,涂秀云,等. 廣東北江上游流域農田土壤有機氯農藥殘留及其分布特征[J]. 生態環境學報,2012,21(2):321-326.
[13]瞿程凱,祁士華,張莉,等. 福建戴云山脈土壤有機氯農藥殘留及空間分布特征[J]. 環境科學,2013,34(11):4427-4433.
[14]裴紹峰,劉海月,葉思源. 我國南方主要城市土壤有機氯農藥殘留及分布特征[J]. 山東農業大學學報:自然科學版,2014,45(5):768-774.
[15]穆季平. 持久性有機污染物(POPs)研究進展[J]. 環境科學與技術,2006,29(z1):140-143.
[16]李敬光,趙云峰,吳永寧. 我國持久性有機污染物人體負荷研究進展[J]. 環境化學,2011,30(1):5-19.
[17]Katayama A,Matsumura F. Degradation of organochlorine pesticides,particularly endosulfan,by Trichoderma harzianum[J]. Environmental Toxicology and Chemistry,1993,12(6):1059-1065.
[18]Yu Binbin,Zeng Jingbin,Gong Lifen,et al. Investigation of the photocatalytic degradation of organochlorine pesticides on a nano-TiO2 coated film[J]. Talanta,2007,72(5):1667-1674.
[19]Aigner E J,Leone A D,Falconer R L. Concentrations and enantiomeric ratios of organochlorine pesticides in soil from the US Corn Belt[J]. Environmental Science & Technology,1998,32(9):1162-1168.
[20]Miglioranza K,Aizpún de Moreno J E,Moreno V J,et al. Fate of organochlorine pesticides in soils and terrestrial biota of “Los Padres” pond watershed,Argentina[J]. Environmental Pollution,1999,105(1):91-99.
[21]Abou-Arab A K. Degradation of organochlorine pesticides by meat starter in liquid media and fermented sausage[J]. Food and Chemical Toxicology,2002,40(1):33-41.
[22]Duinker J C,Hillebrand M J. Behaviour of PCB,pentachlorobenzene,hexachlorobenzene,α-HCH,γ-HCH,β-HCH,dieldrin,endrin and p,p′-DDD in the rhinemeuse estuary and the adjacent coastal area[J]. Netherlands Journal of Sea Research,1979,13(2):256-281.
[23]krbic' B,Duriic'-Mladenovic' N. Principal component analysis for soil contamination with organochlorine compounds[J]. Chemosphere,2007,68(11):2144-2152.羅春香,楊君,段建南,等. 基于城鄉接合部土地利用變化的生態系統服務價值研究[J]. 江蘇農業科學,2016,44(5):420-425.

