接種枯草芽孢桿菌和叢枝菌根真菌促進(jìn)紅三葉修復(fù)石油污染土壤
王麗麗++楊謙

摘要:在溫室內(nèi)通過(guò)盆栽試驗(yàn)的方法,比較對(duì)照組(CK)、單純接種枯草芽孢桿菌(Bacillus subtilis,簡(jiǎn)稱(chēng)Bs)、單純接種叢枝菌根真菌——地球囊霉(Glomus geosporum,簡(jiǎn)稱(chēng)Gg)、混合接種Gg+Bs的紅三葉種植于石油污染的土壤中后,植株與土壤理化性狀差異。實(shí)驗(yàn)結(jié)果表明,經(jīng)過(guò)60 d修復(fù)后,與對(duì)照組相比,單純或混合接種處理均能顯著增加紅三葉地上和地下干生物量(P<0.05),可溶性糖含量和脯氨酸含量均顯著升高(P<0.05),葉片CAT、POD活性顯著升高(P<0.05),丙二醛含量明顯減少(P<0.05)。在各種接種處理中,紅三葉根際與非根際土壤脫氫酶活性和土壤中總石油烴降解率均顯著升高(P<0.05)。Bs和Gg在紅三葉修復(fù)石油污染土壤和植物抗石油脅迫的能力方面有協(xié)同作用,接種Bs+Gg處理修復(fù)效果要優(yōu)于單獨(dú)接種Bs或Gg。
關(guān)鍵詞:枯草芽孢桿菌;叢枝菌根真菌;紅三葉;石油污染;土壤修復(fù)
中圖分類(lèi)號(hào): X53文獻(xiàn)標(biāo)志碼: A文章編號(hào):1002-1302(2016)05-0526-03
通信作者:楊謙,教授,博士生導(dǎo)師,主要從事環(huán)境微生物方面的研究。E-mail:yangq@hit.edu.cn。石油污染土壤的修復(fù)與治理已經(jīng)成為當(dāng)前亟待解決的問(wèn)題。植物修復(fù)技術(shù)是降解修復(fù)石油污染土壤的一種有效手段,選擇適宜油污區(qū)生長(zhǎng)的綠色植物是實(shí)現(xiàn)植物修復(fù)的前提條件。植物-微生物修復(fù)系統(tǒng)作為農(nóng)業(yè)生態(tài)環(huán)境保護(hù)領(lǐng)域具有價(jià)值和廣闊前景的新型技術(shù),不僅能促進(jìn)土壤中石油污染物的降解和礦化,也能有效提高植物對(duì)石油類(lèi)和其他有機(jī)污染物的修復(fù)效率。植物根際促生細(xì)菌(plant growth promoting rhizobacteria,PGPR)和叢枝菌根真菌(Arbuscular mycorrhiza fungi,AMF)是植物根際微生物的重要組成部分,二者都能加速土壤養(yǎng)分循環(huán),增強(qiáng)污染物的降解能力,可以改善植物根際微生物和土壤酶活性,提高植物對(duì)逆境的抗御能力[1-7]。PGPR 和AMF既可通過(guò)促進(jìn)植物的生長(zhǎng)促進(jìn)彼此在植物根際的繁衍,同時(shí)也存在對(duì)營(yíng)養(yǎng)和生態(tài)位的競(jìng)爭(zhēng)[8]。紅三葉(Trifolium pratense)是一種抗逆性較強(qiáng)的天然牧草,具有發(fā)達(dá)的根系,對(duì)重金屬、干旱、養(yǎng)分脅迫等逆境條件表現(xiàn)出不同的響應(yīng)[9-11]。然而,紅三葉對(duì)石油污染土壤的修復(fù)效果的報(bào)道還很少,有關(guān)枯草芽孢桿菌與地球囊霉對(duì)紅三葉修復(fù)石油污染土壤效果的影響尚不明確。在前期的研究中,我們篩選出了一株根際枯草芽孢桿菌,該菌株對(duì)原油具有一定的降解能力。本研究結(jié)果可為利用PGPR和AMF強(qiáng)化植物原位修復(fù)降解大慶石油生產(chǎn)區(qū)域石油污染土壤提供理論依據(jù)。
1材料和方法
1.1材料
采用受石油污染土壤(黑龍江省大慶市臥里屯草甸土)作為供試基質(zhì),其主要理化性質(zhì)為:pH值(土 ∶水=1 ∶2.5)8.09,有機(jī)質(zhì)35.7 g/kg,全氮含量2.75 g/kg,全磷含量 3.28 g/kg,全鉀含量18.8 g/kg,總石油烴含量75.24 g/kg。采集的土壤經(jīng)風(fēng)干,過(guò)2 mm網(wǎng)篩后,在105 ℃下濕熱滅菌2 h。土壤過(guò)篩時(shí)并未發(fā)現(xiàn)有土著AM真菌。供試植物為紅三葉(Trifolium pratense),將紅三葉種子在10% NaClO中浸泡10 min,然后用無(wú)菌去離子水沖洗數(shù)次,而后置于濕潤(rùn)的濾紙上進(jìn)行催芽處理。供試PGPR菌為枯草芽孢桿菌(Bacillus subtilis,以下簡(jiǎn)稱(chēng)Bs),由本實(shí)驗(yàn)室從問(wèn)荊(Equisetum arvense)分離,保存在-80 ℃。在室溫條件下將Bs接種在TSB液體培養(yǎng)基[12]、28 ℃下振蕩培養(yǎng)24 h,用無(wú)菌水洗后,在4 ℃、4 000 r/min 條件下離心2次后重懸浮于無(wú)菌雙蒸餾水中,用無(wú)菌水調(diào)整PGPR菌懸液濃度為 5×109 CFU/mL。供試AMF菌為地球囊霉(Glomus geosporum,以下簡(jiǎn)稱(chēng)Gg),由本實(shí)驗(yàn)室從雙穗雀稗(Paspalum distichum)根際土壤中分離,保存在-80 ℃。使用時(shí)Gg預(yù)先經(jīng)紅三葉草盆栽繁殖,試驗(yàn)使用的菌劑是含有孢子、根外菌絲和被侵染植物根段的根際土壤混合物,每克菌劑中含有25~35個(gè)孢子。
1.2試驗(yàn)設(shè)計(jì)
試驗(yàn)在溫室內(nèi)進(jìn)行,采用盆栽紅三葉草接種不同菌種,共設(shè)置4個(gè)處理,分別為:(1)對(duì)照組(CK)(僅種植植物,未對(duì)植物進(jìn)行任何接種處理),(2)單獨(dú)接種PGPR(Bs),(3)單獨(dú)接種AMF(Gg),(4)PGPR和AMF混合接種(Gg+Bs)。
盆栽塑料花盆高度30 cm,盆口內(nèi)直徑30 cm,盆底內(nèi)直徑20 cm,裝土前在花盆內(nèi)套上塑料袋,防止污染物隨水流失,每盆裝基質(zhì)3 kg。將菌根真菌Gg接種劑與供試土壤按質(zhì)量比1 ∶20的比例(約150 g)混勻散撒在種子下約2 cm處的土壤中;不接種處理的則加入等量滅活的菌根真菌Gg菌劑,以保持土壤理化性質(zhì)與微生物區(qū)系的一致性。Bs接種處理是將經(jīng)表面消毒處理過(guò)的紅三葉用PGPR菌體懸浮液浸種0.5 h,未接種PGPR處理種子用無(wú)菌雙蒸餾水浸種0.5 h。每處理設(shè)置4個(gè)重復(fù),隨機(jī)排列。
生長(zhǎng)期間維持溫度在(25±5) ℃,光照時(shí)間為14 h/d,每天7至21時(shí)用生物鏑燈補(bǔ)充光照。待各盆出苗齊全后間苗,每盆留50株。植物生長(zhǎng)期間用稱(chēng)質(zhì)量法澆水,苗期每天按基質(zhì)質(zhì)量的10%澆水,植株生長(zhǎng)出現(xiàn)差異后,隔2 d稱(chēng)質(zhì)量一次并按土質(zhì)量的20%補(bǔ)給,確保盆內(nèi)水不外溢,土壤含水量保持在75%左右。
紅三葉草生長(zhǎng)60 d后收割,將根系清洗干凈后,選取1 cm 長(zhǎng)的新鮮根段用曲利本藍(lán)染色法染色[13],制作切片,然后在光學(xué)顯微鏡下采用網(wǎng)格交叉計(jì)數(shù)法統(tǒng)計(jì)菌根侵染率。將鮮葉清洗干凈后,稱(chēng)取5.0 g植株鮮葉片測(cè)定有關(guān)生理指標(biāo);并且對(duì)紅三葉的地下和地上部分烘干后測(cè)定生物量。同時(shí)測(cè)定紅三葉草根際和非根際土壤的脫氫酶活性和總石油烴含量,計(jì)算土壤中總石油烴降解率。
1.3測(cè)定項(xiàng)目
紅三葉生物量采用烘干法測(cè)定,即將收獲后的植株洗凈瀝干在105 ℃下殺青30 min,70 ℃下烘干至恒質(zhì)量,用電子天平稱(chēng)量植株地上和地下生物量。游離脯氨酸(Pro)含量采用茚三酮顯色法[14]測(cè)定;丙二醛(MDA)含量采用硫代巴比妥酸法[14](TBA)測(cè)定;過(guò)氧化物酶(POD)活性采用愈創(chuàng)木酚法測(cè)定[14];過(guò)氧化氫酶(CAT)活性采用H2O2還原法測(cè)定[14];可溶性糖測(cè)定采用蒽酮比色法[14];土壤脫氫酶活性采用TTC比色法[15];土壤中總石油烴含量測(cè)定采用質(zhì)量法。
1.4統(tǒng)計(jì)分析
試驗(yàn)數(shù)據(jù)以x±s表示,運(yùn)用SPSS 17.0軟件對(duì)試驗(yàn)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析。
2結(jié)果與分析
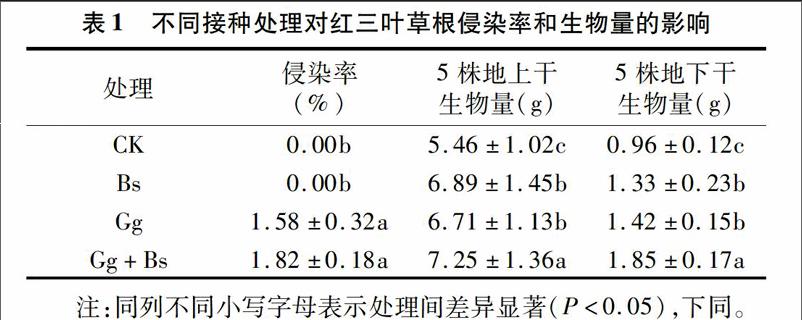
2.1不同接種處理對(duì)紅三葉草根侵染率和生物量的影響
不同接種處理對(duì)在石油污染土壤中生長(zhǎng)的紅三葉草根侵染率和生物量存在很大差異(表1)。對(duì)照組(CK)和接種Bs處理紅三葉草根部侵染率均為0,接種Gg的紅三葉草根部的侵染率為1.58,接種Gg+Bs處理紅三葉草根部侵染率達(dá)到3.32。Gg、Gg+Bs處理與對(duì)照組相比紅三葉草菌根侵染率有顯著增加(P<0.05)。接種處理后紅三葉草的生物量(地上和地下)與對(duì)照組相比均顯著增大(P<0.05),表明接種Bs、Gg可以提高紅三葉草的生物量積累來(lái)緩解石油污染對(duì)紅三葉草生長(zhǎng)帶來(lái)的不利影響。方差分析表明,Gg和Bs之間存在顯著交互效應(yīng)(P<0.05),主要表現(xiàn)在接種Gg+Bs處理協(xié)同促進(jìn)紅三葉生長(zhǎng),增加生物量,表明混合接種處理對(duì)于提高紅三葉在石油污染土壤中的生長(zhǎng)和修復(fù)能力有重要意義。
2.2不同接種處理對(duì)紅三葉草植株生理指標(biāo)的影響
2.2.1不同接種處理對(duì)紅三葉草葉片可溶性糖含量的影響不同接種處理后紅三葉草植株葉片可溶性糖含量都有一定幅度升高(表2)。在石油污染土壤條件下,接種Bs、Gg處理的紅三葉草植株葉片中可溶性糖含量與對(duì)照組相比較顯著升高(P<0.05),這說(shuō)明單獨(dú)接種Bs或Gg可以使紅三葉草葉片可溶性糖含量增加。接種Gg+Bs處理的紅三葉植株葉片可溶性糖明顯高于對(duì)照組(P<0.05),方差分析表明,Gg和Bs之間存在顯著交互作用效應(yīng)(P<0.05),主要表現(xiàn)在接種Gg+Bs處理協(xié)同促進(jìn)紅三葉植株可溶性糖的積累。
2.2.2不同接種處理對(duì)紅三葉草葉片脯氨酸含量的影響由表2可見(jiàn),石油污染土壤條件下,接種Bs、Gg處理的紅三葉植株脯氨酸含量顯著高于對(duì)照組(P<0.05),Gg+Bs處理脯氨酸含量比Gg、Bs處理均顯著升高(P<0.05)。說(shuō)明Bs與Gg之間存在顯著的交互作用效應(yīng),接種Bs+Gg對(duì)于提高石油污染脅迫下紅三葉植株中脯氨酸含量有協(xié)同作用。
2.2.3不同接種處理對(duì)紅三葉草葉片丙二醛含量的影響各接種處理的紅三葉的MDA含量都表現(xiàn)出降低的趨勢(shì)(表2)。與對(duì)照組相比較,接種Bs、Gg處理紅三葉葉片MDA含量顯著降低(P<0.05),Gg+Bs處理紅三葉葉片MDA含量顯著降低(P<0.05)。Gg和Bs混合接種處理對(duì)紅三葉葉片MDA含量有顯著協(xié)同效應(yīng)。
2.2.4不同接種處理對(duì)紅三葉草葉片POD活性的影響在石油污染土壤中,各接種處理后紅三葉葉片POD活性都呈升高的趨勢(shì)(表2),Bs、Gg、Gg+Bs處理后紅三葉葉片POD活性與對(duì)照組相比顯著升高(P<0.05),Gg+Bs處理最高。這說(shuō)明Gg、Bs對(duì)紅三葉植株葉片POD活性均有促進(jìn)作用。
2.2.5不同接種處理對(duì)紅三葉草葉片CAT活性的影響由表2可知,與對(duì)照組相比較,Bs、Gg、Gg+Bs處理能顯著提高石油污染土壤生長(zhǎng)的紅三葉植株葉片CAT活性(P<0.05),Gg+Bs處理最大。Bs與Gg之間有顯著的交互作用(P<005),表現(xiàn)為Gg+Bs處理協(xié)同提高石油污染土壤紅三葉植株葉片的CAT活性。
2.3不同接種處理對(duì)石油污染土壤的脫氫酶活性和總石油烴含量的影響
不同接種處理的紅三葉根際和非根際土中脫氫酶和總石油烴含量的變化如圖1所示。相同處理的紅三葉根際和非根際土之間的脫氫酶活性存在差異,呈現(xiàn)出紅三葉非根際土脫氫酶活性普遍低于根際土脫氫酶的趨勢(shì)。各接種處理紅三葉根際和非根際土壤的脫氫酶活性均顯著高于對(duì)照組(P<005),Bs+Gg處理的土壤脫氫酶活性最高,表現(xiàn)出顯著的協(xié)同作用(P<0.05)。
不同接種處理對(duì)石油污染土壤總石油烴降解率如圖2所示。對(duì)照組土壤中總石油烴的平均降解率為5.55%,接種處理的土壤中總石油烴含量顯著降低(P<0.05),各接種處理中紅三葉根際土的總石油烴降解率均高于其非根際土總石油烴降解率。Gg+Bs處理土壤總石油烴平均降解率達(dá)到2339%,接種Gg+Bs處理對(duì)土壤總石油烴的降解效果顯著強(qiáng)于Gg、Bs處理(P<0.05), 表明混合接種Bs和Gg對(duì)紅三葉降解石油污染土壤總石油烴具有協(xié)同增效作用。
3討論
一般認(rèn)為,植物體內(nèi)通過(guò)一些滲透物質(zhì)(如可溶性糖、脯氨酸等)的調(diào)節(jié)來(lái)防御逆境脅迫引起的不利影響[16]。在石油污染土壤中生長(zhǎng)的植株,植物的呼吸和蒸騰作用受到影響,破壞了細(xì)胞膜結(jié)構(gòu),造成細(xì)胞內(nèi)電解質(zhì)的外滲,因而對(duì)植物產(chǎn)生一定的毒害作用,嚴(yán)重抑制植物的生長(zhǎng)[17-19]。以往的研究表明通過(guò)接種PGPR和AMF可以增強(qiáng)逆境脅迫下植物的生長(zhǎng)能力和抗逆性。本研究表明接種根際促生細(xì)菌Bacillus subtilis和菌根真菌地球囊霉Glomus geosporum能顯著提高石油污染土壤中紅三葉植株中可溶性糖、脯氨酸含量和生物量,對(duì)由于石油污染引起的紅三葉的滲透脅迫起到保護(hù)作用,提高紅三葉對(duì)石油污染脅迫的耐受性。丙二醛是活性氧啟動(dòng)膜脂過(guò)氧化的主要產(chǎn)物,其含量的高低和細(xì)胞質(zhì)膜的透性變化是反映膜脂過(guò)氧化作用強(qiáng)弱和質(zhì)膜破壞程度的重要指標(biāo)[20]。在逆境脅迫下,植株的生長(zhǎng)發(fā)育受到抑制,丙二醛含量會(huì)嚴(yán)重降低。在本試驗(yàn)中,我們發(fā)現(xiàn)接種促生細(xì)菌Bacillus subtilis和菌根真菌Glomus geosporum可以降低紅三葉植株丙二醛含量的積累,表明促生細(xì)菌Bacillus subtilis和Glomus geosporum協(xié)同作用可以有效提高紅三葉對(duì)石油污染脅迫的耐受性。接種PGPR和接種GM處理的紅三葉葉片POD、CAT活性顯著升高,增強(qiáng)了紅三葉對(duì)活性氧的清除能力,降低膜脂過(guò)氧化程度,這為提高紅三葉修復(fù)石油污染提供了一道生理屏障。
AM菌與根際促生菌假單胞菌屬(Pseudomonas)和枯草芽孢桿菌屬(Bacillus)等細(xì)菌[21]有相互促進(jìn)作用,可以改善植物根際微生物和土壤酶活性,增強(qiáng)污染物的降解能力。Kohler等認(rèn)為接種PGPR、AM真菌和溶磷菌處理的萵苣(Lactuca sativa)根際土壤酶活性顯著高于非接種處理[22-23]。本試驗(yàn)認(rèn)為,接種處理可以顯著提高土壤脫氫酶的活性,表明不同接種處理的紅三葉對(duì)石油污染土壤中總石油烴的降解能力存在差異。真菌、細(xì)菌可以協(xié)同作用對(duì)石油污染土壤進(jìn)行修復(fù),其生長(zhǎng)及對(duì)石油烴的降解不受土著微生物的抑制。單獨(dú)接種地球囊霉、摩西球囊霉以及混接AM真菌、細(xì)菌能顯著提高柴油的降解率[24]。本試驗(yàn)研究表明單獨(dú)和混合接種Bacillus subtilis和Glomus geosporum都能顯著促進(jìn)石油污染土壤中總石油烴降解能力,由此可見(jiàn),接種Bacillus subtilis和菌根真菌Glomus geosporum是提高紅三葉修復(fù)石油污染土壤的有效技術(shù)手段。
4結(jié)論
接種Bacillus subtilis和Glomus geosporum處理均能顯著提高紅三葉地上和地下干生物量、可溶性糖含量和脯氨酸含量(P<0.05),葉片CAT、POD活性顯著升高(P<0.05),丙二醛含量明顯減少(P<0.05)。在各接種處理中,紅三葉根際與非根際土壤脫氫酶活性和土壤中總石油烴降解率均顯著升高(P<0.05)。接種Bs+Gg處理修復(fù)效果要優(yōu)于單獨(dú)接種Bs或Gg,Bs和Gg在紅三葉修復(fù)石油污染土壤和植物抗石油脅迫的能力方面有協(xié)同作用。
參考文獻(xiàn):
[1]耿春女,李培軍,陳素華,等. 不同AM真菌對(duì)三葉草耐油性的影響[J]. 應(yīng)用與環(huán)境生物學(xué)報(bào),2002,8(6):648-652.
[2]Arshad M,Shaharoona B,Mahmood T. Inoculation with plant growth promoting rhizobacteria containing ACC-deaminase partially eliminates the effects of water stress on growth,yield and ripening of Pisum sativum L.[J]. Pedosphere,2008,18(5):611-620
[3]趙碩偉,沈嘉澍,沈標(biāo).復(fù)合菌群的構(gòu)建及其對(duì)石油污染土壤修復(fù)的研究[J]. 農(nóng)業(yè)環(huán)境科學(xué)學(xué)報(bào),2011,30(8):1567-1572.
[4]Huang X D,El-Alawi Y,Gurska J,et al. A multi-process phytoremediation system for decontamination of persistent total petroleum hydrocarbons (TPHs) from soils[J]. Microchemical Journal,2005,81:139-147.
[5]Hong S H,Ryu H W,Kim J,et al. Rhizoremediation of diesel-contaminated soil using the plant growth-promoting rhizobacterium Gordonia sp. S2RP-17[J]. Biodegradation,2011,22:593-601.
[6]龍偉文,王平,馮新梅,等. PGPR與AMF相互關(guān)系的研究進(jìn)展[J]. 應(yīng)用生態(tài)學(xué)報(bào),2000,11(2):311-314.
[7]秦芳玲,田中民. 同時(shí)接種解磷細(xì)菌與叢枝菌根真菌對(duì)低磷土壤紅三葉草養(yǎng)分利用的影響[J]. 西北農(nóng)林科技大學(xué)學(xué)報(bào):自然科學(xué)版,2009,37(6):151-157.
[8]張瑞芹,盧致霖,陳潔雯,等. AM真菌影響三葉草根系抗氧化酶活性的系統(tǒng)效應(yīng)[J]. 微生物學(xué)通報(bào),2011,38(3):322-327.
[9]張穎,高景慧.鎘脅迫對(duì)紅三葉種子萌發(fā)及幼苗生理特性的影響[J]. 西北農(nóng)業(yè)學(xué)報(bào),2007,16(3):57-59.
[10]何瑋,蔣安,王琳,等. PEG 干旱脅迫對(duì)紅三葉抗性生理生化指標(biāo)的影響研究[J]. 中國(guó)農(nóng)學(xué)通報(bào),2013,29(5):5-10.
[11]孔令慧,趙桂琴. 不同品種紅三葉苗期對(duì)4 ℃低溫脅迫的生理響應(yīng)[J]. 中國(guó)草地學(xué)報(bào),2013,35(3):31-37.
[12]吉云秀. 含ACC脫氨酶PGPR分離及提高植物抗逆性[D]. 大連:大連海事大學(xué),2008.
[13]Phillips J M,Hayman D S.Improved procedures for clearingand staining parasitic and vesicular-arbuscular mycorrhizalfungi for rapid assessment of infection[J]. Trans Br Mycol Soc,1970,55:158-161.
[14]李玲. 植物生理學(xué)實(shí)驗(yàn)指導(dǎo)[M]. 北京:科學(xué)出版社,2009:10-11.
[15]劉光崧. 土壤理化分析與剖面描述[M]. 北京:中國(guó)標(biāo)準(zhǔn)出版社,1996.
[16]簡(jiǎn)令成,王紅. 逆境植物細(xì)胞生物學(xué)[M]. 北京:科學(xué)出版社,2009.
[17]何潔,賀鑫.石油對(duì)翅堿蓬生長(zhǎng)及生理特性的影響[J]. 農(nóng)業(yè)環(huán)境科學(xué)學(xué)報(bào) 2011,30(4):650-655.
[18]岳冰冰,李鑫,任芳菲,等. 石油污染對(duì)紫花苜蓿部分生理指標(biāo)的影響[J]. 草業(yè)科學(xué),2011,28(2):236-240.
[19]李小利,劉國(guó)彬. 土壤石油污染對(duì)植物苗期生長(zhǎng)和土壤呼吸的影響[J]. 水土保持學(xué)報(bào),2007,21(3):95-98.
[20]張金林,李惠茹,郭姝媛,等. 高等植物適應(yīng)鹽逆境研究進(jìn)展[J]. 草業(yè)學(xué)報(bào),2015,24(12):220-236.
[21]Linderman R G. Role of VAM fungi in biocontrol[M]//Pfleger F L,Linderman R G. Mycorrhizae and plant health.St Paul,MN:APS Press,1994:1-26.
[22]Kohler J,Hernández J A,Caravaca F,et al. Induction of antioxidant enzymes is involved in the greater effectiveness of a PGPR versus AM fungi with respect to increasing the tolerance of lettuce to severe salt stress[J]. Environmental and Experimental Botany,2009,65:245-252.
[23]Kohler J,Caravaca F,Carrasco L,et al. Interactions between a plant growth-promoting rhizobacterium,an AM fungus and a phosphate-solubilising fungus in the rhizosphere of Lactuca sativa[J]. Applied Soil Ecology,2007,35:480-487.
[24]耿春女,李培軍,陳素華,等. 不同叢枝菌根真菌對(duì)萬(wàn)壽菊生長(zhǎng)及柴油降解率的影響[J]. 應(yīng)用生態(tài)學(xué)報(bào),2003,14(10):1775-1779.孫凱文,時(shí)佩佩,盛海君,等. 富營(yíng)養(yǎng)化水體中磷濃度對(duì)不同種類(lèi)浮萍生長(zhǎng)的影響[J]. 江蘇農(nóng)業(yè)科學(xué),2016,44(5):529-531.
- 江蘇農(nóng)業(yè)科學(xué)的其它文章
- 農(nóng)業(yè)科研系列職稱(chēng)評(píng)審組織流程網(wǎng)絡(luò)化平臺(tái)建設(shè)
- 基于三方動(dòng)態(tài)博弈的食品安全社會(huì)共治研究
- 重慶山區(qū)農(nóng)戶(hù)轉(zhuǎn)入耕地補(bǔ)償現(xiàn)狀及影響因素
- 新型農(nóng)業(yè)企業(yè)經(jīng)營(yíng)者勝任力模型構(gòu)建及構(gòu)成要素
- 江蘇省農(nóng)業(yè)科學(xué)院科技產(chǎn)業(yè)發(fā)展的實(shí)踐與思考
- 黑龍江省農(nóng)村電子商務(wù)發(fā)展水平測(cè)度實(shí)證分析

