幾種不同方法學檢測胃蛋白酶原I,II臨床應用探討
閆敏,閆華林,李明
(1.解放軍第一O五醫院檢驗科,安徽 合肥 230031;2.安慶市第一人民醫院檢驗科,安徽 安慶 246004)
?
幾種不同方法學檢測胃蛋白酶原I,II臨床應用探討
閆敏1,閆華林2,李明2
(1.解放軍第一O五醫院檢驗科,安徽 合肥230031;2.安慶市第一人民醫院檢驗科,安徽 安慶246004)
摘要:目的使用化學發光法(CLIA),流式熒光發光法(FFIA),酶聯免疫法(ELISA)三種不同的方法檢測血清胃蛋白酶原I(PGI)、胃蛋白酶原II(PGII),探討三種檢測方法用于胃癌輔助診斷的臨床價值。方法通過方法學比對與相關分析,比較三種方法的一致性與相關性。通過檢測確診為胃癌患者的臨床血清樣本,利用ROC曲線確定PGI與PGI/PGII(PGR)臨界值,評價三種方法的靈敏度與特異度。結果三種方法測試不同組別血清樣本中PGI、PGII,根據PGI、PGII結果計算PGR。發現胃癌組與非胃癌組間PGI、PGR兩個指標差異有統計學意義,PGII差異無統計學意義。方法學比對發現,不同方法學之間PGI、PGII相關性良好,相關系數r為:0.9612~0.9789,不同方法學之間PGR相關系數為:0.8602~0.9109。對三種方法進行ROC曲線分析,確定ROC曲線最佳臨界值后,分析PGI、PGR組合用于胃癌診斷,化學發光法、流式熒光發光法、酶聯免疫法靈敏度分別為67.6%,61.8%,58.8%,特異度分別為96.6%、94.7%、96.6%。結論化學發光法,流式熒光發光,酶聯免疫法檢測PGI、PGII存在較好的相關性。通過臨床評估,PGI結合PGR可以有效提高胃癌的診斷特異度與陽性預測值,具有較好的臨床價值。
關鍵詞:胃蛋白酶原A;胃蛋白酶原C;發光測定法;流式細胞術;聚合酶鏈反應
胃癌在全國居惡性腫瘤發病第2位,發病率為36.21/106[1],是我國最常見惡性腫瘤之一。早期胃癌術后生存率可以達到80%以上,但目前缺乏簡便的早期篩查的方法,近年來利用腫瘤標志物用于胃癌輔助診斷或早期篩查研究較多,其中利用胃蛋白酶原(Pepsinogen,PG)用于胃癌輔助診斷有較為明顯的優勢[2~4],PG為由375個氨基酸組成的胃蛋白酶的無活性前體,相對分子量為42kD,Samloff根據其生化性質和免疫原性將其分成PGI與PGII2個亞群,PGI主要由胃黏膜細胞及頸黏液細胞分泌;PGII主要由全胃腺體及十二指腸Brunner腺分泌[5]。檢測胃蛋白酶原I、II常用方法有:酶聯免疫吸附法(ELISA)、化學發光法(CLIA)、流式熒光發光法(FFIA)、時間分辨熒光免疫分析法(TRFIA)、光激化學發光免疫分析法(LICA)以及乳膠增強免疫比濁法等[6-9]。本次研究利用化學發光法、酶聯免疫吸附法、流式熒光發光法三種不同方法檢測血清PGI、PGII,評價了三種方法的一致性與相關性,并通過臨床樣本評價了三種不同方法各自靈敏度與特異度。
1 材料和方法
1.1主要試劑及儀器胃蛋白酶原Ⅰ∕胃蛋白酶原Ⅱ聯合定量測定試劑盒(流式熒光發光法)由上海透景公司提供,配套使用儀器為Luminex多功能流式點陣儀(Luminex公司,型號Luminex200);胃蛋白酶原I和胃蛋白酶原II檢測試劑盒(酶聯免疫法)由芬蘭Biohit公司提供,配套使用儀器為酶標儀(鄭州安圖,型號:PHOMO);胃蛋白酶原I和胃蛋白酶原II測定試劑盒(化學發光微粒子免疫檢測法)由Abbott公司提供,配套儀器為Abbott全自動免疫分析儀(Abbott公司,型號:ARCHITECTi2000SR)。
1.2標本來源2015年1月至2015年7月期間,安慶市第一人民醫院消化內科共收集臨床血清樣本241例。其中通過胃鏡及病理組織確診為胃癌的樣本為34例(平均年齡55歲,男性17例,女性17例),該組作為胃癌組;胃部良性疾病38例(含慢性胃炎32例、胃潰瘍組5例、胃部良性息肉1例;平均年齡58歲,男性26例,女性12例),該組作為胃部良性疾病組;另外再取經體檢無胃部疾病的健康體檢樣本169例(平均年齡40歲,男性73例,女性96例),作為健康對照組。在分析PGI、PGII用于胃癌輔助診斷時,胃部良性疾病組與健康對照組合并成非胃癌組。
1.3方法采集受試者空腹靜脈血5mL,離心分離血清后置-20℃保存待測。檢測過程中嚴格按照三個不同方法學試劑說明書及儀器說明書要求進行操作,在測試過程均進行質控,上海透景試劑采用上海透景提供的質控品,芬蘭Biohit試劑使用試劑盒內配套質控品,Abbott試劑盒Abbott公司提供的PGI,PGII質控品,要求質控品測值均應在其提供的參考范圍內。
1.4統計學方法用MicrosoftExcel2010與IBMSPSS22進行圖形處理與數據統計分析。使用對于正態分布計量數據兩組間比較用獨立樣本t檢驗;多組間比較用方差分析;兩兩比較采用SNK-q檢驗方法。對偏態分布計量數據,兩組間比較用Mann-WhitneyU檢驗;多組間比較采用Kruskal-WallisH檢驗。通過方法學比對比較三種方法測值的一致性,對不同方法學間進行相關分析。使用SPSS分析PGI、PGII以及PGR對胃癌診斷的ROC曲線,分析ROC曲線面積,并通過ROC曲線確定各個指標最佳臨界值,通過確定的臨界值分析三種方法各自靈敏度,特異度,陽性預測值以及陰性預測值。所有檢驗均以P<0.05為差異有統計學意義。
2 結果
2.1三種方法檢測不同組別樣本結果分析經三種不同方法對PGI、PGII以及PGR檢測結果統計見表1。
2.2三種方法學檢測結果分析對三種方法測試得到的PGI、PGII及PGR結果進行兩兩方法學比對,繪制散點圖,并擬合兩方法學之間的直線方程(圖1),分析方法學間相關性(表1)。
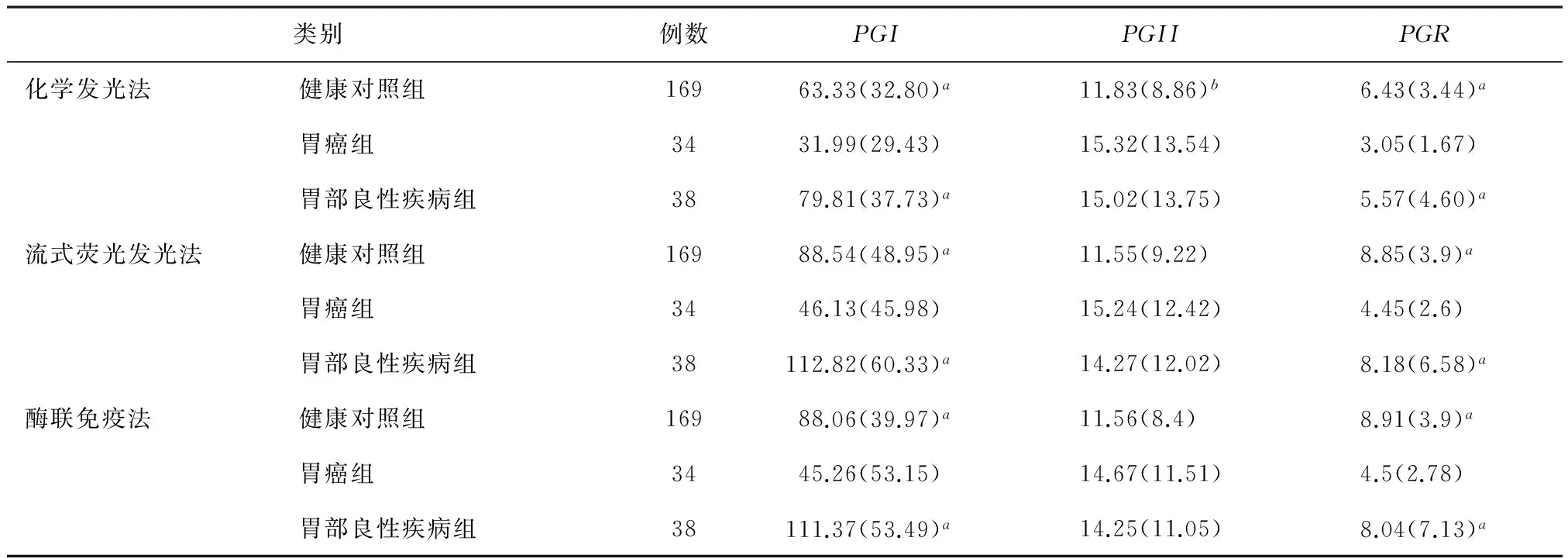
表1 三種不同方法檢測結果統計分析
注:同方法學內與胃癌對照組比較,aP<0.05,同方法學內與胃部良性疾病組比較,bP<0.05。
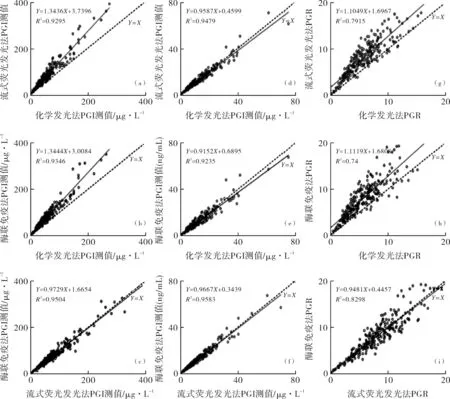
注:圖(a),化學發光法與流式熒光發光法PGI方法學比對散點圖;圖(b),化學發光法與酶聯免疫法PGI方法學比對散點圖;圖(c),流式熒光發光法與酶聯免疫法PGI方法學比對散點圖;圖(d),化學發光法與流式熒光發光法PGII方法學比對散點圖;圖(e),化學發光法與酶聯免疫法PGII方法學比對散點圖;圖(f),流式熒光發光法與酶聯免疫法PGII方法學比對散點圖;圖(g),化學發光法與流式熒光發光法PGR方法學比對散點圖;圖(h),化學發光法與酶聯免疫法PGR方法學比對散點圖;圖(i),流式熒光發光法與酶聯免疫法PGR方法學比對散點圖。
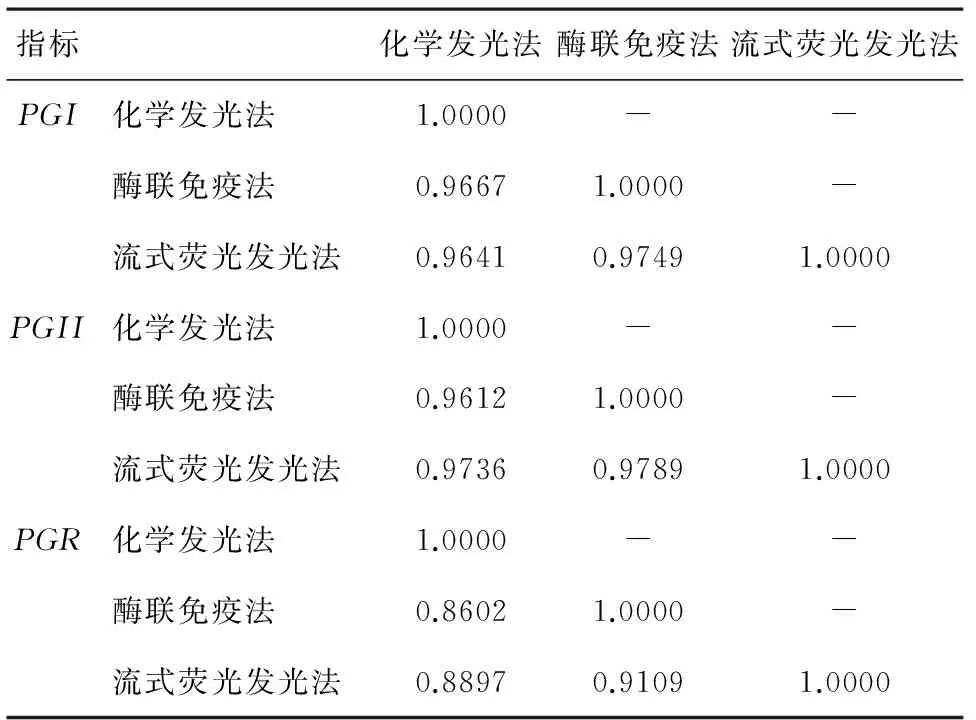
圖1 三種不同方法學檢測PG,PGI、PGII、PGR三個指標不同方法學比較 表2 不同方法學間相關系數r統計
2.3ROC曲線分析及最佳臨界值確定以胃癌組作為陽性組,胃部良性疾病組與健康對照組作為陰性組。因PGII指標在三個組別間測值差異無統計學意義,僅繪制PGI、PGR在三個方法學中各自的ROC曲線,見圖2,并計算出各曲線下面積見表3。選擇ROC曲線上靠近左上方即約登指數最大的切點為最佳臨界值,分別計算出各個指標在不同方法學下最佳臨界值,見表3。

圖2 PGI、PGR在各自方法學中ROC曲線表3 不同方法學下不同指標ROC曲線
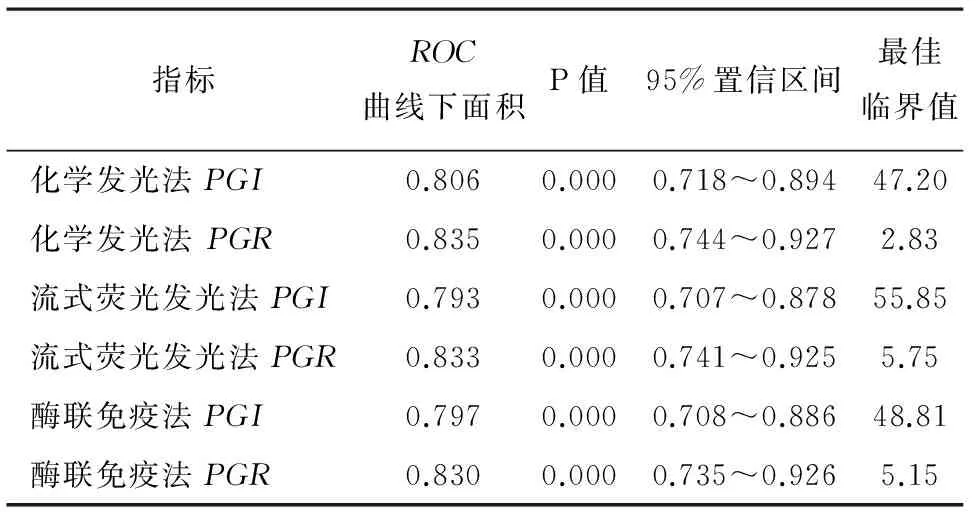
指標ROC曲線下面積P值95%置信區間最佳臨界值化學發光法PGI0.8060.0000.718~0.89447.20化學發光法PGR0.8350.0000.744~0.9272.83流式熒光發光法PGI0.7930.0000.707~0.87855.85流式熒光發光法PGR0.8330.0000.741~0.9255.75酶聯免疫法PGI0.7970.0000.708~0.88648.81酶聯免疫法PGR0.8300.0000.735~0.9265.15
2.4不同方法學PG靈敏度與特異度分析通過ROC曲線確定最佳臨床診斷值,其中先分析PGI單指標靈敏度與特異度數據,見表4。再利用PGI與PGR指標串聯方式進行檢驗結果判斷(即PGI、PGR同時為陽性才判斷檢驗結果為陽性,否則為陰性)。對241例樣本結果進行分析統計,計算各個方法學對胃癌的診斷靈敏度與特異度,并計算各自陽性預測值與陰性預測值,見表5。
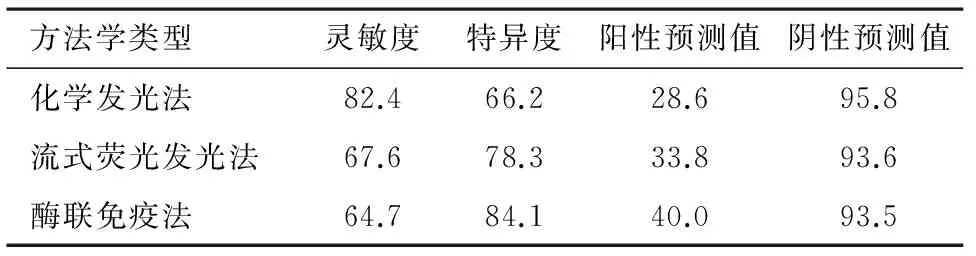
表4 三種不同方法檢測PG各自診斷靈敏度與特異度(使用PGI單指標)/%

表5 三種不同方法檢測PG各自診斷靈敏度與特異度(使用PGI、PGR組合指標)/%
3 討論
血清中胃蛋白酶原PG水平可以反映胃黏膜功能和組織學狀況,PG作為胃癌的腫瘤標志物現已經獲得廣泛研究與臨床應用。相對單獨進行PGI檢測,PGI結合PGR,可以有效提高診斷特異度[9]。
目前有相當多的檢測PG的方法,不同的方法有可能導致樣本測試結果產生較大差異[7]。本次研究采用了3種方法來檢測同一批臨床血清樣本中PGI、PGII,分析三種不同方法學之間的一致性與相關性,其中流式熒光發光法是較為創新的方法,可以一次測試實現PGI、PGII兩個指標的同步測試。對三種不同方法檢測PGI、PGII進行兩兩方法學比對,相關系數r為0.961 2~0.978 9,提示三種不同方法學之間存在良好的相關性,PGR兩兩相關系數r為0.860 2~0.910 9。從圖形及數據來看,PGR方法學之間相關性明顯不及PGI、PGII。主要原因可能為不同方法學因采用抗體的差異以及方法學本身差異,導致同一樣本PGI、PGII結果存在差異,PGR結果取決于PGI、PGII結果,PGI、PGII結果差異疊加,會導致PGR離散程度增加,從而導致相關系數r下降。另外通過方法學比對,本研究觀察到化學發光法測試PGI與其它兩種方法存在明顯的差異,PGI酶聯免疫法與化學發光法,流式熒光發光法與化學發光法擬合直線方程分別為Y=1.344 4X+3.008 4,Y=1.343 6X+3.739 6。直線方程斜率提示,兩種方法學之間存在較大的系統差異。而流式熒光發光法與酶聯免疫法擬合直線方程為Y=0.972 9X+1.665,斜率為0.972 9,在0.9~1.1之間,提示兩種方法學之間測值系統差異小。相對于PGI,PGII在三種不同方法學之間系統差異明顯要小,PGII酶聯免疫法與化學發光直線擬合方程為Y= 0.915 2X+0.689 5,流式熒光發光法與化學發光直線擬合方程為Y=0.938 7X+0.459 9,酶聯免疫法與流式熒光發光法擬合直線方程為Y=0.966 7X+0.343 9,PGII方法學兩兩擬合直線,斜率均在0.9~1.1之間。PGI之所以在不同方法學之間存在較大測值差異,推測主要原因是由于PGI、PGII目前無參考測量程序以及無約定的參考測量物質,導致無法將結果通過合適的溯源途徑在計量學上至統一的國際單位。該現象的存在,將導致PGI在采用不同檢測方法的檢測實驗室無法實現檢驗結果互認。
通過三種不同方法檢測PGI、PGII并獲得PGR數據,三種方法的檢驗結果均表明在胃部良性疾病組、健康對照組兩個組別中PGI與PGR兩項指標與胃癌組均差異無統計學意義(P<0.05),而PGII則在三個不同疾病組別中不存在組間差異(P>0.05)。這個結果表明PGII指標在胃癌輔助診斷中臨床診斷價值不高。
考慮到不同方法學之間PGI存在系統差異,使用ROC曲線建立各自方法學PGI、PGR的最佳臨界值。化學發光法中確定PGI臨界值為47.20,PGR為2.83,流式熒光發光法PGI臨界值為55.85,PGR為5.75,酶聯免疫法PGI臨界值為48.81,PGR為5.15。本方法確定的臨界值與文獻報道的臨界值存在較大差異[12],可能原因為:(1)入組樣本存在差異;(2)樣本量偏少;(3)入組人群與文獻中入組人群本身差異。通過確定的臨界值分析各個指標的靈敏度與特異度。結果表明單獨以PGI作為臨界值時,特異度明顯較PGI、PGR兩個指標要差。使用PGI、PGR在維持一定靈敏度的情況下能使特異度提高66.2%~84.1%提高至90%以上,同時提高了三種方法的陽性預測值。鑒于方法學間較高的相關性,三種方法學之間靈敏度與特異度上經卡方檢驗差異無統計學意義。
綜上所述,三種常見方法學檢測PGI、PGII存在較好的相關性,PGI在化學發光法中與另外兩種方法學之間存在系統測值差異。通過臨床評估,PGI結合PGR可以有效提高胃癌的診斷特異度與陽性預測值,具有較好的臨床價值。
參考文獻
[1]赫捷,陳萬青.2012中國腫瘤登記年報[M].北京:軍事醫學科學出版社,2012:188.
[2]吳冠楠,姚學權,劉福坤.血清胃蛋白酶原對早期胃癌檢測的研究進展[J].檢驗醫學與臨床,2015,12(14):2126-2128.
[3]YoonH,KimN.Diagnosisandmanagementofhighriskgroupforgastriccancer[J].GutandLiver,2015,9(1):5-17.
[4]PasechnikovV,ChukovS,FedorovE,etal.Gastriccancer:Prevention,screeningandearlydiagnosis[J].WorldJGastroenterol,2014,20(38):13842-13862.
[5]聶娜,騫佩,馮英明.胃癌相關血液標志物的研究進展[J].現代腫瘤醫學,2015,23(9):1298-1302.
[6]程桐花,朱貞祥.血清胃蛋白酶原和幽門螺桿菌IgG抗體檢測在胃癌及其癌前疾病篩查中的意義研究[J].安徽醫藥,2015,19(12):2354-2355.
[7]朱國民,邱峰.三種血清胃蛋白酶原檢測方法在胃癌篩查中的比較分析[J].檢驗醫學,2012 ,27 (11):961-962.
[8]李小華,謝瑋,曹興建,等.乳膠增強免疫比濁測定血清胃蛋白酶原及其在胃癌診斷中的應用[J].臨床檢驗雜志,2010,28 (5):338-339.
[9]KimN,JungHY.Theroleofserumpepsinogeninthedetectionofgastriccancer[J].GutandLiver,2010,4(3):307-319.
doi:10.3969/j.issn.1009-6469.2016.07.031
(收稿日期:2016-02-12,修回日期:2016-04-08)
Clinical application of three different methods to the detection of Pepsinogen I and Pepsinogen II
YAN Min1,YAN Hualin2,LI Ming2
(1.DepartmentofClinicalLaboratory,105HospitalofPLA,Hefei,Anhui230031,China;2.FirstPeople’sHospitalofAnqing,Anqing,Anhui246004,China)
Abstract:ObjectiveTo study the clinical value of gastric cancer auxiliary diagnosis of three kinds of detection methods,using the chemiluminescent immunoassay (CLIA) ,flow type fluorescent light emitting method (FFIA) and enzyme linked immunosorbent assay (ELISA) to detect Pepsinogen I (PGI),Pepsinogen II (PGII).MethodsWith the method of comparison and correlation analysis,the consistency and correlation of the three methods are compared.The clinical serum samples of patients diagnosed with gastric cancer were tested and the critical values of PGI and PGI/PGII (PGR) were determined by using ROC curve to evaluate the sensitivity and specificity of the three methods.ResultsThe results of PGI and PGII in serum samples were tested by three different methods.And PGR was calculated according to the results of PGI and PGII.It was found that there were significant differences in the two indexes of PGI and PGR between gastric cancer group and non gastric cancer group,and there was no significant difference in PGII between the two groups.The comparative study found that the correlation coefficient between PGII and PGI was good,and the correlation coefficient r was in the range of 0.9612~0.9789,and the correlation coefficients of PGR among different methodology was in the range of 0.8602~0.9109.The sensitivities and specificities of CLIA,FFIA,ELISA were 67.6%,61.8%,58.8%,and 96.6%,94.7% and 96.6%,respectively.ConclusionsThere is good correlation among CLIA,FFIA,and ELISA detection of PGI,and PGII.Clinical evaluation indicates that PGI combined with PGR can effectively improve the diagnostic specificity and positive predictive value of gastric cancer,which has a good clinical value.
Key words:Pepsinogen A;Pepsinogen C;Luminescent Measurements;Flow Cytometry;Polymerase Chain Reaction

