菲立磁標記兔骨髓基質細胞自體移植坐骨神經的研究
何驍,鄧莉莉,鄒康(.郴州市第一人民醫院中心醫院骨科一區,湖南43000;.郴州市第一人民醫院北院/兒童醫院兒科,湖南43000)
菲立磁標記兔骨髓基質細胞自體移植坐骨神經的研究
何驍1,鄧莉莉2,鄒康1
(1.郴州市第一人民醫院中心醫院骨科一區,湖南423000;2.郴州市第一人民醫院北院/兒童醫院兒科,湖南423000)
目的在合適示蹤劑幫助下,采用無創傷性影像學技術來在體識別、跟蹤移植后骨髓基質細胞(BMSCs)的存活狀態及與宿主神經組織整合情況,了解BMSCs移植周圍神經后細胞如何遷移、如何凋亡和如何被吸收。方法BMSCs原代分離培養、誘導,菲立磁標記、鑒定及傳代后注入坐骨神經損傷的兔模型中,并于細胞移植后第1、2、4、8、16周分別行磁共振成像(MRI)、透射電鏡及免疫組織化學等。結果將菲立磁標記的干細胞移植后,采用MRI技術對兔坐骨神經進行掃描發現,以T1加權像(T1WI)和T2加權像(T2WI)序列檢查可見移植菲立磁-多聚賴氨酸(FE-PLL)標記干細胞的坐骨神經區有明顯低信號改變,T2WI掃描序列信號較T1WI明顯。結論兔BMSCs源神經干細胞移植后,可在坐骨神經內存活、遷移、分化,T2WI序列成像可清晰顯示菲立磁標記的BMSCs所致的低密度影像改變。利用MRI可以對移植后的標記細胞進行初步活體追蹤。
移植,自體;坐骨神經;磁共振成像;菲立磁;骨髓基質細胞
【Abstract】Objective To adopt the non-invasive imaging technology in the help of suitable tracermaterial to in vivo recognize and track the survivalstatus of post-trans plantbone marrow stromal cells(BMSCs)and integration condition of hostnervous tissue,to understand themigration,apoptosis and absorption of cells after bonemarrow stromal cells autotransplant into peripheral nerve.M ethods BMSCs were primarily isolated,cultured,induced,Feridex labeled,identified and injected into the rabbitmodelof sciatic nerve injury after passage.Then MRI,transmission electron microscope and immunohis tochemicalex aminations were performed at1,2,4,8 and 16 weeks after cell transplantation.Results After Feridex labeled stem cell trans plantation,MRI scanning on rabbitsciatic nerve found that the obvious low signal change in the sciatic nerve area of FE-PLL labeled stem cells could be seen by the T1W1 and T2W1 sequence examinations,moreover the sequence signal of T2W1 scanningwas more significant than T1W1.Conclusion Theneuralstem celloriginated from rabbit BMSCs can survive,migrateand different iate after trans plantation.The T2W1 sequence imaging can clearly display the changeof low density imaging caused by Feridex labeled BMSCs.Using MRI can conduct thepreliminary in vivo trackingon labeled cellsafter transplantation.
【Keywords】Transplantation,autologous;Sciatic nerve;Magnetic resonance imaging;Feridex;Stromal cell
近年來干細胞療法已成為治療多種疾病的新策略,其目的是替代、修復及加強受損組織或器官的生物學功能。隨著干細胞研究的深入,有關骨髓基質細胞(bonemarrow stormal cells,BMSCs)移植修復神經系統損傷的研究也越來越多。本研究擬在合適示蹤劑幫助下,采用無創傷性影像學技術來在體識別、跟蹤移植后BMSCs的存活狀態及與宿主神經組織整合情況,從而了解BMSCs移植周圍神經后細胞如何遷移、凋亡、被吸收及被誰吞噬。最終為其進一步行體內自體移植治療的實驗應用奠定基礎。
1 材料與方法
1.1材料
1.1.1動物選取2~3月齡,體質量為1.5~2.0 kg的新西蘭兔(由南華大學動物中心提供)。
1.1.2試劑與儀器菲立磁(PE)試劑盒(Advanced Magnetic公司);堿性成纖維細胞生長因子(b-FGF,R&D公司);白血病抑制因子(LIF)、細胞表皮因子(EGF)、PKH67染料試劑盒、3,3-二氨基苯聯胺試劑盒(DAB)、淋巴細胞分離液;FITC標記山羊抗小鼠IgG、生物素標記山羊抗小鼠IgG試劑盒(Sigma公司);兔神經巢蛋白(Nestin)抗體、鼠抗單克隆神經元特異性烯醇化酶(NSE)抗體(Santa Cruz公司);神經干細胞培養基(南方醫科大學實驗室配制,專利號:02134314.4)。
1.1.3主要儀器外科手術器械:手術剪、彎剪、鑷子、血管鉗、顯微器械1套、縫針、無菌注射器等醫用超導磁共振儀(荷蘭PHILIP電器公司)。
1.2方法
1.2.1兔骨髓采集、BMSCs的分離、擴增及分化鑒定將兔用水合氯醛靜脈注射麻醉后,無菌條件下于兔股骨處抽取骨髓約4mL。所獲骨髓用Hank′s液稀釋,細胞懸液與淋巴細胞分離液按1∶2比例混合,2 500 r/min密度梯度離心15min。吸取富含核細胞的界面層,加入1~2mL雙蒸水吹打,加入干細胞培養基,800 r/min離心約5min,小心去除上清液后加相同體積培養基,并加1%胎牛血清及LIF(10 ng/mL)及bFGF(10 ng/mL),接種于培養板和培養瓶中,培養5 d,見圖1、2。培養細胞均經4%多聚甲醛固定,磷酸緩沖液(PBS)沖洗,一抗4℃孵育過夜,室溫孵育顯色劑染色呈棕色的細胞為陽性。以抗原表達鑒定神經干細胞、分化形成的神經元、分化形成的膠質細胞,見圖3、4。

圖1 相差顯微鏡下培養8 h的BMSCs細胞形態(200×)

圖2 第3代BMSCs細胞形態(200×)

圖3 相差顯微鏡下神經元樣多突起細胞形態(400×)

圖4 相差顯微鏡下類神經元細胞NSE免疫組織化學檢測結果(400×)
1.2.2PE體外標記BMSCs將FE(50μg/mL)和多聚賴氨酸(PLL,1.5μg/mL)混合,振蕩30min,將FE-PLL混合物1∶1加入體外擴增培養誘導后觀察存活良好的細胞培養基中。在37℃下培養10 d左右,室溫下用0.25%胰蛋白酶消化,用含血清培養基終止反應并懸浮細胞,1 000 r/min離心5min,去除上清液,用神經干細胞培養液調整細胞密度為1.0×106μL-1,置40℃備用,見圖5。
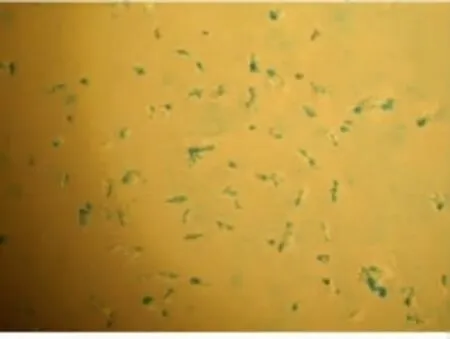
圖5 相差顯微鏡下FE標記BMSCs普魯士藍染色(200×)
1.2.3兔坐骨神經損傷模型的建立將兔稱質量、麻醉,碘酒、乙醇消毒后,鋪一次性手術巾。隨機選擇移植側及對照側,行髖關節后入路,依次切開皮膚、皮下,分離臀部肌肉顯露并保護坐骨神經,顯露坐骨神經分支處,并在其上方約8mm處向上切開坐骨神經外膜,銳性切除約8mm長神經。將肌膜縫合包裹神經外膜以加強對移植干細胞的包裹力。移植的神經干細胞用微量注射器在5min內注入兔坐骨神經缺損區內,對照側注射DMEM培養液。最后再用明膠海綿包裹,在皮膚外標記實驗組移植側。術后清潔籠具,給予青霉素以預防感染,并觀察動物的生命體征。
1.2.4磁共振成像(MRI)檢查于細胞移植后第1、2、4、8、16周分別行MRI檢查。檢查時,動物麻醉后俯臥位固定于有機玻璃板上,采用荷蘭PHILIP電器公司醫用超導磁共振儀常規定位后進行T1加權像(T1WI)和T2加權像(T2WI)序列檢查。
2 結果
移植前臺盼蘭染色顯示活細胞數在96%左右。T2WI掃描序列信號較T1WI明顯,細胞移植1周時低信號改變區比較局限,見圖6a。但經包裹的骨髓源性神經干細胞稍有外滲,移植4、8周后低信號改變增大,見圖6b。移植16周后MRI檢查未能發現明顯低信號改變。
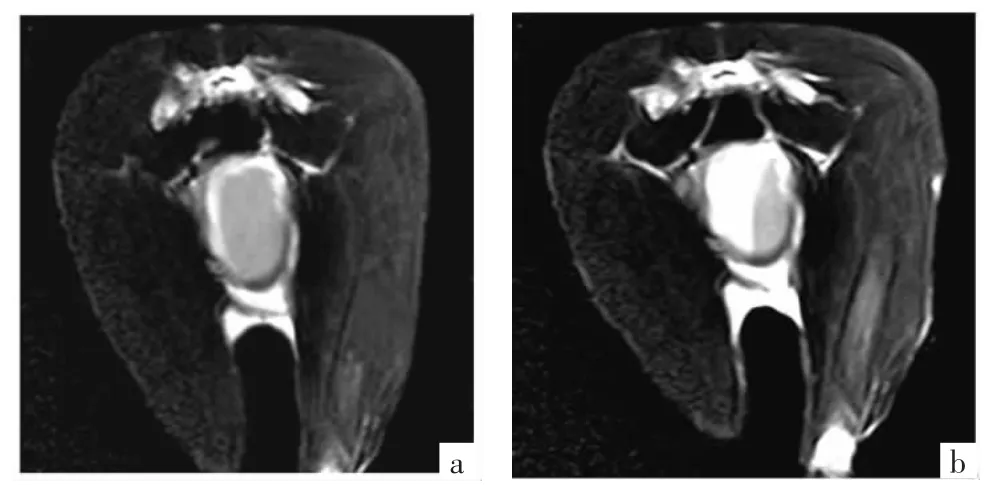
圖6 細胞移植1、8周后MRI檢查結果
3 討論
周圍神經損傷殘疾率高、治療困難,是常見的臨床問題[1],給社會及家庭帶來沉重的負擔。而作為一種新的治療神經系統損傷方法——體外分離培養獲得的BMSCs移植正成為神經科學研究的熱點[2-3]。
由于BMSCs具有來源廣泛、強大的再生及分化潛能、體內移植反應弱、移植后可以在體內分化出神經元和神經膠質細胞,補充因各種原因導致的神經元和神經膠質細胞的丟失[4]等優點,因此,BMSCs移植治療一直是人們探索的目標。
經研究發現周圍神經與BMSCs有很大關系[5]。2007 年1月,Hu等[6]在恒河猴尺神經缺損處移植BMSCs,結果證實BMSCs移植與自體神經移植術后神經恢復效果相當,為BMSCs用來修復靈長類動物周圍神經提供了有力的證據。2013年7月,Zhang等[7]將體外培養的BMSCs移植入大鼠坐骨神經15mm缺損模型,12周后電生理檢測結果表明,再生神經的傳導速度明顯改善,改善了大鼠的行走行為,減輕了腓腸肌質量和復合肌肉動作電位(CMAP)波幅的降低,并發現大量的再生軸突。2015年,Zhu等[8]取成年大鼠的BMSCs進行體外培養、擴增并標記后移植入馬尾神經損傷的大鼠中,術后12周顯示,大鼠馬尾神經得到修復并恢復一定功能。
FE是用于靜脈給藥的MRIT2加權造影劑,其外周為葡萄糖包裹,理化性質穩定[9]。注入人體后,其顆粒主要被正常肝臟組織內的網狀內皮系統(庫普弗細胞)所吞噬,造成肝臟組織的T2值明顯縮短,使富含庫普弗細胞的正常肝組織背景信號降低。有研究發現,利用轉染試劑可以轉運FE至細胞內[10-12]。本實驗將超順磁性氧化鐵顆粒(SPIO)吞噬于BMSCs內并移植到兔坐骨神經缺損處,選擇SE-T2WI序列進行MRI掃描。結果發現移植入兔坐骨神經內的FE標記BMCSs在移植初可發生局限性遷移,移植段周圍可見低信號影。而后低信號影逐漸消失,被機體所吸收、代謝。由此證明FE標記的BMCSs與宿主坐骨神經及肌組織有很好的相容性,對周圍結構無明顯破壞。
本實驗利用MRI成功活體觀察了FE標記的干細胞在周圍神經內的定位與遷移情況。但是因MRI分辨率有限及掃描厚度過大等缺點,一些組織切片結果及微小影像變化尚不能完全敏感地反映出來。相信隨著MRI技術的進步,有望追蹤到移植細胞更細微的影像變化。
綜上所述,FE標記的兔骨髓基質源神經干細胞移植后,可在坐骨神經內存活、遷移、分化,利用MRI技術可以對移植后的標記細胞進行初步的活體追蹤。
[1]Torres RY,Miranda GE.Epidemiology of traumatic peripheral nerve injuries evaluated by electrodiagnostic studies in a tertiary care hospital clinic[J].BolAsoc Med PR,2015,107(3):79-84.
[2]Schafer KH,MicciMA,Pasricha PJ.Neural stem cell transplantation in the enteric nervous system:roadmaps and roadblocks[J].NeurogastroenterolMotil,2009,21(2):103-112.
[3]Osakada F,HiramiY,TakahashiM.Stem cell biology and cell transplantation therapy in the retina[J].Biotechnol Genet Eng Rev,2010,26:297-334.
[4]Freedman MS,Bar-Or A,Atkins HL,et al.The therapeutic potential of mesenchymal stem cell transplantation asa treatment formultiple sclerosis:consensus reportof the International MSCTStudy Group[J].Mult Scler,2010,16(4):503-510.
[5]Oliveira JT,Mostacada K,de Lima S,et al.Bonemarrow mesenchymal stem cell transplantation for improvingnerve regeneration[J].IntRev Neurobiol,2013,108:59-77.
[6]Hu J,Zhu QT,Liu X L,etal.Repairofextended peripheralnerve lesions in rhesusmonkeys using acellular allogenic nerve grafts implanted with autologousmesenchymal stem cells[J].Exp Neurol,2007,204(2):658-666.
[7]Zhang C,Lv G.Repair of sciatic nerve defects using tissue engineered nerves[J].NeuralRegen Res,2013,8(21):1985-1994.
[8]Zhu L,Liu T,Cai J,et al.Repair and regeneration of lumbosacral nerve defects in ratswith chitosan conduits containing bonemarrowmesenchymalstem cells[J].Injury,2015,46(11):2156-2163.
[9]Moraes L,Vasconcelos-dos-Santos A,Santana FC,et al.Neuroprotective effects andmagnetic resonance imaging ofmesenchymal stem cells labeled with SPION in a ratmodelofHuntington′s disease[J].Stem CellRes,2012,9(2):143-155.
[10]Zhang S,He H,LuW,etal.Tracking intrahepatically transplanted islets labeledwith Feridex-polyethyleneimine complexusinga clinical3.0-Tmagnetic resonance imagingscanner[J].Pancreas,2009,38(3):293-302.
[11]Skopalik J,Polakova K,Havrdova M,etal.Mesenchymal stromal cell labeling by new uncoated superparamagnetic maghemite nanoparticles in comparison with commercial Resovist—an initial in vitro study[J].Int J Nanomedicine,2014,9:5355-5372.
[12]Shim J,Kwak BK,Jung J,et al.Evaluation of engraftment of superparamagnetic iron oxide-labeled mesenchymal stem cells using three-dimensional reconstruction ofmagnetic resonance imaging in photothrombotic cerebral infarctionmodelsof rats[J].Korean JRadiol,2015,16(3):575-585.
讀者·作者·編者
本刊歡迎各類基金課題論文
為了更快的傳播、交流醫學科學技術領域的新成果、新技術,我們特別歡迎各類基金課題論文,基金課題論文包括國家自然科學基金、國家各部委及各省、市、自治區的各種基金課題所產生的論文。本刊將以優惠價格,優先安排發表,鼓勵基金課題作者踴躍投稿。基金項目需寫明基金名稱及編號,并附單位證明,否則無效。
本刊編輯部
Research on Feridex labeled bonemarrow stromal cellsautotransplant into rabbitsciatic nerve
He Xiao1,Deng Lili2,Zou Kang1
(1.First Department of Orthopedics,Central Hospital;2.Department of Pediatrics,North Branch Hospital,Chenzhou Municipal First People′s Hospital,Chenzhou,Hunan 423000,China)
10.3969/j.issn.1009-5519.2016.10.011
A
1009-5519(2016)10-1468-03
何驍(1982-),碩士研究生,主治醫師,主要從事關節、創傷相關疾病的研究工作。
(2016-01-11)

