過量表達枯草芽孢桿菌乙偶姻還原酶提高2,3-丁二醇產量
李秀鵬,楊套偉,徐美娟,張顯,饒志明(江南大學生物工程學院,江蘇無錫)
過量表達枯草芽孢桿菌乙偶姻還原酶提高2,3-丁二醇產量
李秀鵬1,楊套偉2,徐美娟3,張顯4,饒志明*
(江南大學生物工程學院,江蘇無錫214122)
枯草芽孢桿菌Bacillus subtilis 168是一株安全生產的菌株,但是在2,3-丁二醇(2,3-BD)的發酵過程中,會積累較多的副產物乙偶姻(AC)。乙偶姻還原酶是催化AC合成2,3-BD的關鍵酶。為了提高2,3-BD合成效率,首先將乙偶姻還原酶基因acr克隆到B.subtilis 168,構建了重組菌B.subtilis 168/pMA5-acr。對重組菌進行搖瓶發酵實驗,結果表明,相比出發菌,重組菌的2,3-BD產量和轉化率分別提高28.62%和22.87%,主要副產物AC積累量下降了20.01%。同時,分支路徑的副產物甲酸、乙酸、乳酸、琥珀酸,也有不同程度的降低。
乙偶姻還原酶;2,3-丁二醇;乙偶姻;枯草芽孢桿菌
2,3-丁二醇(2,3-Butanediol,2,3-BD),化學式是CH3CHOHCHOHCH3,其結構存在3種立體異構體[1],分別為L-(+)-、D-(-)-和meso-構型。作為一種重要的化工原料和液體燃料,2,3-BD被廣泛應用于化工、能源、食品及航空航天等多個領域[2]。隨著經濟社會的蓬勃發展和石油等不可再生資源的日益枯竭,2,3-BD逐漸受到世界的關注。由于2,3-BD結構特殊[3],利用化石原料生產2,3-BD成本高、條件苛刻、過程繁瑣,容易對環境造成污染,并且化石原料日益枯竭,因此化學合成法工業化生產較為困難。微生物轉化法是利用可再生資源生產2,3-BD,既克服了化學法生產的原料問題,又符合綠色化工的要求,因此受到了人們越來越多的關注。通過代謝工程、合成生物學及其集成的方法改造微生物[4],同時,通過優化發酵條件與分離純化工藝來降低環境污染與生產成本,對我國低碳經濟和循環經濟的建設,具有重要的促進作用和潛在的經濟效益[5]。早在1906年,Harden和Walpole[6]就研究了利用肺炎克雷伯氏菌(Klebsiella pneμmoniae)發酵生產2,3-BD;1926年,Donker[7]提出了用多粘芽孢桿菌(Bacillus polymyxa)發酵生產2,3-BD;1933年,Fulmer等[8]提高了產酸克雷伯氏菌(Klebsiella oxytoca)生物合成2,3-BD的水平,并指出了其工業化生產的潛力。2,3-BD高產菌株主要是克雷伯氏菌、產氣腸桿菌和粘質沙雷氏菌[3,9-10]。然而,這些菌株都具有潛在致病性,不符合工業化安全生產的要求。
作者所在實驗室保藏的枯草芽孢桿菌Bacillus subtilis 168是一株安全生產2,3-BD的菌株,其代謝產生的2,3-BD主要以D-(-)-和meso-兩種構型存在[1]。枯草芽孢桿菌的2,3-BD合成途徑[1,11]如圖1所示,以糖類為底物經丙酮酸、α-乙酰乳酸、乙偶姻(Acctoin,AC)并最終轉化為2,3-BD,此步反應需要NADH的參與[5,9],同時伴隨著有機酸的合成[12]。乙偶姻還原酶(Acctoin,reductase,ACR)作為一種雙功能酶可催化AC和2,3-BD之間的相互轉化[12]:在弱酸性的條件下,該酶以催化AC向2,3-BD轉化為主,過程中消耗NADH;弱堿性時,該酶則主要催化2,3-BD向AC逆向轉化,該過程生成NADH[13-14]。因此,有機酸副產物如甲酸、乙酸、乳酸、琥珀酸的合成會與2,3-BD合成途徑競爭碳源;另外,乳酸和琥珀酸的合成還會消耗NADH[1,11],這可能會影響AC 向2,3-BD轉化的程度,從而造成AC的大量積累。

圖12 ,3-丁二醇代謝路徑Fig.1 Metabolic pathway of 2,3-BD.E;acetoin reductase
以B.subtilis 168作為出發菌,克隆乙偶姻還原酶基因acr,構建重組枯草芽孢桿菌B.subtilis 168/ pMA5-acr,并對其在弱酸性的條件下進行發酵試驗,研究過量表達ACR對發酵過程中2,3-BD積累的影響,希望能達到2,3-BD提高、AC和相關有機酸減少的目標,為工業化應用打下基礎。
1 材料與方法
1.1菌種與質粒
Bacillus subtilis 168由作者所在實驗室保藏,表達載體pMA5亦由作者所在實驗室保藏。
1.2主要試劑與培養基
工具酶,購自TaKaRa公司;質粒小量抽提試劑盒、膠回收試劑盒、抗生素、咪唑,購自上海Sangon公司;丙烯酰胺、甲叉雙丙烯酰胺,購自Ferments公司;NADH,NAD+,購自Sigma Aldrich公司;PCR引物,由上海Sangon公司合成;其他試劑均為國產試劑。
活化培養基(g/L):蛋白胨10,酵母粉5,氯化鈉10;自然pH值。
種子培養基(g/L):葡萄糖80,蛋白胨10,酵母粉5,氯化鈉10;自然pH值。
發酵培養基(g/L):葡萄糖140,酵母膏5,KH2PO46,K2HPO4·3H2O 14,尿素5,玉米漿20,檸檬酸鈉8;pH 6.5。
1.3主要試劑配制
A液(50 mmol/L磷酸氫二鈉溶液):7.08 g Na2HPO4,加去離子水定容至1 L。
B液(50 mmol/L磷酸二氫鈉溶液):5.99 g NaH2PO4,加去離子水定容至1 L。
磷酸鈉緩沖液(pH 6.5):將A液和B液按照31.5∶68.5的體積比混勻。
PBS緩沖液(pH 7.0):NaCl 8.0 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.626 g/L,用濃鹽酸調至pH 7.0。
1.4乙偶姻還原酶基因acr克隆及表達載體構建
根據NCBI中枯草芽孢桿菌全基因組核酸序列acr的基因序列設計一對引物,見表1,并在引物5′端分別加上BamH I和Mlu I酶切位點(下劃線)。

表1 文中所涉及的引物Table 1 Primers used in the study
提取B.subtilis 168的基因組作為模板,以Forawrd/Reverse引物進行PCR擴增,獲得目的基因片段acr。PCR總反應體系為50 μL,包含1 ng的質粒模板,200 μmol/L dNTP,20 μmol/L引物和1 μL 的ExTaq DNA聚合酶。程序設定為95℃預變性5 min;循環擴增程序為95℃變性50 s,56℃退火90 s,72℃延伸90 s(根據實際情況,時間設定為1 kb/min),35個循環;72℃延伸10 min。PCR反應產物用0.8 g/dL的瓊脂糖凝膠電泳分離,目的條帶經分離后,用膠回收試劑盒(Takara)回收,回收的基因片段與pMD18-T連接,轉化E.coli JM109,經過氨芐青霉素抗性平板篩選,挑取陽性轉化子。提取質粒酶切驗證,重組質粒命名為T-acr,DNA測序由上海生工生物工程有限公司完成。經測序驗證正確的重組質粒T-acr,用BamH I和Mlu I雙酶切后連接到經過相同酶切的pMA5上,構建表達載體pMA5-acr。
1.5ACR在枯草芽孢桿菌中的表達
將構建好的表達載體pMA5-acr轉化至B. subtilis 168中,在卡那霉素抗性平板上篩選陽性重組子并進行酶切驗證。將驗證正確的重組菌B. subtilis 168/pMA5-acr,接種至含有50 μg/mL卡那霉素的LB液體培養基37℃過夜培養,次日以體積分數1%的接種量轉接至50 mL LB液體培養基37℃培養24 h。發酵的菌液8 000 r/min離心10 min,用pH 7.0的PBS緩沖液洗滌細胞3次,然后離心后的細胞重懸浮于pH 7.0的PBS緩沖液中,用超聲波破碎儀破碎細胞,10 000 r/min離心30 min沉淀細胞碎片,上清液即為粗酶液,置于-4℃保存,后續用于蛋白質純化、SDS-PAGE實驗和ACR的酶活測定。
1.6酶的Ni-TNA純化
超聲破碎制得粗酶液后,經0.45 μm濾膜過濾,采用Ni-NTA蛋白純化柱來純化目的蛋白質,經過兩次上樣,蛋白質末端的6個His與Ni-NTA的金屬離子螯合。洗脫過程,首先用不含有咪唑的緩沖液洗柱,洗脫掉未與Ni-NTA結合的細胞體雜蛋白質,然后用不同濃度的咪唑(20~300 mmol/L)緩沖液進行梯度洗脫,在一定的咪唑濃度條件下,可以得到較純的酶液。
1.7重組蛋白質表達情況分析
利用SDS-PAGE分析重組菌的全細胞蛋白質[15],用5 g/dL的濃縮膠及12~15 g/dL分離膠的不連續垂直平板電泳進行蛋白質分離,考馬斯亮蘭R-250染色;總蛋白質濃度采用Brandford方法,以牛血清蛋白質(BSA)作為標準蛋白質[16]。
1.8ACR酶活力的測定
將20 μL粗酶液加入到酶活力測定緩沖體系,立即檢測340 nm處吸光值在3 min內的變化。
乙偶姻還原酶活力測定緩沖體系:0.05 mol/L AC,5 mmol/L NAD+,磷酸鈉緩沖液pH 6.5。
總酶活力(U/mL)定義:每毫升粗酶液OD600 nm每分鐘消耗1 μmol/L NADH的酶量。
比酶活(U/g)定義:總酶活(U/mL)和粗酶液蛋白質質量濃度(g/mL)的相除值。
1.9搖瓶發酵產2,3-BD實驗
重組枯草芽孢桿菌B.subtilis 168/pMA5-acr和出發菌株B.subtilis 168經過LB液體培養基活化后,按體積分數1%的接種量轉接至10 mL種子培養基,37℃培養12 h后按照體積分數4%的接種量轉接至50 mL發酵培養基于37℃培養,發酵過程跟蹤監測菌體濃度、葡萄糖含量、相關有機酸含量、AC產量和2,3-BD產量。
1.10發酵參數分析方法
1)AC和2,3-BD含量測定:采用毛細管氣相色譜法檢測,儀器型號GC1600(JieDao TECH),色譜柱規格為柱長30 m,內徑0.32 mm,液膜厚度0.50 μm;檢測條件為柱箱溫度160℃,進樣器和檢測器溫度250℃,進樣量0.2 μL,采用FID檢測器。
2)葡萄糖含量測定:采用SBA生物傳感器測定,發酵液經適當稀釋后,取25 μL直接進樣到生物傳感器中,根據葡萄糖標準樣品濃度、儀器讀數及發酵液稀釋倍數計算發酵液中葡萄糖的含量。
3)OD測定:取一定量的種子培養液或發酵液,以相應的培養基作對照液,在600 nm處測定OD值。
4)有機酸產物含量測量:采用高效液相色譜(HPLC)測定,流動相為含有體積分數5%甲醇的50 mmol/L的KH2PO4,體積流量為1.0 mL/min,紫外檢測器檢測波長為210 nm,溫度為30℃。
2 結果與分析
2.1acr的克隆及其表達載體的構建
提取B.subtilis 168的基因組為模板,以Forawrd/Reverse引物進行PCR擴增,得到包含18 bp His編碼序列的基因片段,總長1 041 bp,見圖2。

圖2 acr基因的PCR擴增Fig.2 PCR amplification of acr gene
將目的基因片段,連接到經BamH I和Mlu I酶切的pMA5上,構建表達載體pMA5-acr,并且轉化至B.subtilis 168感受態中。獲得的重組表達載體pMA5-acr經BamH I和Mlu I雙酶切驗證(見圖3),得到約7 200 bp和1 040 bp大小的片段,剛好對應線性化的pMA5和acr的大小,表明外源基因acr已經正確連接到表達載體pMA5上。
2.2ACR在B.subtilis 168/pMA5-acr中的表達
將重組載體pMA5-acr轉化至B.subtilis 168,在卡那霉素抗性平板上篩選陽性重組子,即得B. subtilis 168/pMA5-acr,將其接種于LB液體培養基培養24 h,收集菌體并破碎,菌體用pH 7.0的PBS緩沖液懸浮,采用超聲波破碎細胞,將破碎上清液及其純化蛋白質進行SDS-PAGE分析,結果如圖4所示,ACR的相對分子質量約為39 kDa,與預期的蛋白質相對分子質量大小相符,表明ACR在B. subtilis 168/pMA5-acr中成功獲得了表達。

圖3 重組質粒pMA5-acr的酶切驗證Fig.3 Identification of the recombinant plasmid pMA5-acr by enzyme digestion
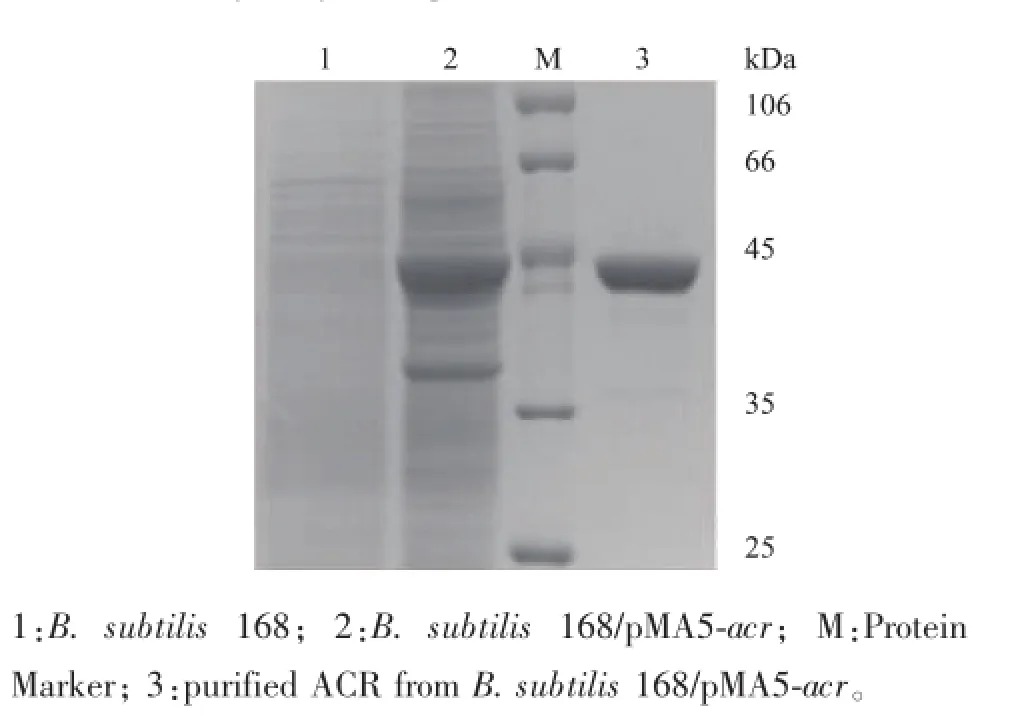
圖4 ACR表達與純化的SDS-PAGE分析Fig.4 SDS-PAGE analysis of expressed and purified recombinant ACR
2.3ACR在B.subtilis 168/pMA5-acr中的酶活力測定
分別測定重組菌和原始菌破碎上清液中ACR的酶活力,結果如表2所示,與原始菌株相比,重組菌中ACR的比酶活提高了3.48倍,表明ACR在B. subtilis 168里成功過量表達。

表2 B.subtilis 168和B.subtilis 168/pMA5-acr的ACR酶活Table 2 ACR enzyme activities of B.subtilis 168 and B. subtilis 168/pMA5-acr
2.4過量表達ACR對菌體生長、糖耗和2,3-BD積累的影響
對B.subtilis 168和B.subtilis 168/pMA5-acr進行發酵實驗,菌體量和葡萄糖變化曲線見圖5,AC和2,3-BD發酵曲線見圖6,發酵特征分析見表3。重組菌在前期的生長速度較慢,發酵培養16 h后,菌體生長速度加快,80 h達到最高菌體量。可能的原因是ACR的過量表達,加重了菌體的負擔,前期生長受到抑制。但是過量表達ACR后,對菌體生長有害的分支路徑副產物有機酸等減少了,所以后半段的菌體長勢較好,菌體量也比出發菌高,使得2,3-BD的合成具備良好的細胞基礎。
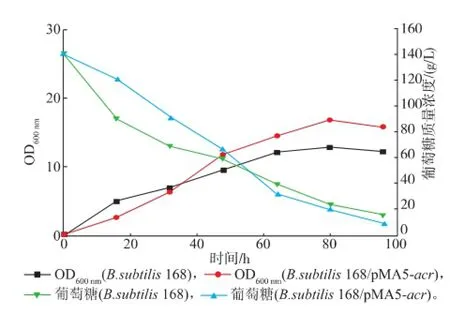
圖5 發酵過程中OD和糖耗曲線Fig.5 Curves of OD and Glucose during the fermentation
從圖5可以看到,重組菌的葡萄糖變化是一個前期下降平緩,中后期較為迅速的過程,而出發菌的糖耗曲線則較為均衡。這種現象表明,過量表達ACR,對菌體的生長造成負擔。在前期,菌體生長緩慢,對于碳源的消耗減少,葡萄糖質量濃度下降較為平緩;而當菌體進入2,3-BD合成期后,對碳源的需求大大加強,發酵培養16 h,葡萄糖質量濃度開始較快減少。
圖6和表3顯示,發酵培養80 h,重組菌的2,3-BD的產量達到最大值33.08 g/L,比出發菌提高了28.62%;轉化率達37.56%,提高了22.87%;副產物AC 11.59 g/L,降低了20.01%;2,3-BD/AC比率為2.854,提高了60.79%。過量表達ACR,并且控制發酵條件在弱酸性,促進了由AC到2,3-BD的轉化程度,成功地使主產物2,3-BD的產量提高,同時降低了副產物AC的積累。
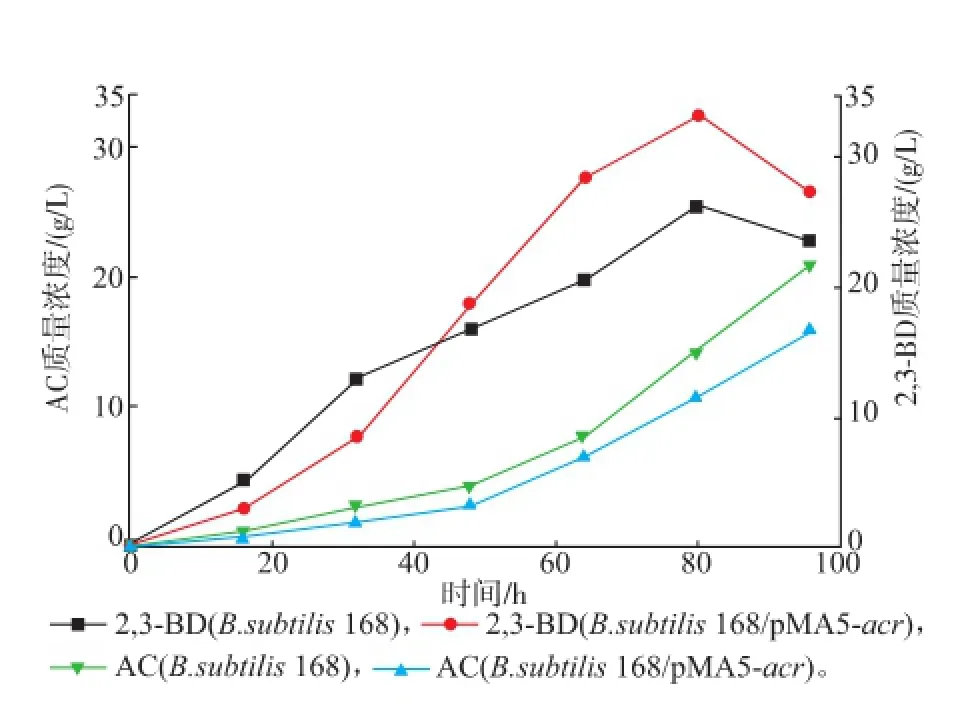
圖6 發酵過程中AC和2,3-BD曲線Fig.6 Curves of AC and 2,3-BD during the fermentation

表3 發酵特征分析Table 3 Analysis of fermentation results
2.5過量表達ACR對有機酸積累的影響
對B.subtilis 168和B.subtilis 168/pMA5-acr兩株菌發酵液進行有機酸測定分析,結果如表4所示,相比出發菌,重組菌株發酵液中副產物甲酸、乙酸、乳酸、琥珀酸分別降低了15.21%、34.35%、35.39%、39.53%。ACR的活力和NADH的含量是2,3-BD合成的兩個重要因素,過量表達ACR,促進了從AC到2,3-BD的合成效率。獲得了更多2,3-BD就意味著有更多的NADH參與了AC向2,3-BD的轉化,也就是說該過程需要消耗更多的NADH,而用于需要NADH參與的其他有機酸副產物的NADH的量會相應減少,這可能是相關支路的有機酸積累量減少的原因所在。
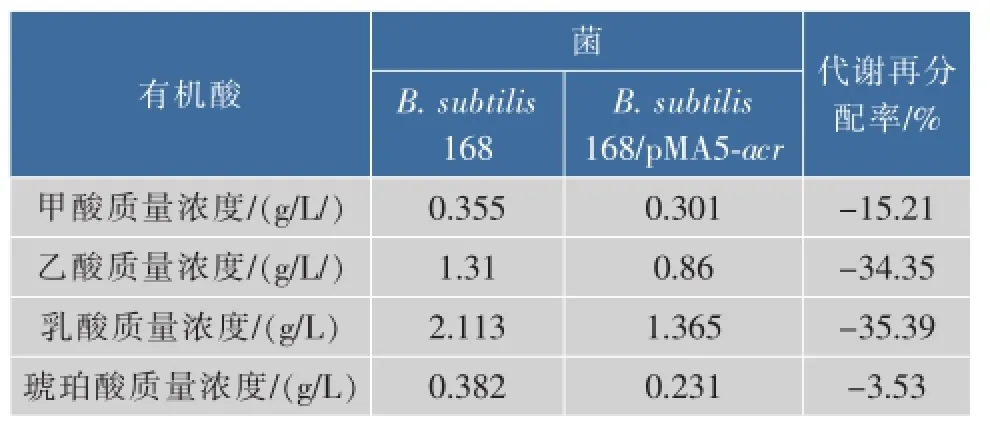
表4 ACR過量表達對發酵過程有機酸質量濃度的影響Table 4 Effects of overexpressing ACR on organic acidsin fermentation
3 結語
以安全菌株B.subtilis 168為出發菌,克隆其乙偶姻還原酶基因acr,構建重組質粒pMA5-acr,將重組質粒轉化入B.subtilis 168,構建重組枯草芽孢桿菌B.subtilis 168/pMA5-acr。測定了重組菌ACR的酶活,并在弱酸性條件下進行發酵試驗。結果表明,ACR在B.subtilis 168/pMA5-acr中實現了過量表達,主產物2,3-BD的產量得到提高,而副產物AC和相關有機酸的積累量則不同程度下降。2,3-BD高產菌株主要是克雷伯氏菌、產氣腸桿菌和粘質沙雷氏菌[3,9-10],然而這些菌株都具有潛在致病性,不符合工業化安全生產的要求。而枯草芽孢桿菌有長期制備發酵食品的歷史,不產內毒素和致熱敏蛋白質,是一種公認安全的微生物,無論是作為出發菌還是宿主菌都具有很強可行性[17]。過量表達ACR和適當控制發酵pH,增強了合成2,3-BD的碳源通量,消耗了更多的輔酶NADH。相應地,AC和需要NADH參與的相關有機酸合成所需的碳源流量和NADH則會減少,因而成功地實現了主產物2,3-BD產量提高和相關副產物產量減少的目標。雖然重組菌產2,3-BD的產量和國內外最高產量還有一定的差距[1],但是相信通過進一步的分子改造和發酵條件優化,一定能實現微生物法高效安全生產2,3-BD的目標。
[1]Ji X J,Huang H.Microbial 2,3-butanediol production:a state-of-the-art review[J].Biotechnology Advances,2011,29(3):351.
[2]Garg S K,Jain A.Fermentative production of 2,3-butanediol:A review[J].Bioresource Technology,1995,51:103-109.
[3]Syu M J.Biological production of 2,3-butanediol[J].Applied Microbiology and Biotechnology,2001,55(1):10-18.
[4]Jarboe L R,Zhang X,Wang X,et al.Metabolic engineering for enzymes in Clostridium[J].Journal of Biomedicine and Biotechnology,2010:761042.
[5]付晶,王萌,劉維喜,等.生物法制備2,3-丁二醇的最新進展[J].化學進展,2012,24(11):2268-2276. FU Jing,WANG Meng,LIU Weixi,et al.Latest advances of microbial production of 2,3-Butanediol[J].Progress in Chemistry,2012,24(11):2268-2276.(in Chinese)
[6]Magee R,Kosaric N.The microbial production of 2,3-butanediol[J].Advances in Applied Microbiology,1987,32:89-161.
[7]Long S K,Patrick R.Microbial production of 2,3-Butylene glycol from cheese whey[J].Applied and Environment Microbiology,1982,43(5):1216-1218.
[8]Fulmer E I,Christensen L M,Kendali A R J.Production of 2,3-Butylene glycol by fermentation[J].Industrial and Engineering Chemistry,1933,25:798-800.
[9]Celinska E,Grajek W.Biotechnological production of 2,3-butanediol-current state and prospects[J].Biotechnology Advances,2009,27:715-725.
[10]Garg S K,Jain A.Fermentative production of 2,3-butanediol:a review[J].Bioresource Technology,1995:103-109.
[11]Maddox I S.Microbial production of 2,3-butanediol[J].VCH Verlagsgesellschaft mbH,1996:269-291.
[12]Larsen S H,Stormer F C.Diacetyl(acetoin)reductase from Aerobacter aerogenes Kinetic mechanism and regulation by acetate of the reversible reduction of acetoin to 2,3-butanediol[J].European Journal of Biochemistry,1973,34(1):100-106.
[13]Machielsen R,Uria A R,Kengen S W M,et al.Production and characterization of a thermostable alcohol dehydrogenase that belongs to the aldo-keto reductase superfamily[J].Applied and Environmental Microbiology,2006,62:233-238.
[14]Wang Z,Song Q,Yu M,et al.Characterization of stereospecific acetoin(diacetyl)reductase from Rhodococcus erythropolis WZ010 and its application for the synthesis of(2S,3S)-2,3-butanediol[J].Applied Microbiology Biotechnology,2013:1.
[15]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,5259:680.
[16]Bradford M M.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[17]李靜靜,徐美娟,張顯,等.一種耐低溫α-乙酰乳酸脫羧酶在枯草芽孢桿菌中的高效表達[J].食品與生物技術學報,2013,32(5):522. LI Jingjing,XU Meijuan,ZHANG Xian,et al.High-Level expression of Cold-Adapted α-acetolactate decarboxylase in Bacillus subtilis[J].Jouranl of Food Science and Biotechnology,2013,32(5):522.(in Chinese)
Improved 2,3-Butanediol Production by Overexpressing Acetoin Reductase in Bacillus subtilis 168
LI Xiupeng1,YANG Taowei2,XU Meijuan3,ZHANG Xian4,RAO Zhiming*
(School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Bacillus subtilis 168 is a safe strain for industrial-scale microbial production of 2,3-butanediol(2,3-BD).However,a large quantity of by-product of acetoin(AC)is accumulated during 2,3-BD fermentation process.Acetoin reductase(ACR)is the key enzyme which catalyzes the conversion of acetoin to 2,3-BD.In this study,in order to improve 2,3-BD production,we firstly cloned the acr gene of acetoin reductase into B.subtilis 168,and then further constructed the recombinant strain B.subtilis 168/pMA5-acr.The results showed that the yield and conversion rate of the 2,3-BD were increased up to 28.62%and 22.87%by the recombinant strain,respectively. Whereas the accumulation of the main by-product of acetoin decreased by 20.01%.Furthermore,the molar yields of by-products of formic acid,acetic acid,lactic acid,and succinate were also decreased.
Acetoin reductase,2,3-Butanediol,Acetoin,B.subtilis 168
Q 78
A
1673—1689(2016)03—0252—06
2014-11-26
國家973計劃項目(2012CB725202);國家自然科學基金項目(31400082,21276110);教育部重點科研項目(113033A);江蘇高校優勢學科建設工程資助和111引智工程項目(111-2-06)。
饒志明(1975—),男,江西臨川人,農學博士,教授,博士研究生導師,主要從事工業微生物育種和發酵代謝方面的研究。
E-mail:raozhm@jiangnan.edu.cn

