6種常用低聚糖對嗜熱鏈球菌體外生長的影響
夏曉風,王虎飛,吳曉玉*(1.江西農業大學生物科學與工程學院,江西南昌330045;2.南昌市發酵應用技術重點實驗室,江西南昌330045)
6種常用低聚糖對嗜熱鏈球菌體外生長的影響
夏曉風1,2,王虎飛1,2,吳曉玉*1,2
(1.江西農業大學生物科學與工程學院,江西南昌330045;2.南昌市發酵應用技術重點實驗室,江西南昌330045)
為使低聚糖和嗜熱鏈球菌在生產中能合理配伍使用,并為益生菌產品的開發提供理論依據,采用6種常用低聚糖分別替代M17培養基中部分或全部乳糖組分,以及添加不同濃度低聚糖到M17作為發酵培養基這兩種方法,研究6種低聚糖對嗜熱鏈球菌生長以及產酸性能的影響。結果表明,6種低聚糖替代乳糖可造成嗜熱鏈球菌生長能力下降甚至停止生長,而在乳糖存在的情況下,添加低聚糖有利于菌株的生長及產酸。
低聚糖;嗜熱鏈球菌;生長;乳酸;高效液相色譜
嗜熱鏈球菌(Streptococcus thermophilus)是乳酸菌的一種,是僅次于乳酸乳球菌的第二大重要的商業菌種[1]。它屬于化能異養型微生物,不能合成多種有機化合物,必須從外界吸收多種小分子營養物質才能較好實現自身的新陳代謝。S.thermophilus之所以成為重要的商業菌種在于其發酵產生大量的有機酸(如乳酸、甲酸、乙酸)、醇、醛、酮和氨基酸等代謝物質,這些物質相互作用形成了發酵產品特有的風味[2-5],是主要的乳品發酵劑之一。S. thermophilus以單一或復合制劑用于青貯飼料時,可以提高畜禽對飼料的利用率,促進畜禽生長,降低畜禽死亡率[6-7]。該菌可大量產生乳酸等有機酸,降低腸道pH,抑制病原菌和腸內腐敗菌的生長,激活宿主的巨噬細胞和免疫細胞,同時顯著降低血清總膽固醇和低密度脂蛋白膽固醇含量[8]。另外,嗜熱鏈球菌具有β-乳糖酶,能緩解乳糖不耐受性,具有部分抑制腫瘤的能力[3]。
研究表明,功能性低聚糖具有多種生理功能,可通過促進腸道益生菌的生長和抑制病原菌的生長來調節腸道菌群平衡,降低血脂血壓和血清膽固醇,促進營養物質(如礦物質)的消化吸收,增強機體免疫功能等[9]。低聚糖同時具有用量小、增殖效果顯著等特性,故少許添加量就能達到良好的生理功能。目前廣泛應用于食品、醫藥、保健品,以及飼料工業[10-11]。雖然低聚糖和嗜熱鏈球菌對人體和動物均具有明顯的益生作用,但至目前,就6種常用低聚糖對嗜熱鏈球菌生長影響的研究少有報道。因此,本文擬闡述6種常用低聚糖對嗜熱鏈球菌生長的影響,以期為低聚糖和嗜熱鏈球菌在生產中的配伍使用以及益生菌產品的開發提供科學依據。
1 材料與方法
1.1材料
1.1.1菌種Streptococcus thermophilus(嗜熱鏈球菌),購自中國工業微生物菌種保藏管理中心。
1.1.26種低聚糖種類低聚異麥芽糖(質量分數99%)、低聚果糖(質量分數99%)、低聚乳糖(質量分數95%)、低聚半乳糖(質量分數99%)、低聚木糖(質量分數99%)和乳酮糖(質量分數99%),購自河南金源生物科技有限公司。
1.1.3培養基M17培養基(改良培養基,g/L):胰蛋白胨5,魚蛋白胨5,牛肉膏5,酵母浸膏2.5,抗壞血酸0.5,硫酸鎂0.25,甘油10,磷酸二氫鉀5,乳糖3;pH 7.0。詳見文獻[12]。
1.2方法
1.2.1菌種母液的制備取5支處于對數生長期的嗜熱鏈球菌斜面,用M17培養基洗下,調節A600= 1.000±0.050,待用。
1.2.2低聚糖替代M17培養基的乳糖對S. thermophilus生長影響的測定低聚糖分別按照25%、50%、100%的替換量部分或完全替代基礎培養基中的乳糖,制成替代培養基A1。取菌種母液(A600=1.000±0.05)按體積分數1%的接種量接種于培養基A1,42℃靜置培養,分別取培養4、12、24、36、48 h菌液,測定各菌液中嗜熱鏈球菌A600值和pH值,每個處理設3個重復,并以接種于M17培養基和接種于不含乳糖組分的M17培養基的菌液為對照組。
1.2.3M17培養基中添加低聚糖對S.thermophilus生長影響的測定低聚糖按照0.05、0.1、0.25 g/dL 和0.5 g/dL 4種不同質量濃度添加到M17培養基中,制成添加培養基A2。取菌種母液(A600=1.000± 0.05)按體積分數1%的接種量接種于培養基A2,42℃靜置培養,分別取培養4、12、24、36、48 h菌液,測定各菌液中嗜熱鏈球菌A600值和pH值,每個處理設3個重復,并以接種于M17培養基的為對照組。
1.2.4高效液相色譜法測定菌液中乳酸和乙酸含量菌液前處理:取由實驗1.2.2和1.2.3確定的對嗜熱鏈球菌生長促進作用較好的最適低聚糖添加量,42℃靜置培養,分別取培養0、4、12、24、36、48 h的菌液,離心,取上清液,用0.22 μm微孔濾膜過濾兩次,稀釋2.5倍,待測。色譜條件:色譜柱Aminex Hpx-87H柱,流動相0.002 mol/L H2SO4,體積流量0.6 mL/min,柱溫35℃,檢測波長210 nm,進樣量15 μL。
2 結果與分析
2.1低聚糖替代M17培養基的乳糖組分對S. thermophilus生長的影響
由圖2可知,路徑3,即深圳港-江門水上“巴士”,具有不可替代的優勢.相比路徑1在運輸成本、時間和服務水平上均占有絕對優勢,這主要因為江門新會與深圳港的水上距離更近,且深圳港可為貨主提供更好的服務.雖然路徑3的運輸成本高于路徑2,但其規模運輸避免了多次往返,節約了運輸時間使得經濟性較好.故深圳港-江門新會水上“巴士”的優勢明顯,短時間內不會貨源流失.
2.1.16種低聚糖對S.thermophilus生長量的影響按照1.2.2研究低聚糖替代M17培養基的乳糖對S. thermophilus生長的影響,結果如圖1所示:6種低聚糖部分或完全取代乳糖時,S.thermophiluss的生長量均有不同程度的降低,且均隨著低聚糖替代乳糖比例的增大,生長量降低的幅度越大。其中低聚乳糖完全替代乳糖(100%替代乳糖)時,該菌生長量在整個生長過程中(0~48 h)沒有變化,說明其生長被抑制,而低聚果糖、低聚半乳糖與低聚木糖完全替代乳糖時,生長量變化遲緩,菌株生長緩慢。無糖組嗜熱鏈球菌在整個培養過程中完全不生長。
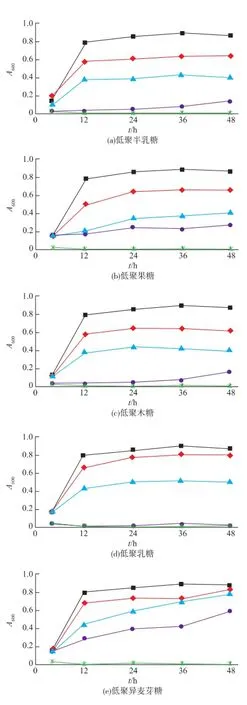
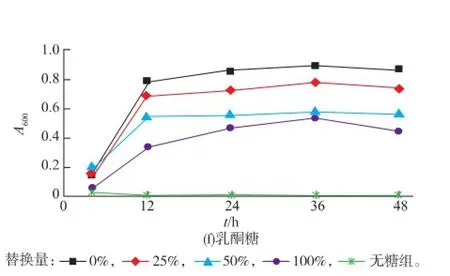
圖1 6種低聚糖對嗜熱鏈球菌菌液A600值的影響(替代實驗)Fig.1 Effects of six oligosaccharides on growth of S. thermophiluss(replacement test)
2.1.2低聚糖替代M17培養基乳糖組分對S. thermophiluss發酵液pH值的影響按照1.2.2測定培養0、4、12、24、36、48 h菌液的pH值,設置M17培養基的發酵液為對照組,見圖2。結果表明,低聚糖替代乳糖的比例越大,隨培養時間的延長,發酵液pH下降幅度越小;尤其低聚乳糖、低聚半乳糖、低聚果糖以及低聚木糖在完全替代乳糖時,與初始pH值比較,培養48 h后pH下降幅度不明顯。圖2顯示,發酵液pH值均在培養12 h時有一個轉折點。培養0~12 h時,pH值下降幅度較大,12 h以后下降幅度減緩,pH值變化不明顯。與圖1相比較,發酵液pH值的變化規律與菌量的變化規律存在相關性,表明菌量大小影響發酵液產酸量,從而影響pH值的變化。無糖組嗜熱鏈球菌發酵液pH在整個培養過程中與初始pH相比幾乎無變化。

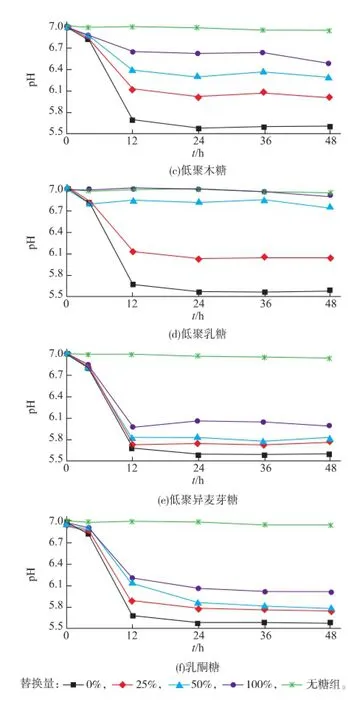
圖2 6種低聚糖對嗜熱鏈球菌菌液pH的影響(替代實驗)Fig.2 Effects of six oligosaccharides on solution pH of S. thermophiluss(replacement test)
2.2M17培養基中添加低聚糖對S.thermophilus生長的影響
2.2.1低聚糖不同添加量對S.thermophilus生長量的影響按照1.2.3,M17培養基中添加低聚糖對S.thermophilus生長的影響如圖3所示,結果表明,6種低聚糖作為添加因子按照不同質量濃度添加到M17培養基時,S.thermophilus的生長量均有不同程度的增加。其中,與對照組相比,低聚異麥芽糖、低聚果糖、低聚半乳糖和乳酮糖的添加量為0.5 g/dL時,S.thermophilus的生長量增加幅度最大。而低聚乳糖和低聚木糖則分別在0~0.1 g/dL和0~0.25 g/dL內隨著添加量的增大,S.thermophilus的生長量增大,超過這個范圍則生長遲緩。低聚乳糖最佳添加量為0.1 g/dL,低聚木糖為0.25 g/dL。
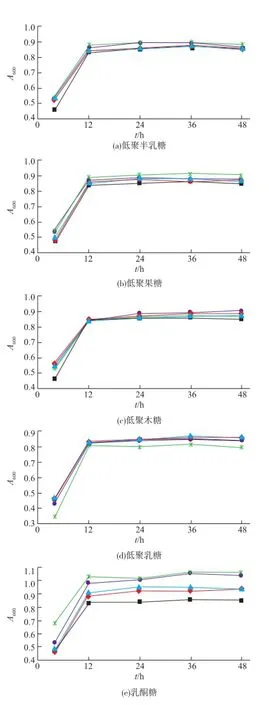

圖3 6種低聚糖對嗜熱鏈球菌菌液A600值的影響(添加實驗)Fig.3 Effects of six oligosaccharides on growth of S. thermophiluss(adding test)
2.2.2低聚糖不同添加量對發酵液pH值的影響按照1.2.3測定培養0、4、12、24、36、48 h菌液的pH值,設置M17培養基的發酵液為對照組,見圖4。結果表明,與對照組相比,實驗組隨著培養時間的延長,發酵液pH下降幅度增大。當低聚異麥芽糖、低聚果糖、低聚半乳糖和乳酮糖的添加量為0.5 g/dL時,S.thermophilus的發酵液pH與初始pH相比有較大幅度下降。而低聚乳糖和低聚木糖則分別在0~0.1 g/dL和0~0.25 g/dL范圍內隨著添加量的增大,發酵液pH下降,這與圖3菌量的變化規律一致。由圖4可以看出,培養12 h以后pH變化不明顯。


圖4 6種低聚糖對嗜熱鏈球菌菌液pH的影響(添加實驗)Fig.4 Effects of six oligosaccharides on solution pH of S. thermophiluss(adding test)
2.3添加低聚異麥芽糖和乳酮糖對發酵液乳酸和乙酸生成量的影響
在M17培養基中添加低聚異麥芽糖和乳酮糖后,菌株產乳酸和乙酸的能力均較對照組有不同程度的提高。其中添加低聚異麥芽糖的發酵液乳酸和乙酸含量高于添加乳酮糖的。菌株產乳酸水平在0~12 h內呈直線上升,培養12 h達最大值,以后趨于穩定;而乙酸含量則在0~36 h時呈上升趨勢,36 h達最大值,之后,乙酸含量不斷下降;且3個處理組均顯示乙酸含量遠低于乳酸含量,說明菌株主要通過同型乳酸發酵產生乳酸,使發酵液pH值下降。將圖5(a)與菌株生長量的增長及發酵液pH值變化趨勢(圖3(e)(f);圖4(e)(f))相比較,其變化趨勢相似度極高,均在12 h達到最大值,以后趨于穩定。推測菌株生長量的提高,造成發酵產乳酸總體能力增強,造成發酵液pH值下降。
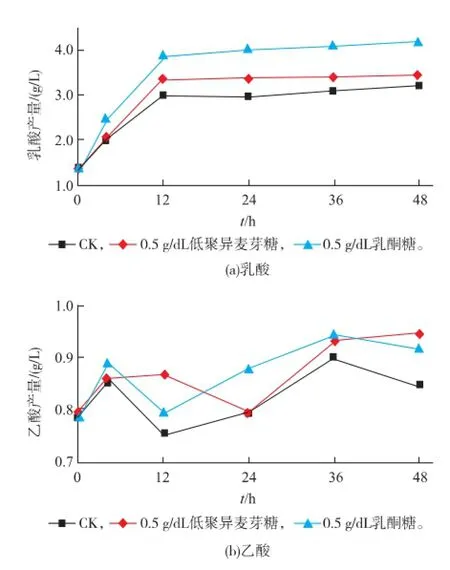
圖5 不同培養時間發酵液中乳酸和乙酸產量變化Fig.5 Changes of lactic acid and acetic acid content in the fermented solution within different culture time

圖6 嗜熱鏈球菌培養12 h發酵液的乳酸和乙酸色譜圖Fig.6 Chromatogram of lactic acid and acetic acid from broth fermented for 12 h by S.thermophilus
3 討論
低聚糖又稱寡糖,是由2~10個相同的或不同的單糖單位通過糖苷鍵聚合而成的直鏈或分支的一類低度聚合糖,其相對分子質量約為300~2 000,分為普通低聚糖和功能性低聚糖兩大類[14-16]。普通低聚糖(如蔗糖、麥芽糖、麥芽三糖、乳糖等)可以被機體消化吸收[17-18]。功能性低聚糖[19](如水蘇糖、棉子糖、異麥芽酮糖、乳酮糖、低聚果糖、低聚木糖、低聚半乳糖、低聚乳果糖、低聚異麥芽糖和低聚異麥芽酮糖等)因在動物胃腸道沒有水解這些糖類(除異麥芽酮糖之外)的酶系統,不被消化吸收而直接為益生菌所利用,因此可以作為益生菌的增殖因子[9,18,20-21]。
本課題的替代實驗結果顯示,當M17培養基中不含乳糖成分時,嗜熱鏈球菌生長量及pH值變化趨于零,說明盡管培養基中存在其他可用碳源物質,但該菌株在無乳糖條件下幾乎不生長。當6種低聚糖(低聚異麥芽糖、低聚果糖、低聚乳糖、低聚半乳糖、低聚木糖和乳酮糖)以不同比率替代乳糖作為碳源時,隨著替代量的增大,嗜熱鏈球菌的生長量降低、產酸能力減弱,且均低于乳糖為碳源時;當完全替代乳糖,替代糖為低聚乳糖、低聚半乳糖以及低聚木糖時,菌株幾乎不生長或生長極其緩慢。表明以上述6種低聚糖為碳源,不利于S. thermophilus的生長與產酸。由添加實驗可以看出,6種低聚糖中低乳酮糖作為促生因子,可以有效促進嗜熱鏈球菌的生長、增強產酸能力;其次為低聚異麥芽糖、低聚半乳糖及低聚果糖,而低聚木糖、低聚乳糖的促生長作用效果不明顯。通過高效液相色譜測定發酵液中乳酸和乙酸含量進一步證實:伴隨S. thermophilus生長量增加,其產乳酸能力提高,引起發酵液pH值下降,且發酵液乳酸含量在菌量達到最大值(發酵培養12 h)時也同時達到最大值并趨于穩定。
據資料顯示,大部分S.thermophilus菌株沒有分解淀粉和大分子碳水化合物的酶系,不能利用大分子物質作碳源,僅能利用葡萄糖、乳糖、蔗糖等單糖和一些寡糖為碳源[4,22]。其中乳糖作為碳源生長率最高,其次為蔗糖,再次為葡萄糖與果糖,且菌株生長率低至易被代謝的乳糖、蔗糖的數分之一[23-24]。菌株在對糖類的吸收利用過程中,磷酸烯醇式丙酮酸-糖磷酸轉移酶系統(phosphoenolpyruvate-dependent sugar phosphotransferase system,簡稱PTS)是乳酸菌及其他細菌的主要糖吸收系統。但對于S. thermophilus,蔗糖和果糖是唯一可以由PTS吸收利用的糖[25-26]。乳糖則通過專用滲透酶LacS(Lactose/ H+同向轉移或lactose/galactosetang交換)被吸收利用[27]。
4 結語
根據本課題的實驗結果,6種低聚糖替代乳糖作為碳源,不利于S.thermophilus的生長與產酸,而在培養基中添加少量低聚糖(0.05~0.5 g/dL),如乳酮糖、低聚異麥芽糖、低聚半乳糖等,對其生長與產酸有明顯或少量促進作用,推測該特性與S. thermophilus吸收、轉化、利用低聚糖的能力有關,其受制于低聚糖的結構特征。有關低聚糖結構與S. thermophilus吸收利用的關系,有待進一步深入研究。
[1]Arioli S,Monnet C,Guglielmetti S,et al.Aspartate biosynthesis is essential for the growth of Streptococcus thermophilus in milk,and aspartate availability modulates the level of urease activity[J].Applied and Environmental Microbiology,2007,73(18):5789-5796.
[2]康歡,鄭遂,王偉,等.4株嗜熱鏈球菌產酸和產香力的比較與分析[J].食品科技,2013(1):13-17. KANG Huan,ZHENG Sui,WANG Wei,et al.Comparison and analysis of ability to produce acid and aroma byfour Streptococcus thermophilus[J].Food Science and Technology,2013(1):13-17.(in Chinese)
[3]葉淑紅,何連芳,張彧,等.乳酸菌的發酵條件及其對發酵胡蘿卜汁風味的影響[J].食品科學,2005,26(5):127-130. YE Shuhong,HE Lianfang,Zhang Yu,et al.Study on lactobacillus fermentation conditions and effects on flavor of fermented carrot juice[J].Food Science,2005,26(5):127-130.(in Chinese)
[4]陳芳,靳亞平.嗜熱鏈球菌部分生物學特性研究[J].中國奶牛,2007(8):42-44. CHEN Fang,JIN Yaping.Some biological characteristics study of Streptococcus thermophilus[J].China Dairy Cattle,2007 (8):42-44.(in Chinese)
[5]Ramya Iyer,Tomar S K,Uma Maheswari T.Streptococcus thermophilus strains:Multifunctional lactic acid bacteria[J]. International Dairy Journal,2010,20:133-141.
[6]劉福柱,牛竹葉.日糧中添加乳酸菌劑對雛雞生長發育的影響[J].畜牧獸醫雜志,1995,14(1):9-10. LIU Fuzhu,NIU Zhuye.Effect of supplementing lactobacillus additives acid in diet on grouth and development of chick[J]. Journal of Animal Science and Veterinary Medicine,1995,14(1):9-10.(in Chinese)
[7]穆新元,孫春秋.新生仔豬口服乳酸菌效果觀察[J].遼寧畜牧獸醫,1999(6):8-9. MU Xinyuan,SUN Chunqiu.Roles of lactic acid bacterium in newborn piglets by oral administration[J].Liaoning Journal of Animal Husbandry and Veterinary Medicine,1999(6):8-9.(in Chinese)
[8]Akalin A S,Gone S.Influence of yegurl and acidephilus yegurt on serum cholesteml levels in mice[J].J Dairy Sci,1997,80:2721-2725.
[9]安麗娜,周慶民,馮萬宇,等.低聚糖的生理作用及其在家畜生產中的應用[J].畜牧獸醫科技信息,2011(6):123. AN Lina,ZHOU Qingmin,FENG Wanyu et al.Physiological functions of functional oligosaccharide application in livestock and poultry[J].Chinese Journal of Animal Husbandry and Veterinary Medicine,2011(6):123.(in Chinese)
[10]滕超,查沛娜,曲玲玉,等.功能性寡糖研究及其在食品中的應用進展[J].食品安全質量檢測學報,2014(1):1. TENG Chao,ZHA Peina,QU Lingyu,et al.Progress of research and application in food industry of functional oligosaccharides [J].Journal of Food Safety and Quality,2014(1):1.(in Chinese)
[11]李麗麗,劉蕾,云婷婷,等.低聚糖對雙歧桿菌的增殖研究[J].廣州化工,2013,41(5):66-67. LI Lili,LIU Lei,YUN Ting ting,et al.The research of proliferation on bifidobacterium byoligosaccharides[J].Guangzhou Chemical Industry,2013,41(5):66-67.(in Chinese)
[12]曹文海,任國譜.嗜熱鏈球菌的檢驗培養基(M17)的改良[J].乳品加工,2006(1):46-48. CAO Wenhai,REN Guopu.Improvement of test medium(M17)for Streptococcus thermophiles[J].Dariy Industry,2006(1):46-48.(in Chinese)
[13]Khalid K.An overview of lactic acid bacteria[J].Int J Biosci,2011,1(3):1-13.
[14]胥九兵,劉海玉,李克文,等.高純度功能性低聚糖的生產及應用[J].精細與專用化學品,2013(4):7. XU Jiubing,LIU Haiyu,LI Kewen,et al.Production and application of high purity functional oligosaccharides[J].Fine and Specialty Chemicals,2013(4):7.(in Chinese)
[15]龐明利,琚爭艷,楊海軍.功能性低聚糖在乳品行業中的應用進展[J].中國乳業,2010(12):48-50. PANG Mingli,JU Zhhengyan,YANG Haijun.The application of functional oligosaccharides on dairy industry[J].China Dairy,2010(12):48-50.(in Chinese)
[16]單黎然,龔月樺,賈建光,等.4種重要功能性低聚糖的研究進展[J].西北農林科技大學學報:自然科學版,2006,34(7):1. SHAN Liran,GONG Yuehua,JIA Jianguang,et al.Research progress in 4 key functional oligosaccharides[J].Jour.of Northwest Sci-Tech Univ.of Agri.and For.:Nat.Sci.Ed.,2006,34(7):1.(in Chinese)
[17]劉紅梅,劉聚勝.功能性低聚糖的研究及在食品中的應用現狀[J].輕工科技,2012(4):15-16. LIU Hongmei,LIU Jusheng.Research progress and application in food of functional oligosaccharides[J].Light Industrial Science and Technology,2012(4):15-16.(in Chinese)
[18]李金敏,張菊,張志焱,等.功能性低聚糖對雙歧桿菌的增殖作用研究現狀及前景[J].飼料廣角,2012(21):19-20. LI Jinmin,ZHANG ju,zhang Zhiyan,et al.Prospects and advanced study on proliferative effect of functional oligosaccharides on bifidobacteria[J].Feed China,2012(21):19-20.(in Chinese)
[19]閔力,劉立恒,許蘭嬌,等.功能性寡糖的研究進展[J].飼料研究,2012(9):18-22. MIN Li,LIU Liheng,XU Lanjiao,et al.Progress of study on functional oligosaccharides[J].Feed Research,2012(9):18-22.(in Chinese)
[20]姜竹茂.功能性低聚糖的發展及應用[J].食品安全導刊,2010(9):58-60. JIANG Maoheng.Development and applications of functional oligosaccharides[J].China Food Safety Magazine,2010(9):58-60.(in Chinese)
[21]魏紅軍.功能性低聚糖的生理功能及其在食品中的應用[J].農產品加工學刊,2011(9):126-128. WEI Hongjun.Physiologic functions and application in food of functional oligosaccharides[J].Academic Periodical of Farm Products Processing,2011(9):126-128.(in Chinese)
[22]張興昌.嗜熱鏈球菌高密度培養及冷凍保護的研究[D].呼和浩特:內蒙古農業大學,2011.
[23]Poolman B,Royer T J,Mainzer S E,et al.Carbohydrate utilization in Streptococcus thermophilus:characterization of the genes for aldose 1-epimerase(mutarotase)and UDPglucose 4-epimerase[J].Journal of bacteriology,1990,172(7):4037-4047.
[24]van den Bogaard P T C,Kleerebezem M,Kuipers O P,et al.Control of lactose transport,β-galactosidase activity,and glycolysis by CcpA in Streptococcus thermophilus:evidence for carbon catabolite repression by a non-phosphoenolpyruvate-dependent phosphotransferase system sugar[J].Journal of Bacteriology,2000,182(21):5982-5989.
[25]de Vos W M,Vaughan E E.Genetics of lactose utilization in lactic acid bacteria[J].FEMS Microbiology Reviews,1994,15 (2):217-237.
[26]Postma P W,Lengeler J W,Jacobson G R.Phosphoenolpyruvate:carbohydrate phosphotransferase systems of bacteria[J]. Microbiological Reviews,1993,57(3):543.
[27]Gunnewijk M G W,Poolman B.Phosphorylation state of HPr determines the level of expression and the extent of phosphorylation of the lactose transport protein of Streptococcus thermophilus[J].Journal of Biological Chemistry,2000,275(44):34073-34079.
Effects of Six Commonly Used Oligosaccharides on the Growth of Streptococcus thermophilus in vitro
XIA Xiaofeng1,2,WANG Hufei1,2,WU Xiaoyu*1,2
(1.School of Bioscience and Bioengineering,Jiangxi Agricultural University,Nanchang 330045,China;2.Nanchang Key Laboratory of Fermentation Application Technology,Nanchang 330045,China)
The effect of six oligosaccharides on the growth of Streptococcus thermophilus and its capability of lactic acid production was investigated by two methods to provide a theoretical basis for the realization of the compatibility use of oligosaccharides and Streptococcus thermophilus for industry production and probiotic products development.One way is to partly or completely replace the lactose composition of M17 culture medium by six commonly used oligosaccharides.Another way is to add six oligosaccharides with various concentrations into M17 culture medium.Six oligosaccharides have been proved to cause a reduction in the growth of Streptococcus thermophilus or even cause growth stop if oligosaccharides completely replaced lactose,while the addition of oligosaccharides was conducive to the growth of Streptococcus thermophilus with the presence of lactose.
oligosaccharide,Streptococcus thermophilus,growth,lactic acid,HPLC
TS 24;TS 201
A
1673—1689(2016)03—0310—08
2014-11-25
農業部功能食品重點實驗室開放基金項目(粵農科蠶加字【2012】9號)。
吳曉玉(1966—),女,江西南昌人,工學博士,教授,主要從事微生物開發利用研究。E-mail:xywu166@163.com

