雙酶體系高效制備(R)-2-氯-1-(3-氯苯基)乙醇
朱利娟,余濤,顧穎,楊標,鄔敏辰*(.江南大學藥學院,江蘇無錫4;.江南大學無錫醫學院,江蘇無錫4)
雙酶體系高效制備(R)-2-氯-1-(3-氯苯基)乙醇
朱利娟1,余濤1,顧穎2,楊標2,鄔敏辰*2
(1.江南大學藥學院,江蘇無錫214122;2.江南大學無錫醫學院,江蘇無錫214122)
人工合成經密碼子優化的羰基還原酶基因Sys1,并與葡萄糖脫氫酶基因Sygdh共克隆至雙啟動子表達質粒pETDuet-1中,獲重組質粒pETDuet-Sygdh-Sys1。將其轉化大腸桿菌(Escherichia coli)BL21(DE3),構建了共表達羰基還原酶和葡萄糖脫氫酶的重組工程菌E.coli BL21/pETDuet-Sygdh-Sys1。以經IPTG誘導的重組菌為生物催化劑,不對稱還原間-氯苯甲酰甲基氯(m-CPC),制備手性藥物中間體(R)-2-氯-1-(3-氯苯基)乙醇((R)-CCE)。在m-CPC 30 mmol/ L、重組濕菌體70 mg/mL、葡萄糖40 mmol/L、輔酶NADP+0.2 mmol/L,以及pH 7.0、反應溫度40℃和反應時間3 h等條件下,所獲手性化合物(R)-CCE的摩爾產率高達99.0%,對映體過量值(e.e.值)為100%。
雙酶體系;羰基還原酶;葡萄糖脫氫酶;共表達;(R)-2-氯-1-(3-氯苯基)乙醇
手性醇是合成藥物、香料、農藥和功能性材料等的重要中間體[1]。例如,(R)-2-氯-1-(3-氯苯基)乙醇(2-chloro-1-(3-chlorophenyl)ethanol,(R)-CCE)用于合成多種β3-腎上腺素能受體(adrenergic receptor,AR)激動劑,如抗抑郁藥SR 58611A,減肥藥BRL 37344等[2-3]。手性醇的制備可采用化學法和生物法,而每種方法又可分為拆分法和合成法。化學拆分法或合成法需要昂貴的金屬催化劑,以及對藥物中金屬離子的含量有嚴格標準,從而限制了其廣泛的應用[4-6]。迄今為止,采用生物拆分法制備手性醇的報道較多,然而外消旋體拆分所獲某種對映異構體的理論產率僅為50%[7]。
近年來采用生物合成法不對稱還原羰基化合物制備手性醇已成為熱點:
如Lin等[8]利用釀酒酵母(Saccharomyces cerevisiae)不對稱還原間-氯苯甲酰甲基氯(mchlorophenacyl chloride,m-CPC)合成(R)-CCE,其產率達到97%,對映體過量(enantiomeric excess,e.e.)值為99%。
倪曄等[9]利用安大略假絲酵母(Candida ontarioensis)還原m-CPC所獲(R)-CCE的產率和e.e.值分別為97.5%和99.5%。
朱敦明等[10]研究發現,來源于木蘭假絲酵母(C. magnoliae)的羰基還原酶(EC 1.1.1.184)S1可以催化苯乙酮及其衍生物生成相應的手性醇,但未對m-CPC進行研究。
本研究基于羰基還原酶S1編碼基因s1的核苷酸序列(GenBank登錄號:AB036927),針對E.coli密碼子偏愛性對編碼基因s1進行密碼子優化及人工合成,命名為Sys1。由于羰基還原酶催化的還原反應需要輔酶NADPH的參與,昂貴的輔酶限制了其應用,而葡萄糖脫氫酶[11]能夠特異性地催化D-葡萄糖生成葡萄糖酸,并伴隨NADP+向輔酶NADPH的轉化。本研究中將Sys1與葡萄糖脫氫酶基因Sygdh[11]分別克隆至pETDuet-1雙啟動子的下游,轉化E.coli BL21(DE3),構建共表達兩種酶的重組工程菌E.coli BL21/pETDuet-Sygdh-Sys1,從而實現底物m-CPC的還原和輔酶NADPH的再生循環,如圖1所示。為制備高摩爾產率和高e.e.值的(R)-CCE,研究中還對重組菌催化m-CPC不對稱還原反應的條件(如底物、菌體、葡萄糖和輔酶濃度等)進行了優化。
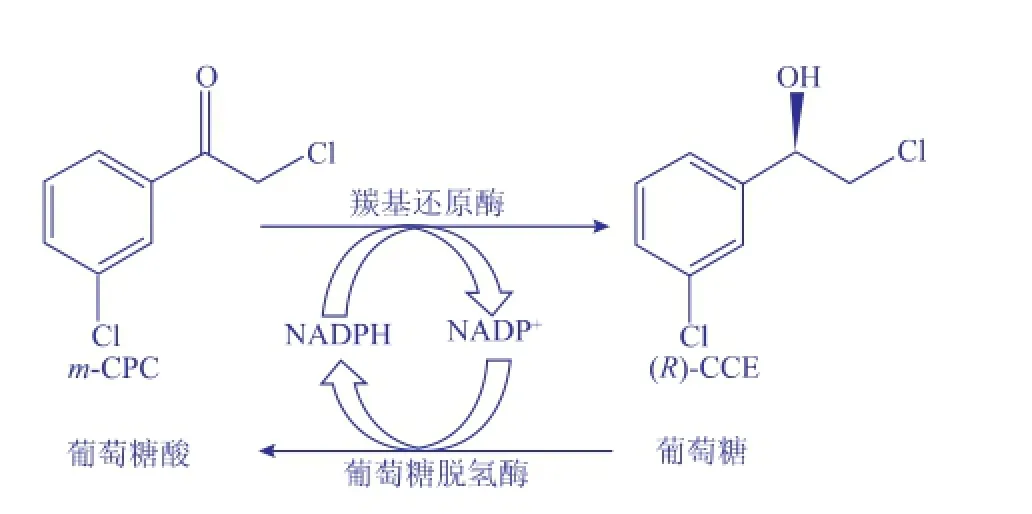
圖1 重組菌E.coli BL21/pETDuet-Sygdh-Sys1不對稱還原m-CPC制備(R)-CCEFig.1 Synthesis of(R)-CCE by asymmetrically reducing m-CPCusingtherecombinantE.coliBL21/ pETDuet-Sygdh-Sys1
1 材料與方法
1.1菌株、質粒和培養基
重組質粒pET28a-Sygdh,由作者所在實驗室構建和保藏;大腸桿菌E.coli JM109,BL21(DE3)和表達質粒pETDuet-1,購自Novagen公司;克隆質粒pUCm-T,購自上海Sangon公司。
LB培養基(g/dL):蛋白胨1,酵母提取物0.5,NaCl 1(固體培養基添加1.5 g/dL瓊脂粉);pH 7.2。
1.2主要試劑和儀器
各種限制性內切酶,rTaq DNA聚合酶,T4 DNA連接酶,DNA Markers和蛋白質Marker,購自大連TaKaRa公司;IPTG和EZ-10柱式DNA膠回收試劑盒,購自上海Sangon公司;NADPH和NADP+,購自上海源葉生物科技有限公司;m-CPC,(R)-CCE和(S)-CCE,Sumitomo公司產品;外消旋體(R,S)-CCE,由作者所在實驗室合成;其他試劑均為國產或進口分析純。
GC-2014型氣相色譜儀,購于日本Shimadzu公司;CP-Chirasil-DEX CB手性氣相色譜柱(25 m× 0.25 nm×0.25 μm),購于美國Agilent科技公司。
1.3密碼子優化及基因Sys1合成
不同的宿主細胞對密碼子有不同的偏愛性[12]。為高效表達羰基還原酶,參照宿主細胞E.coli的密碼子偏愛性表,對源自木蘭假絲酵母的羰基還原酶基因s1中的稀有密碼子進行替換,并在基因5′和3′端分別添加NdeⅠ和XhoⅠ酶切位點。將密碼子優化后的基因命名為Sys1(GenBank登錄號:KJ522844),由上海Sangon公司合成并與pUCm-T連接,獲重組質粒pUCm-T-Sys1。
1.4重組菌的構建及誘導表達
用NdeⅠ和XhoⅠ雙酶切pUCm-T-Sys1,割膠回收目的基因Sys1,與經同樣雙酶切的質粒pETDuet-1連接,獲重組質粒pETDuet-Sys1;再用NcoⅠ和HindⅢ雙酶切pET28a-Sygdh,割膠回收Sygdh,與經同樣雙酶切的pETDuet-Sys1連接,獲含有雙基因的重組質粒pETDuet-Sygdh-Sys1。該重組質粒經測序驗證正確后轉化E.coli BL21(DE3),獲重組工程菌E.coli BL21/pETDuet-Sygdh-Sys1。該重組菌的誘導表達參見文獻[11]。8 000 r/min離心10 min收集菌體,用磷酸鉀緩沖液(100 mmol/L、pH 7.0)洗滌菌體兩次,用于SDS-PAGE分析和催化底物m-CPC還原反應,未經IPTG誘導的重組菌用作陰性對照。
1.5輔酶NADPH的再生循環
在磷酸鉀緩沖液(100 mmol/L、pH 7.0)中加入10 mg經IPTG誘導的濕菌體、終濃度50 mmol/L葡萄糖、1 mmol/L NADPH或NADP+和2 mmol/L m-CPC,用緩沖液定容至1 mL,置于40℃、220 r/min搖床上反應12 h。8 000 r/min離心10 min,取0.6 mL上清液加入1 mL乙酸乙酯,激烈震蕩后吸取上層有機相,無水硫酸鎂干燥,過0.22 μm有機膜,用于氣相色譜分析。
1.6(R)-2-氯-1-(3-氯苯基)乙醇的分析
樣品分析采用GC-2014氣相色譜儀、CPChirasil-DEX CB手性氣相色譜柱和氫火焰離子檢測器。參數設置:進樣口和檢測器溫度均為250℃;初始柱溫145℃維持2 min,再以5℃/min升溫至200℃;載氣氮氣,體積流量2.0 mL/min,分流比1∶50。在此檢測條件下,m-CPC、(R)-CCE和(S)-CCE的出峰時間分別為8.172、10.975和11.184 min,如圖2所示。

圖2 m-CPC和CCE的氣相色譜圖Fig.2 Gas chromatograms of m-CPC and CCE

式(1)(2)中,r為摩爾產率;n1、n2、n3、n4分別為(R)-CCE、m-CPC、(R)-CCE-(S)-CCE、(R)-CCE+(S)-CCE物質的量(mol);e為對映體過量值(e.e.值)。
1.7重組菌催化條件的優化
在磷酸鉀緩沖液(100 mmol/L、pH 7.0)中加入不同終濃度的m-CPC、濕菌體、葡萄糖和NADP+,用緩沖液定容至1 mL,在40℃、220 r/min催化反應6 h。反應樣品參照1.5和1.6進行處理和分析,以(R)-CCE的產率為指標,優化重組菌的催化條件。
2 結果與討論
2.1含雙基因重組表達質粒的構建
用NdeⅠ和XhoⅠ分別雙酶切pUCm-T-Sys1和pETDuet-1,將目的基因Sys1與pETDuet-1進行連接、轉化JM109,篩選得到重組菌JM109/pETDuet-Sys1。再對pETDuet-Sys1和pET28a-Sygdh分別進行NcoⅠ和HindⅢ雙酶切,將基因Sygdh連接到pETDuet-Sys1中,轉化E.coli BL21,篩選得到重組菌E.coli BL21/pETDuet-Sygdh-Sys1。分別用NdeⅠ和XhoⅠ、NcoⅠ和HindⅢ、NcoⅠ和XhoⅠ雙酶切含有雙基因的重組質粒pETDuet-Sygdh-Sys1,見圖3(a),瓊脂糖凝膠電泳分析如圖3(b)所示,各基因長度與理論值相符。
2.2羰基還原酶與葡萄糖脫氫酶的表達與鑒定
重組菌E.coli BL21/pETDuet-Sygdh-Sys1經1.0 mmol/L的IPTG于25℃誘導12 h后。利用Quantity One軟件分析SDS-PAGE電泳圖,結果顯示,與未誘導的對照組相比(圖4,泳道1),重組菌E.coli BL21/pETDuet-Sygdh-Sys1的表達產物在表觀相對分子質量30.0 kDa(羰基還原酶)和41.0 kDa
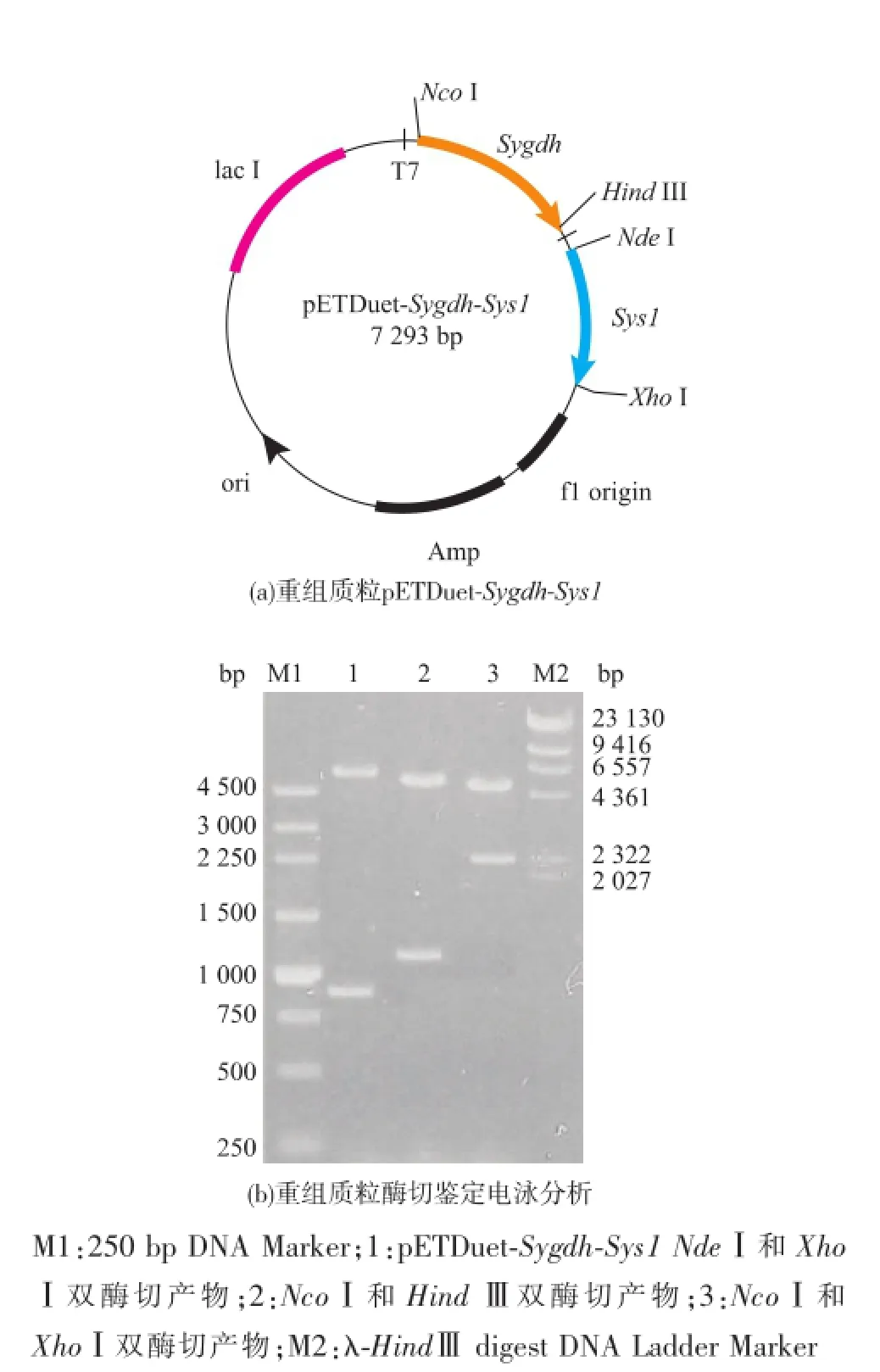
圖3 pETDuet-Sygdh-Sys1及其酶切產物電泳圖Fig.3 pETDuet-Sygdh-Sys1 and its digestion by NdeⅠ/ XhoⅠ,NcoⅠ/HindⅢand NcoⅠ/XhoⅠ,respectively
(葡萄糖脫氫酶)處有明顯的蛋白質條帶(圖4,泳道2)。結果表明Sygdh和Sys1基因在大腸桿菌中實現了高效表達。
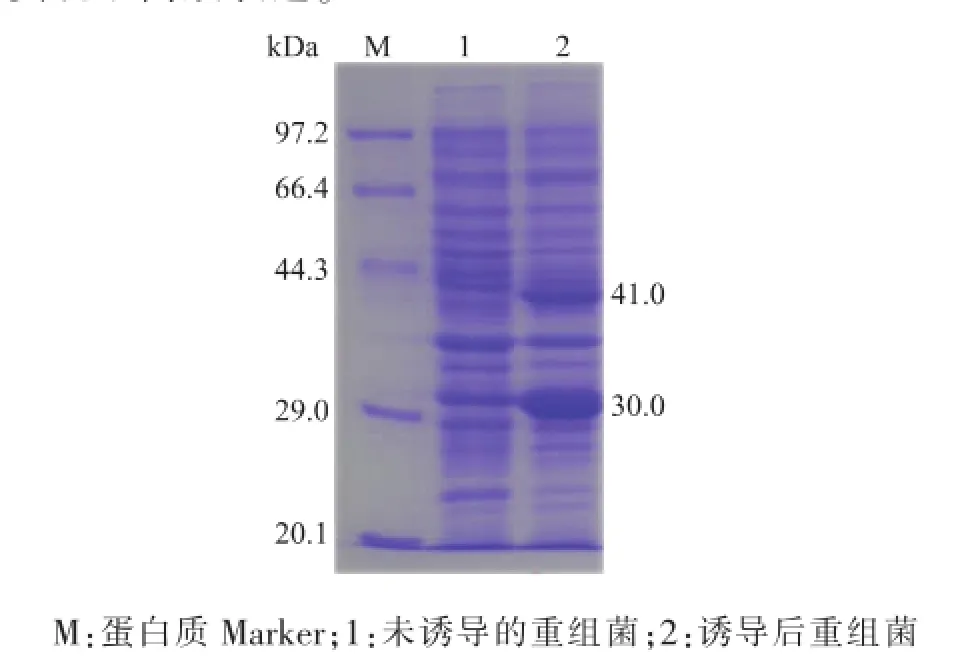
圖4 重組蛋白質的SDS-PAGE分析圖Fig.4 SDS-PAGE analysis of the recombinant proteins
2.3NADPH再生循環的驗證
利用重組菌做反應前,需要驗證輔酶再生的可能性。由表1反應體系1、2、3可知,葡萄糖脫氫酶成功完成輔酶的再生循環,且葡萄糖參與的體系3的產率是體系2的2.2倍。比較體系3、4、5的產率可知,NADP+和NADPH作用相當,由于NADPH的價格比較昂貴,用NADP+替代NADPH參與生物催化反應。

表1 不同反應體系分析輔酶再生Table 1 Analysis of cofactor regeneration with difference reaction systems
2.4重組菌催化條件的優化
2.4.1底物濃度對轉化反應的影響重組菌E.coli BL21/pETDuet-Sygdh-Sys1轉化體系中,底物m-CPC初始濃度為10~30 mmol/L時,產物(R)-CCE的產率變化不大,如圖5所示。當底物濃度高于30 mmol/L時,產物的產率開始降低,這可能是由于過高的底物濃度使酶的活性中心飽和,從而造成酶的催化效率下降,但這個反應過程中e.e.值并不因受底物濃度的改變而改變。
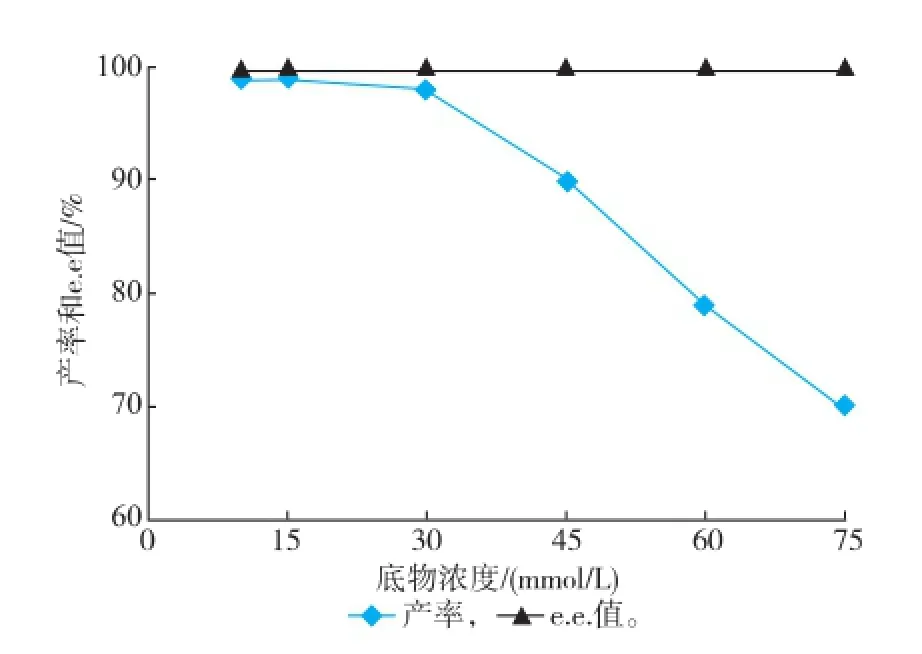
圖5 底物m-CPC初始濃度對轉化反應的影響Fig.5 Effectofinitialsubstrateconcentrationon biotransformation reaction
2.4.2菌體濃度對轉化反應的影響由圖6可知,當底物初始濃度為30 mmol/L、菌體濕質量濃度為50~70 mg/mL時,摩爾產率隨細胞質量濃度的增加而增大;當細胞質量濃度為70、80、90、100 mg/mL時,得率分別為99.2%、99.6%、99.6%、99.8%,基本不變。可能是在一定范圍內,菌體質量濃度增加導致參加催化反應的細胞內酶分子數增加,可提供給底物分子的活性結合位點增加,因而反應體系的催化效率明顯提高。

圖6 菌體質量濃度對轉化反應的影響Fig.6 Effect of cell concentration on biotransformation reaction
2.4.3葡萄糖和輔酶濃度對反應的影響葡萄糖作為輔助底物參與輔酶的循環,在底物濃度30 mmol/L,菌體濕質量濃度70 mg/mL,葡萄糖濃度10~40 mmol/L時,產率隨著葡萄糖濃度的增加而增加。當葡萄糖濃度超過40 mmol/L后產率基本不變,見圖7(a)。輔酶(NADP+)理論上只需一點啟動反應后,在葡萄糖脫氫酶的作用下就可以驅動輔酶作循環,完成生物催化反應,圖7(b)表明0.2 mmol/L輔酶(NADP+)就能夠完成底物99.0%的轉化率。
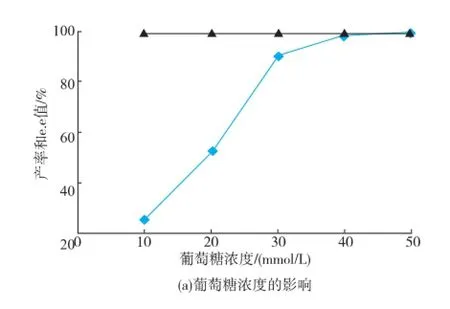

圖7 葡萄糖和輔酶濃度對轉化反應的影響Fig.7 Effect of glucose and NADP+concentrations on biotransformation reaction
2.4.4反應時間對反應的影響由圖8可知,在底物濃度、濕菌體質量濃度、葡萄糖濃度、輔酶濃度、pH值和反應溫度分別為30 mmol/L、70 mg/mL、40 mmol/L、0.2 mmol/L、7.0、40℃時,雙酶體系中的摩爾產率在30~90 min內增加較快,90~180 min內產率增加較慢,而180 min后基本不變,摩爾產率可達到99%,此時反應時間由之前的6 h縮短到3 h,整個過程中e.e.值一直保持100%不變。
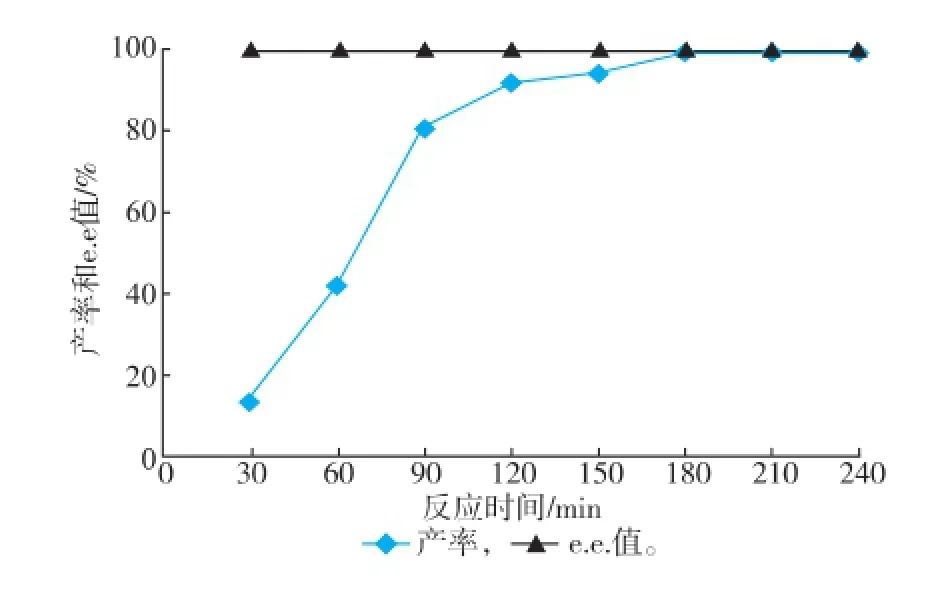
圖8 反應時間對轉化反應的影響Fig.8 Effect of reaction time on biotransformation reaction
3 結語
由于(R)-CCE是重要的藥物中間體,將密碼子優化后的羰基還原酶基因Sys1和葡萄糖脫氫酶基因Sygdh構建雙酶共表達重組菌E.coli BL21/ pETDuet-Sygdh-Sys1,并作為生物催化劑。研究了反應條件對合成(R)-CCE效率的影響。研究結果表明,在底物30 mmol/L、菌體70 mg/mL、葡萄糖40 mmol/L、輔酶0.2 mmol/L、pH 7.0、反應溫度40℃、反應時間3 h條件下,合成產物(R)-CCE的摩爾產率達99.0%,e.e.值可達100%。同時本研究工作也為生物催化解決輔酶再生問題奠定了良好的基礎。
[1]郁惠蕾,黃磊,倪燕,等.羰基生物還原法合成手性醇的研究進展[J].生物加工過程,2013,11(3):71-82. YU Huilei,HUANG Lei,NI Yan,et al.Advances in synthesis of chiral alcohols by carbonyl bioreduction[J].Chinese Journal of Bioprocess Engineering,2013,11(3):71-82.(in Chinese)
[2]Harada H,Hirokawa Y,Suzuki K,et al.Novel and potent human and rat β3-adrenergic receptor agonists containing substituted 3-indolylalkylamines[J].Bioorganic&Medicinal Chemistry Letters,2003,13(7):1301-1305.
[3]Devocelle M,Mortreux A,Agbossou F,et al.Alternative synthesis of the chiral atypical β-adrenergic phenylethanolaminotetraline agonist SR58611A using enantioselective hydrogenation[J].Tetrahedron Letters,1999,40(24):4551-4554.
[4]兒玉浩宣,本河卓也,山口博志,等.2-鹵代-1-(取代苯基)乙醇的生產:中國,CN1063422C[P].2001-03-21.
[5]Ohkuma T,Tsutsumi K,Utsumi N,et al.Asymmetric hydrogenation of α-chloroaromatic ketones catalyzed by η6-arene/ TsDPEN-ruthenium(II)complexes[J].Organic Letters,2007,9(2):255-257.
[6]Thayer A.Removing impurities:Metal scavengers and immobilized catalysts may make for cleaner pharmaceutical products[J]. Chemical&Engineering News,2005,83(36):55-58.
[7]Xia S W,Lin H,Chen Y Z.Preparation of(R)-2-chloro-1-(m-chlorophenyl)ethanol by Lipozyme TL IM-catalyzed second resolution[J].Chinese Chemical Letters,2012,23(3):289-292.
[8]Lin H,Chen Y Z,Xu X Y,et al.Preparation of key intermediates of adrenergic receptor agonists:Highly enantioselective production of(R)-α-halohydrins with Saccharomyces cerevisiae CGMCC 2.396[J].Journal of Molecular Catalysis B:Enzymatic,2009,57:1-5.
[9]Ni Y,Zhang B H,Sun Z H.Efficient synthesis of(R)-2-chloro-1-(3-chlorophenyl)ethanol by permeabilized whole cells of Candida ontarioensis[J].Chinese Journal of Catalysis,2012,33(4):681-687.
[10]Zhu D M,Yang Y,Hua L.Stereoselective enzymatic synthesis of chiral alcohols with the use of a carbonyl reductase from Candida magnoliae with anti-Prelog enantioselectivity[J].Journal of Organic Chemistry,2006,71(11):4202-4205.
[11]余濤,胡蝶,鄔敏辰,等.重組葡萄糖脫氫酶的酶學性質及其偶聯輔酶再生[J].食品與生物技術學報,2014,33(9):910-916. YU Tao,HU Die,WU Minchen,et al.Enzymatic characterization and coenzyme regeneration of a recombinant glucose 1-dehydrogenase[J].Journal of Food Science and Biotechnology,2014,33(9):910-916.(in Chinese)
[12]金光澤,段作營,張蓮芬,等.重組融合人血清白蛋白-人白介素-2C125A突變體在畢赤酵母中的表達[J].食品與生物技術學報,2010,29(4):595-601. JIN Guangze,DUAN Zuoying,ZHANG Lianfen,et al.Expression of the fusion protein human serum albu/mutant human interleukin 2C125A in Pichia pastoris[J].Journal of Food Science and Biotechnology,2010,29(4):595-601.(in Chinese)
Efficient Preparation of(R)-2-Chloro-1-(3-Chlorophenyl)Ethanol by a Double Enzyme System
ZHU Lijuan1,YU Tao1,GU Ying2,YANG Biao2,WU Minchen*2
(1.School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China;2.Wuxi Medical School,Jiangnan University,Wuxi 214122,China)
A codon-optimized gene Sys1,which encodes a carbonyl reductase,was synthesized,and cloned into an expression plasmid pETDuet-1 with double promoters together with a glucose dehydrogenase-encoding gene Sygdh.The recombinant E.coli BL21/pETDuet-Sygdh-Sys1,expressing the carbonyl reductase and the glucose dehydrogenase together,was constructed by transforming the recombinant plasmid,pETDuet-Sygdh-Sys1,into E.coli BL21(DE3).Using recombinant E.coli cells induced by IPTG as biocatalysts,(R)-2-chloro-1-(3-chlorophenyl)ethanol((R)-CCE),achiraldrugintermediate,wassynthesizedbyasymmetricallyreducingmchlorophenacylchloride(m-CPC).Underthereactionconditionsof30mmol/Lofm-CPC,70mg/mLof wetrecombinant E.colicells,40mmol/Lofglucose,0.2 mmol/LofNADP+at pH7.0 and 40℃for 3 h,themolaryieldof(R)-CCEreached99.0%withanenantiomericexcess(e.e.)valueof100%.
double enzyme system,carbonyl reductase,glucose dehydrogenase,coexpression,(R)-2-chloro-1-(3-chlorophenyl)ethanol
Q 814.9
A
1673—1689(2016)03—0278—06
2014-12-12
國家自然科學基金項目(31271811)。
鄔敏辰(1962—),男,江蘇無錫人,理學博士,教授,博士研究生導師,主要從事酶工程與基因工程研究。
E-mail:bioch@163.com

