α-硫辛酸對腦缺血再灌注大鼠細胞凋亡的抑制作用及其機制
高路燕,王洪新,董銀華,梁佩芬,趙嵐,范宏光
(天津市第四中心醫院,天津300000)
?
α-硫辛酸對腦缺血再灌注大鼠細胞凋亡的抑制作用及其機制
高路燕,王洪新,董銀華,梁佩芬,趙嵐,范宏光
(天津市第四中心醫院,天津300000)
目的探討α-硫辛酸對大鼠腦缺血再灌注損傷后細胞凋亡的抑制作用及其機制。方法 取健康雄性Wistar大鼠45只,隨機分為假手術組、模型組、α-硫辛酸組各15只,采用線栓法制作大腦中動脈缺血再灌注損傷模型,TUNEL法測算細胞凋亡指數(AI);免疫組織化學法和Western blotting法檢測各組細胞色素C(CtyC)、Bcl-2、Bax蛋白表達。結果與假手術組比較,模型組及α-硫辛酸組AI均升高,CtyC、Bcl-2、Bax陽性細胞百分比及其表達均升高(P均<0.05);與6 h比較,α-硫辛酸組24、72 h AI均升高(P均<0.05)。與模型組比較,α-硫辛酸組各時間AI均降低(P均<0.05),CtyC及Bax蛋白陽性細胞百分比及其表達降低,而Bcl-2蛋白表達增高(P均<0.05)。結論 α-硫辛酸對大鼠腦缺血再灌注損傷后細胞凋亡有抑制作用,其機制可能與降低CtyC及Bax蛋白表達,提高Bcl-2蛋白表達有關。
腦缺血再灌注損傷;α-硫辛酸;細胞色素C;Bcl-2蛋白;Bax蛋白;大鼠
腦缺血再灌注損傷是治療缺血性腦病常見的并發癥,可造成腦組織的二次損傷,對患者腦組織功能的恢復產生嚴重影響。研究表明,氧化應激是腦缺血再灌注損傷、細胞凋亡的重要機制[1],細胞凋亡與細胞色素C(CtyC)及Bcl-2家族基因有關。α-硫辛酸是否可以通過抗氧化機制,并影響Bcl-2及Bax而抑制腦缺血再灌注后細胞凋亡,尚未見文獻報道。2013年8月~2015年6月,我們觀察了α-硫辛酸對大鼠腦缺血再灌注損傷后細胞凋亡的影響及CtyC、Bcl-2、Bax表達的變化。
1 材料與方法
1.1材料健康雄性Wistar大鼠(SPF級別)45只,體質量220~240 g,由中國人民解放軍醫學科學實驗動物中心提供。TUNEL凋亡試劑盒(美國羅氏公司),兔抗鼠CtyC、Bcl-2、Bax抗體(Abcam 公司,美國);α-硫辛酸(德國史達德大藥廠生產);免疫組化試劑盒(北京博奧森);BCA蛋白定量試劑盒(江蘇碧云天);低溫冷凍離心機(北京奧博通光學儀器有限公司);顯微鏡及圖像處理系統(天津醫科大學);凝膠圖像分析系統(JD-801 江蘇捷達)。
1.2局灶性腦缺血再灌注模型制作及分組將45只大鼠隨機分為假手術組、模型組和α-硫辛酸組,每組各15只。將動物置于實驗室適應環境1周,自由進食水,室溫(24±2)℃,自然光照,術前禁食12 h,參照Zea-Longa法制作大鼠大腦中動脈缺血再灌注損傷模型,尼龍線直徑0.24 mm,線段頭端燒制成光滑、大小一致的球狀。大鼠稱重后以10%水合氯醛按300 mg/kg腹腔注射麻醉,沿頸前正中切開皮膚,分離出右側頸總動脈、頸外動脈和頸內動脈。頸總動脈近心端以手術線結扎,用眼科剪在結扎線遠端剪一小口,將尼龍線插入頸內動脈達大腦中動脈,深度18~20 mm,栓線的血管外部分結扎固定,2 h后拔除線栓,實現再灌注。假手術組結扎動脈但不插入栓線。α-硫辛酸組在腦缺血再灌注后2 h按70 mg/kg腹腔注射α-硫辛酸藥物;模型組給予相應體積生理鹽水;假手術組不給藥。因任何原因造成死亡的大鼠剔除。
1.3細胞凋亡指數(AI)的測算采用TUNEL法。每組大鼠分別于腦缺血再灌注后各個時間點斷頭取腦,4% 2,3,5-氯化三苯基四氮唑磷酸鹽緩沖液固定過夜,轉放入30%蔗糖中脫水,4 ℃存放,用梯度乙醇脫水,包埋切片。顯微鏡觀察切片:正常細胞胞核呈藍色,細胞核中顯示有棕黃色顆粒的為TUNEL陽性細胞,即凋亡細胞。每張切片在顯微鏡下隨機選取5個不重疊的高倍鏡視野(400×),計算凋亡細胞數和細胞總數,然后計算AI,AI=凋亡細胞數/細胞總數×100%。
1.4CtyC、Bcl-2及Bax蛋白表達檢測①CtyC、Bcl-2、Bax陽性細胞率:采用免疫組織化學法。取石蠟切片脫蠟,蒸餾水洗,按照說明書分別進行CtyC、Bcl-2、Bax免疫組織化學染色,光鏡下觀察胞質有棕色顆粒者為陽性細胞。部分切片不加一抗,用0.01 mmol/L PBS代替,作為陰性對照組。在光鏡視野下,隨機選取5個梗死邊緣區視野,計數CtyC、Bcl-2、Bax陽性細胞數,計算細胞陽性率。② CtyC、Bcl-2及Bax蛋白相對表達量:采用Western blotting法。各組大鼠于再灌注6、24、72 h斷頭取腦,-80 ℃保存,取缺血側皮質100 mg,加入細胞裂解液中,4 ℃、1 200 r/min離心20 min,檢測蛋白量。取等蛋白樣品,用10% SDS-PAGE電泳分離蛋白質,轉移至硝酸纖維素膜,用10%脫脂牛奶封閉1 h后加入兔抗鼠CtyC、Bcl-2及Bax抗體,4 ℃孵育過夜,TEST洗膜3次,每次12 min,加入二抗后室溫孵育,洗膜,顯色液中顯色,曝光后保存圖片,以β-actin為內參,應用凝膠圖像分析系統軟件對蛋白條帶進行灰度掃描,測定其灰度值,計算CtyC與內參β-actin的比值、Bcl-2與Bax的比值。
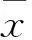
2 結果
2.1各組不同時點AI比較假手術組凋亡細胞很少出現;與假手術組相比,模型組于6 h即出現凋亡細胞明顯增多,胞核呈棕黃色,固縮深染,至24 h細胞最多。各組不同時點AI比較見表1。

表1 各組不同時點AI比較
注:與假手術組相比,#P<0.05;與模型組相比,*P<0.05;與同組6 h比較,ΔP<0.05 。
2.2 各組CtyC、Bcl-2、Bax蛋白陽性細胞率及其相對表達量比較見表2、3。

表2 各組不同時點CtyC、Bcl-2、Bax蛋白陽性細胞率比較
注:與假手術組相比,#P<0.05;與模型組相比,*P<0.05。
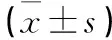
表3 各組不同時點CtyC、Bcl-2及Bax蛋白相對表達量及Bcl-2/Bax比較
注:與假手術組同時間相比,#P<0.05;與模型組同時間相比,*P<0.05。
3 討論
諸多研究顯示,氧化應激是腦缺血再灌注損傷的重要機制,在大腦組織缺血受損后,組織細胞啟動凋亡程序和抑制凋亡程序,其代表的典型基因如Bcl-2家族中的成員及線粒體CtyC,包括促細胞凋亡的Bax和抑制細胞凋亡的Bcl-2,其中Bax可形成同源二聚體,參與組成線粒體膜上的活化離子通道,使得CtyC由此穿過線粒體膜而到達細胞質內,與細胞質內的相關蛋白結合形成凋亡啟動復合體,激活Caspase主導的級聯反應,最終破壞細胞內DNA及蛋白成分,導致細胞凋亡[2]。而Bcl-2作為抗凋亡成員,可與Bax競爭結合,按1∶1方式結合形成異源二聚體,從而滅活線粒體膜上的離子通道,阻止CtyC進入細胞質,最終抑制細胞凋亡。相關研究[3]已證實Bcl-2與Bax的比值較高,提示細胞在受生存信號調節,反之在受凋亡信號調節。
α-硫辛酸屬于硫醇類化合物,是一種強力抗氧化劑,兼具有水溶性和脂溶性,可高濃度存在于細胞內外,具有清除活性氧自由基的能力,是人體不可缺少的抗氧化劑,目前主要應用于糖尿病周圍神經病變的治療。有研究[4]提出α-硫辛酸可減輕H2O2誘導的神經細胞氧化應激損傷,對腦缺血損傷亦具有保護作用。
本研究結果顯示,模型組腦缺血再灌注6 h即出現神經細胞凋亡,24 h達到最大,72 h后稍有改善,當用α-硫辛酸預處理6 h后,小鼠AI較模型組降低,說明α-硫辛酸早期即有抑制腦組織細胞凋亡作用,與何明利等[5]研究一致。
將各組腦組織進行CtyC、Bcl-2及Bax免疫組織化學染色,發現正常腦組織中均有少量CtyC、Bcl-2及Bax陽性細胞,結合Western blotting檢測結果,說明正常腦組織均有少量CtyC、Bcl-2及Bax表達,維持正常的組織功能。腦缺血再灌注6 h后上述蛋白表達有明顯升高,24后達到高峰,其中Bax較Bcl-2增高更多,即Bcl-2/Bax值越來越小,提示促細胞凋亡作用占主導優勢。當用α-硫辛酸干預后,Bcl-2表達進一步增高,而CtyC與Bax表達減低,通過上調Bcl-2/Bax值逆轉促凋亡作用為抗凋亡作用,增多的Bcl-2-Bax二聚體抑制線粒體膜上的CtyC轉移到胞質內,抑制細胞凋亡。說明α-硫辛酸可通過抗氧化應激作用,提高Bcl-2表達,抑制CtyC及Bax表達,提高Bcl-2/Bax值,從而減少腦缺血再灌注引起的細胞凋亡,減少梗死體積,降低神經功能損傷。
有研究[6~8]發現,黃芪、三七、黃芩及低溫聯合硫化氫均可一定程度改善腦缺血再灌注損傷引起的細胞凋亡,保護腦組織,但作用機制不盡相同。α-硫辛酸對于腦缺血再灌注損傷的保護作用較上述藥物有無優勢,尚需進一步研究。
[1] 王釗.氧化應激與腦缺血-再灌注損傷[J].國際病理科學與臨床雜志,2012,32(4):343-346.
[2] Burguillos MA, Hajji N, Englund E, et al. Apoptosis-inducing factor mediates dopaminergic cell death in response to LPS-induced inflammatory stimulus evidence in Parkinson′s disease patients[J]. Neurobiol Dis, 2011,41(1):177-188.
[3] Lalier L, Cartron PF, Juin P, et al. Bax action and mitochondrial insertion during apoptosis[J]. Apoptosis, 2007,12(5):887-896.
[4] 施紅敏,韋晟.α-硫辛酸注射液對過氧化氫致PC12細胞損傷的保護作用[J].中國臨床藥理學雜志,2011,27(6):450-453.
[5] 何明利,陳曼娥,王景周.鼠腦缺血性損傷程度與缺血時間的關系研究[J].臨床神經病學雜志,2000,13(1):13-15.
[6] Zheng WX, Cao XL, Wang F, et al. Baicalin inhibiting cerebral ischemia /hypoxia-induced neuronal apoptosis via MRTF-A-mediated transactivity[J]. Eur J Pharmacol, 2015,767(15):201-210.
[7] Huang XP, Huang D, Lu JD, et al. Effects of the combination of the main active components of astragalus and panax notoginseng on inflammation and apoptosis of nerve cell after cerebral ischemia-reperfusion[J]. Am J Chin Med, 2015,43(7):1-20.
[8] Dai HB, Xu MM, Lv J, et al. Mild hypothermia combined with hydrogen sulfide treatment during resuscitation reduces hippocampal neuron apoptosis via NR2A, NR2B, and PI3K-Akt signaling in a rat model of cerebral ischemia-reperfusion injury[J]. Mol Neurobiol, 2015,56(9):1-9.
10.3969/j.issn.1002-266X.2016.29.011
R749.1
A
1002-266X(2016)29-0034-03
2016-02-02)

