異體羊膜間充質干細胞移植治療初發1型糖尿病的安全性和有效性
張新, 徐亮, 周玉紅,白云
(遼河油田總醫院, 遼寧盤錦 1240102)
?
異體羊膜間充質干細胞移植治療初發1型糖尿病的安全性和有效性
張新, 徐亮, 周玉紅,白云
(遼河油田總醫院, 遼寧盤錦 1240102)
目的 對初發1型糖尿病患者進行異體羊膜間充質干細胞(ADMSCs)移植治療,評估該方法的安全有效性。方法 培養ADMSCs,并對細胞生物活性進行鑒定。將符合納入標準的33例患者隨機分為對照組17例和治療組16例,對照組接受常規治療,治療組接受ADMSCs移植聯合常規治療。檢測患者治療前和治療后6、12、24個月的空腹C肽(FC-P)、空腹血糖(FPG)、餐后2 h血糖(2 h PG)、FC-P與血糖比值(CPGR)、糖化血紅蛋白(HbA1c)和胰島素,并觀察不良反應情況。結果 培養的ADMSCs生物活性良好,符合臨床應用標準。治療后6個月,治療組除FC-P外其余各項觀察指標與治療前相比差異均有統計學意義(P均<0.05);且治療組2 h PG和胰島素與對照組相比明顯減少(P均<0.05)。治療后12個月,治療組除HbA1c外其余各項觀察指標與該組治療前相比差異均有統計學意義(P均<0.05);治療組各項觀察指標與對照組相比,除FPG外差異均具有統計學意義(P均<0.05)。治療后24個月,對照組FPG與治療前相比明顯降低,HbA1c和胰島素明顯升高(P均<0.05);治療組各項觀察指標與治療前相比差異均具有統計學意義(P均<0.05);治療組各項觀察指標與對照組相比,除FPG外差異均具有統計學意義(P均<0.01)。治療組在干細胞治療過程中無明顯不良反應。結論 ADMSCs移植可以有效治療初發1型糖尿病,且安全性好。
1型糖尿病;異體羊膜間充質干細胞;移植;安全性;有效性
1型糖尿病是由T細胞介導的胰島β細胞選擇性破壞導致的器官特異性自身免疫病[1]。1型糖尿病的發病過程是隱匿性的,待到臨床確診時已經有60%~80%的胰島細胞團被破壞,因此保護胰島細胞是治療1型糖尿病的首要目標[2,3]。目前臨床上的主要治療方式為使用胰島素注射或結合免疫抑制劑,但這種治療方式不能很好地保護患者的胰島功能和延緩并發癥的發生[4]。研究證明,采用低免疫源性的間充質干細胞移植方法治療1型糖尿病,可通過調節胰島的自身免疫反應,誘導胰島細胞再生,恢復患者的胰島功能[3~5]。2012年1月~2014年1月,本研究對初發1型糖尿病患者進行異體羊膜間充質干細胞(ADMSCs)移植,取得較好療效。現報告如下。
1 資料與方法
1.1 臨床資料初發1型糖尿病患者33例,符合1999年WHO對糖尿病的診斷和分型標準。男19例、女14例,年齡13~35歲,病程小于1年。排除患有腫瘤等惡性消耗性疾病;嚴重肝腎等功能不全;合并其他內分泌系統疾病;有精神疾病或依從性差等影響試驗完成者;HIV、HBV等感染;妊娠或哺乳期婦女;超敏體質者。隨機分為對照組和治療組。治療組男9例、女7例,年齡(22.1±6.6)歲,病程(3.5±2.9)個月,BMI(20.8±1.9)kg/m2,糖尿病酮癥酸中毒(DKA)10例(62.5%),谷氨酸脫羥酶抗體(GADA)陽性11例(68.8%);對照組男10例、女7例,年齡(21.6±6.8)歲,病程(3.7±5.5)個月,BMI(21.1±1.9)kg/m2,DKA 11例(64.7%),GADA陽性12例(70.6)。兩組性別、年齡、病程、BMI、DKA發生率和GADA陽性率相比差異均無統計學意義(P均>0.05)。
1.2ADMSCs制備、生物活性鑒定 ADMSCs的制備:取健康足月胎兒羊膜,用鹽水洗凈后剪碎,使用Ⅰ型膠原酶(Gibco)消化后離心。再將收集到的單核細胞使用無血清培養液(Gibco)貼壁培養,每隔48 h換液,待細胞達到80%至90%融合時按1∶3進行傳代。經膠原酶消化法得到的細胞接種12 h后可逐漸出現貼壁細胞,2~3 d后貼壁的細胞逐漸增多,且貼壁的細胞伸展成長梭形。接種3 d后棄去未貼壁的紅細胞,剩余貼壁的細胞主要為ADMSCs。1周后培養瓶中的細胞為成纖維細胞樣,散在生長,少部分呈集落狀。傳代培養的ADMSCs增殖能力強,形態更趨于一致、排列整齊,為旋渦狀魚群樣排列。生物活性鑒定:將狀態較好的第4代ADMSCs種于96孔板中,在種板后第1、2、3、5、7天使用MTT法檢測細胞活性,之后繪制細胞生長曲線。從生長曲線中可以看出,ADMSCs細胞在種板后2 d內處在潛伏期,在第3~5天處在對數生長期,在第5~7天進入平臺期,此時細胞增殖速度減慢。因此建議ADMSCs傳代周期應該為5 d。用成脂和成軟骨誘導液誘導培養后,分別用油紅O和阿爾新蘭染色,之后使用光鏡拍照。結果顯示,ADMSCs成脂誘導10~14 d后,細胞從長梭形逐漸變為較圓的多角形,并且細胞內出現光鏡下可見的小脂滴呈葡萄狀,隨著誘導時間的延長,脂滴逐漸融合增大,油紅O染色后顯紅色。成軟骨誘導16~20 d后,細胞可被阿爾新蘭染成藍色。經檢測第4代的ADMSCs細胞呈CD90、CD73、CD105陽性,且陽性率高于97%;呈CD34、CD45和HLA-DR陰性,并且陰性率低于2%。經臺盼蘭染色檢測,用于移植的ADMSCs細胞的成活率均高于96%。經鱟試劑法檢測,用于移植的ADMSCs細胞的內毒素均低于5 EU/mL。
1.3治療方法對照組行常規治療,每日監測血糖至少4次,根據血糖水平調整飲食和運動方案,規律使用胰島素,年齡較大者可增加二甲雙胍和葡萄糖苷酶抑制類藥物。治療組在常規治療基礎上進行ADMSCs移植。將第5至第8代細胞用無動物源成分的胰酶(Gibco)消化成單細胞懸液,離心后用生理鹽水重懸,按1×107/kg體質量進行靜脈回輸,患者移植后留院觀察4 h以上。
1.4主要觀察指標記錄移植前患者的性別、年齡、病程、身高、體質量、有無DKA和GADA陽性情況。移植前和移植后6、12、24個月檢測患者的空腹C肽(FC-P)、空腹血糖(FPG)、餐后2 h血糖(2 h PG)、FC-P與血糖比值(CPGR)、糖化血紅蛋白(HbA1c)、胰島素(Insulin)。記錄移植后和隨訪過程中患者的不良反應。

2 結果
2.1兩組不同時間FC-P、FPG、2 h PG、CPGR、HbA1c、Insulin比較見表1。
2.2不良反應在治療和隨訪過程中,患者未出現高熱、感染等過敏反應或其他嚴重不良反應。
3 討論
1型糖尿病患者的胰島功能嚴重受損,自身分泌能力下降決定了其只能依靠外源性的胰島素控制血糖,而以這種方式控制血糖會造成血糖較大幅度的波動,進而損傷患者機體其他器官功能[6]。1型糖尿病的患者年齡大多小于35歲,終生需要使用胰島素治療,嚴重影響患者的生活質量,因此迫切需要能恢復胰島功能的新治療方式出現。近年來,間充質干細胞以其較好的臨床研究效果越來越受到人們的關注。間充質干細胞是一類具有自我更新和多向分化能力的成體干細胞。它具有較強的免疫調節功能,可抑制反應性T淋巴細胞的增殖,減少T細胞對胰島β細胞的損傷作用[5],還可通過使Th1向Th2細胞轉化,增加調節性T細胞的數量[7]等途徑誘導1型糖尿病患者機體的免疫耐受。本研究通過使用較易采集培養,分化和增殖能力較強的ADMSCs移植治療1型糖尿病,評估ADMSCs治療1型糖尿病的臨床療效和安全性,為臨床應用提供依據。
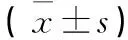
表1 兩組不同時間FC-P、FPG、2 h PG、CPGR、HbA1c、Insulin比較
注:與本組治療前相比,#P<0.05,##P<0.01;與對照組同時間相比,*P<0.05,**P<0.01。
1型糖尿病主要病理機制是T細胞介導的自身免疫性疾病,主要特征是胰島β細胞被破壞,從而導致胰島素分泌不足,因此阻止患者胰島的自身免疫反應,同時最大程度地恢復胰島功能,是治療1型糖尿病的理想方案。總結以往的研究得出間充質干細胞治療1型糖尿病可能主要通過以下機制:①調節機體免疫功能,保護未受損的胰島細胞[7];②促進體內胰島β細胞的再生;③誘導胰腺干細胞分化為胰島β細胞[8];④分化為胰島樣細胞等。目前,間充質干細胞治療1型糖尿病的具體機制還需進一步探索研究。
本文中ADMSCs的細胞表型、成活率、內毒素的檢測結果說明培養的ADMSCs具有較好的生物學活性,并且無菌、無支原體,符合成體干細胞的臨床應用標準。本研究利用間充質干細胞的“歸巢”特性,使用經靜脈回輸的方法,期望能獲得Hu等[5]研究中臍帶間充質干細胞在較長時間內促進胰島β細胞功能恢復的臨床效果。結果顯示,在1型糖尿病患者的血糖控制方面,ADMSCs聯合常規治療與僅使用常規治療相比優勢明顯。對照組和治療組患者的HbA1c、FC-P和CPGR的變化表明ADMSCs聯合常規治療能明顯促進患者胰島β細胞分泌功能的恢復。以上結果說明,ADMSCs移植可有效治療1型糖尿病。在治療和隨訪過程中未發現與細胞移植相關的嚴重不良反應,說明ADMSCs移植治療1型糖尿病安全性好。
由于本研究納入的患者例數有限,隨訪時間不夠長,因此ADMSCS治療初發1型糖尿病的療效和安全性還需大樣本臨床試驗進行驗證。
[1] Luce S, Briet C, Bécourt C, et al. The targeting of β-cells by T lymphocytes in human type 1 diabetes: clinical perspectives[J]. Diabetes Obes Metab, 2013,15(Suppl 3):89-97.
[2] Chen W, Xie A, Chan L. Mechanistic basis of immunotherapies for type 1 diabetes mellitus[J]. Transl Res, 2013,161(4): 217-229.
[3] 顧衛瓊,孫首悅,胡炯,等.自體造血干細胞移植治療1型糖尿病的療效和安全性評價[J].中華內分泌代謝雜志,2010,26(12):1023-1026.
[4] 于文龍,高宏,余霄龍,等.臍帶間充質干細胞移植治療初發1型糖尿病[J].中國組織工程與臨床康復,2011,15(23):4363-4366.
[5] Hu J, Yu X, Wang Z, et al. Long term effects of the implantation of Wharton′s jelly-derived mesenchymal stem cells from the umbilical cord for newly-onset type 1 diabetes mellitus [J]. Endocr J, 2013,60(3):347-357.
[6] 李莉蓉,沈山梅,上官海燕,等.自體外周造血干細胞移植治療初發1型糖尿病的療效和安全性[J].中國糖尿病雜志,2010,18(10):745-748.
[7] Ezquer F, Ezquer M, Contador D, et al. The antidiabetic effect of mesenchymal stem cells is unrelated to their transdifferentiation potential but to their capability to restore Th1/Th2 balance and to modify the pancreatic microenvironment[J]. Stem Cells, 2012,30(8):1664-1674.
[8] Thakkar UG, Trivedi HL, Vanikar AV, et al. Insulin-secreting adipose-derived mesenchymal stromal cells with bone marrow-derived hematopoietic stem cells from autologous and allogenic sources for type 1 diabetes mellitus[J]. Cytotherapy, 2015,17(7):940-947.
10.3969/j.issn.1002-266X.2016.29.015
R587.1
B
1002-266X(2016)29-0044-03
2015-11-05)

