普洱茶茶褐素對大鼠尿液影響的代謝組學研究
劉建,彭春秀,盛軍,高斌,龔加順*
?
普洱茶茶褐素對大鼠尿液影響的代謝組學研究
劉建1,彭春秀2,盛軍1,高斌1,龔加順1*
1. 云南農業大學食品科學技術學院,云南昆明 650201;2. 云南農業大學園林園藝學院,云南昆明 650201
本研究采用核磁共振(NMR)代謝組學法研究普洱茶茶褐素(TB,分子量>50?kDa)對大鼠尿液代謝的影響。將實驗大鼠分為正常對照組、正常+TB組、高脂組和高脂+TB組,以生物核磁共振技術結合正交偏最小二乘-判別分析(OPLS-DA)研究灌胃高劑量普洱茶茶褐素后大鼠尿液內源性代謝物的變化。結果表明,正常+TB組與正常對照組,高脂+TB組與高脂組的尿液代謝譜有明顯差異;篩選出纈氨酸、檸檬酸、牛磺酸、丙酸鹽、α-酮戊二酸、β-羥基丁酸等6種普洱茶茶褐素標志性代謝物;普洱茶茶褐素對大鼠尿液的影響可能涉及到氨基酸代謝、能量代謝、三羧酸循環、脂類代謝和氧化應激反應。
茶褐素;代謝組學;核磁共振
普洱茶是以云南大葉種茶樹的鮮葉經殺青、揉捻、日曬等工序制成的曬青綠毛茶為原料,再經發酵、蒸壓、成型工藝制成的各種形狀的成品茶[1]。研究表明,普洱茶有較為明顯的降脂、降糖、防止動脈硬化等功效[2-4]。普洱茶中主要功能活性來源于茶多酚以及茶色素,茶色素可以分為茶黃素、茶紅素和茶褐素,其中以茶褐素的含量最高,可達17%[5-6]。目前公認茶褐素是一類分子差異極大的復雜的高聚合物,不溶于氯仿、乙酸乙酯以及正丁醇,且茶褐素中含有相當數量的蛋白質、糖類、酸類物質(包括羧酸基以及酚羥基)[7-8]。
茶褐素是普洱茶重要的活性物質,已有多篇文獻報道普洱茶茶褐素具有降脂減肥的功效[9-10]。陳婷等[11]研究表明,茶褐素能減少肝臟脂肪沉積,具有預防實驗動物脂肪肝形成的作用。與陳婷的研究結果相同,王秋萍等[12]以水提醇沉法制備紫娟普洱茶茶褐素飼喂大鼠,發現該茶褐素不僅能減少肝臟脂肪沉積,而且可以顯著抑制大鼠體重的增長速度。高斌等[13]研究發現,普洱茶茶褐素可顯著增強大鼠肝臟和附睪脂肪組織HSL活性及其mRNA的表達,對大鼠降血脂效果明顯。
普洱茶茶褐素如何在生物體內吸收、代謝以及發生降血脂功效等情況尚不清楚。代謝組學是一種系統研究生物體內代謝物的組學方法,可以從整體上把握生物體內源性代謝產物的變化及其發展規律,能夠全面、即時地反映機體的變化信息[14],以核磁共振(NMR)為基礎的代謝組分析技術已得到快速發展和較為廣泛的應用[15-16]。本文通過水提醇沉法提取普洱茶茶褐素并灌胃大鼠,采用基于1H-NMR的代謝組學技術,檢測不同組別的大鼠尿液內源性代謝物的變化,為研究普洱茶在體內的降血脂作用機制提供新的思路。
1 材料與方法
1.1 主要試劑和儀器
普洱茶(大益牌,一級茶),購自云南大益茶業集團有限公司;乙醇(純),D2O購自美國默克試劑公司,水為自制純凈水。MSC300超濾杯,上海靡速科技器材有限公司;FD-1PF真空冷凍干燥機,北京德天佑科技發展有限公司;RE-52A旋轉蒸發儀,上海亞榮儀器廠;AVANCE 500核磁共振儀,德國BRUKER公司;CT15RE冷凍離心機,日本HITACHI公司;-80℃冰箱,美國Thermo Scientific公司。
1.2 普洱茶茶褐素的制備
普洱茶茶褐素參考楊大鵬[17]、王秋萍等[12]的制備方法,具體如下:取茶樣加入10倍蒸餾水浸提2次(70℃,0.5?h),過濾后合并濾液、減壓濃縮(65℃,0.07?MPa),再加乙醇醇沉6?h [(濾液)∶(無水乙醇)=1∶4],離心(4?000?r·min-1, 20?min),收集沉淀,加蒸餾水溶解進行超濾(膜孔徑5?nm),最后將濾液真空冷凍干燥,得到普洱茶茶褐素(分子量>50?kDa)。
該茶褐素呈黑褐色,細沙狀小顆粒,易溶于水。通過600℃下的CP-GC-MS分析顯示,含N-類化合物:18.42%;有機烴類:18.18%;酯類:16.2%;酚類:12.63%;生物堿:9.41%;醇類:7.4%;呋喃類:7.2%;酸類:4.82%;酮類:1.82%;其他:3.92%。
1.3 灌胃劑量的確定
龔加順等[6]研究發現,受試物的LD50>10?g·kg-1(95%可信限),屬實際無毒級物質。根據敬明武等[18]報道,茶色素的人體推薦量為45?mg·kg-1。按《保健食品評價程序和檢驗方法》的要求,設高?中?低3個劑量組[19],其中1個劑量組是人體可能攝入量的5~10倍,最高不超過30倍。因此本實驗將人體推薦量的3倍設為低劑量,中、高劑量分別為人體推薦攝入量的9倍、27倍,即135?mg·kg-1、405?mg·kg-1、1215?mg·kg-1。最后本試驗采用高劑量即1215?mg·kg-1且分子量大于50?kDa的茶褐素。
1.4 動物分組和處理
基礎飼料由昆明醫學院動物實驗中心提供,配方為:玉米350?g·kg-1、麥麩250?g·kg-1、豆粕250?g·kg-1、魚粉?80g·kg-1、酵母20?g·kg-1、骨粉20?g·kg-1、乳清粉10?g·kg-1、鹽5?g·kg-1、菜油5?g·kg-1、礦物添加劑1?g·kg-1、復合維生素0.3?g·kg-1、蛋氨酸1.3?g·kg-1、賴氨酸0.7?g·kg-1和魚肝油0.5?g·kg-1;高脂飼料配方來源于《保健食品檢驗與評價技術規范》[19],配方為:基礎飼料78.8%、熟豬油10.0%、蛋黃粉10.0%、膽固醇1.0%、膽鹽0.2%。
實驗動物由昆明醫學院實驗動物中心提供(許可證號:SYXKX(滇2011-0004)),選擇健康成年雄性SD大鼠,體質量180~200?g。將20只大鼠置于簡易代謝籠中,室內保持12?h光照,12?h避光循環飼養,自由攝食,自由飲水。每天定時通風,環境溫度控制在(20±2)℃,濕度45%~60%。
所有大鼠飼喂基礎飼料1周以適應環境和飼喂方式,1周后根據大鼠體質量水平,隨機分為4組,每組5只大鼠,分別為正常對照組、正常+TB組、高脂組、高脂+TB組。適應期結束后進入為期14?d的干預期,前兩組給予基礎飼料,后兩組給予高脂飼料。其中,正常+TB組和高脂+TB組按照設計劑量每日經口灌胃茶褐素,其他組別均給予相同劑量蒸餾水灌胃。具體分組見表1。
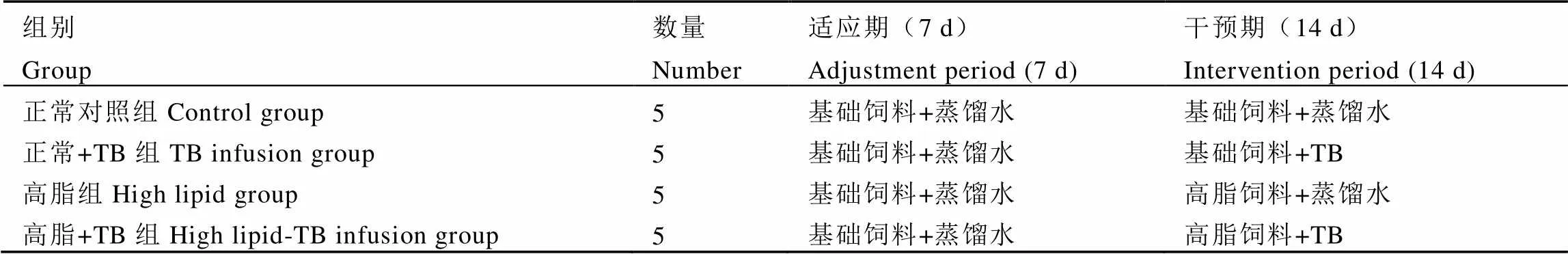
表1 試驗大鼠組別設計
干預期14?d結束時,收集每只大鼠第14天24?h內的尿液,3?000?r·min-1低速離心15?min,用移液槍吸取上層尿液分裝于離心管中并放入-80℃冰箱保存備用。
1.5 尿液的1H-NMR分析
將尿液取出解凍,取尿樣0.5?mL置離心管中,1?2000?r·min-1離心10?min。取上清液300?μL加入5?mm核磁管中,再加入30?μL重水混合均勻,進行1H-NMR測定。以肌酐甲基峰化學位移3.10為內標,采用Noesygpprld脈沖序列,參數如下:譜寬8?000?Hz,累積掃描32次,采樣點數64?000,采樣時間4?s,弛豫延遲8?s,試驗溫度300?K。自由感應衰減信號(FID)經過傅立葉轉換后為一維NMR譜圖,利用MestReNova 6.1軟件對1H-NMR譜進行相位矯正和基線矯正,經相位和基線校正后,去除水峰4.3~6.0,然后將譜圖中0.2~4.3的譜峰,以每段0.02?mg·kg-1的寬度進行分段積分,將積分數據按每一張譜的總積分歸一化,以文本文件或Excel文件貯存,用于多元統計分析。
1.6 數據處理和分析
將所得積分數據輸入SIMCA-P+12.0軟件,進行平均中心化(Mean centering)和Pareto定標(Pareto scaling),利用正交偏最小二乘-判別分析(OPLS-DA)等分析方法進行分析。根據變量投影重要性(Variable importance in the projection, VIP)值、化學位移值以及Chenomx NMR suite 7.5數據庫對主要代謝物的化學位移進行歸屬,VIP>1且具有統計意義的變量被認為是對模型有顯著貢獻的潛在生物標志物。將潛在生物標志物輸入KEGG數據庫查找代謝物涉及的代謝途徑。采用檢驗考察代謝物組間差異的統計學意義,統計數據采用SPSS (version 19.0S, Beijing Stats Data Mining Co. Ltd., China) 統計軟件進行單因素方差分析,<0.05為差異有統計學意義,數據以平均值±標準差(±SD)表示。
2 結果與分析
2.1大鼠尿液1H-NMR圖譜的變化
尿液等終端代謝物是機體各種細胞、組織和器官功能變化的綜合反映,尿液的組成及其代謝物的濃度受機體各系統功能狀態的直接影響,反映機體的代謝狀況[20]。
不同組別大鼠尿液1H-NMR譜見圖1,利用library of the Chenoms NMR suite 7.5,并根據相關參考文獻[21-24]對主要代謝物的化學位移進行歸屬,圖1中包含了7種內源性代謝物,分別為丙酸鹽、β-羥基丁酸鹽、氧化三甲胺、牛磺酸、肌酸、α-酮戊二酸和檸檬酸。與正常對照組相比,正常+TB組的圖譜直接觀察變化不大,而高脂組和高脂+TB組均可看到明顯變化。通過目測很難得出不同組別大鼠尿液代謝物的具體差異,為尋找大鼠尿液的細微成分變化,通過正交偏最小二乘-判別分析(OPLS-DA)對圖譜數據進行統計學分析,詳細研究茶褐素對大鼠尿液內源代謝物的影響。
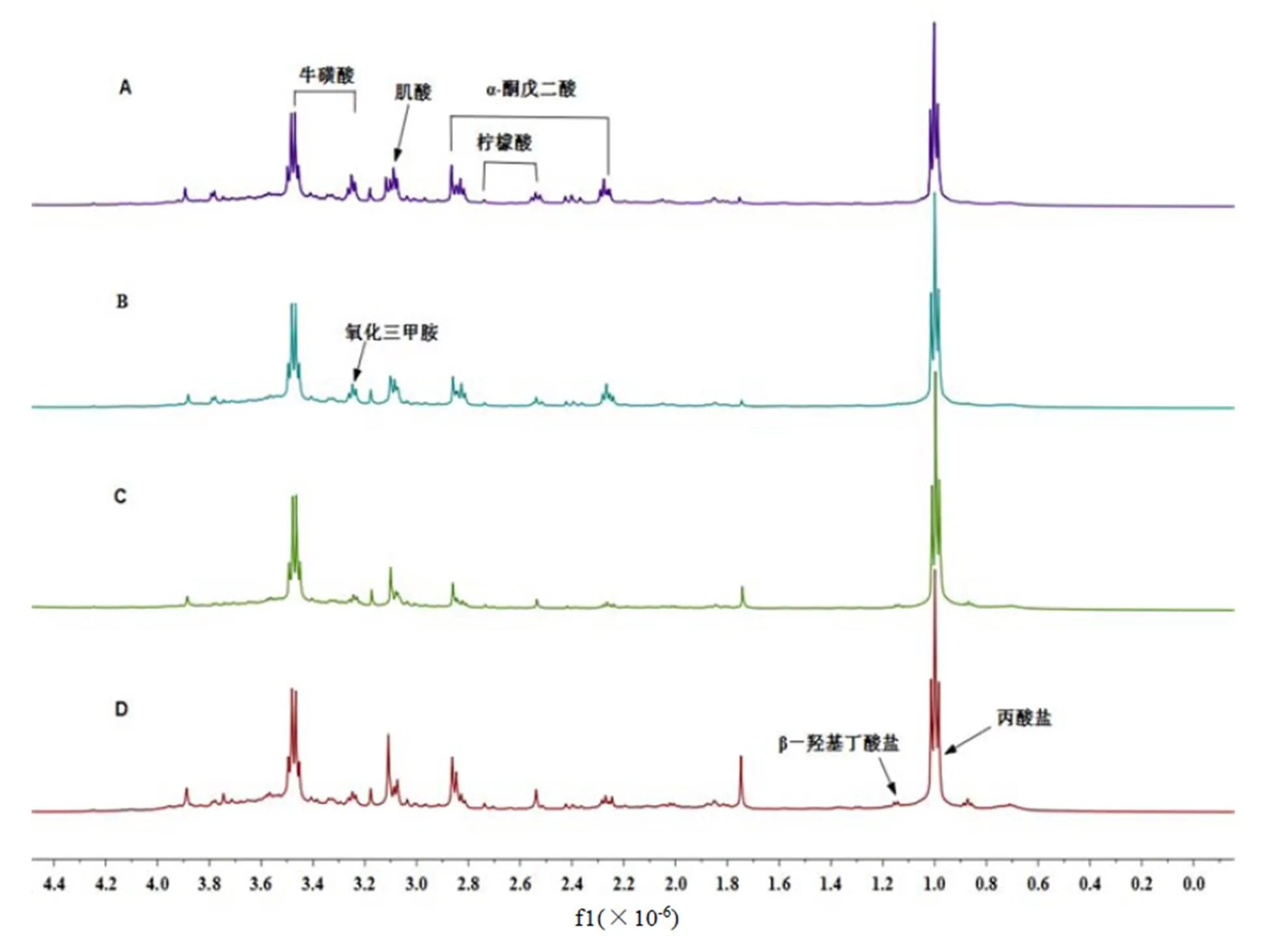
注:A-正常對照組,B-正常+TB組,C-高脂組,D-高脂+TB組。
2.2 大鼠尿液OPLS-DA分析
試驗所建立的OPLS-DA模型的得分圖、載荷圖、S-圖如圖2所示。模型參數R2Y用來衡量已建立的模型對包含分類變量的Y矩陣的解釋能力,Q2表征模型對Y矩陣的預測能力[25]。試驗所建立的OPLS-DA模型的R2Y、Q2值列于圖2中,兩組模型擬合效果較好,有良好的預測能力。
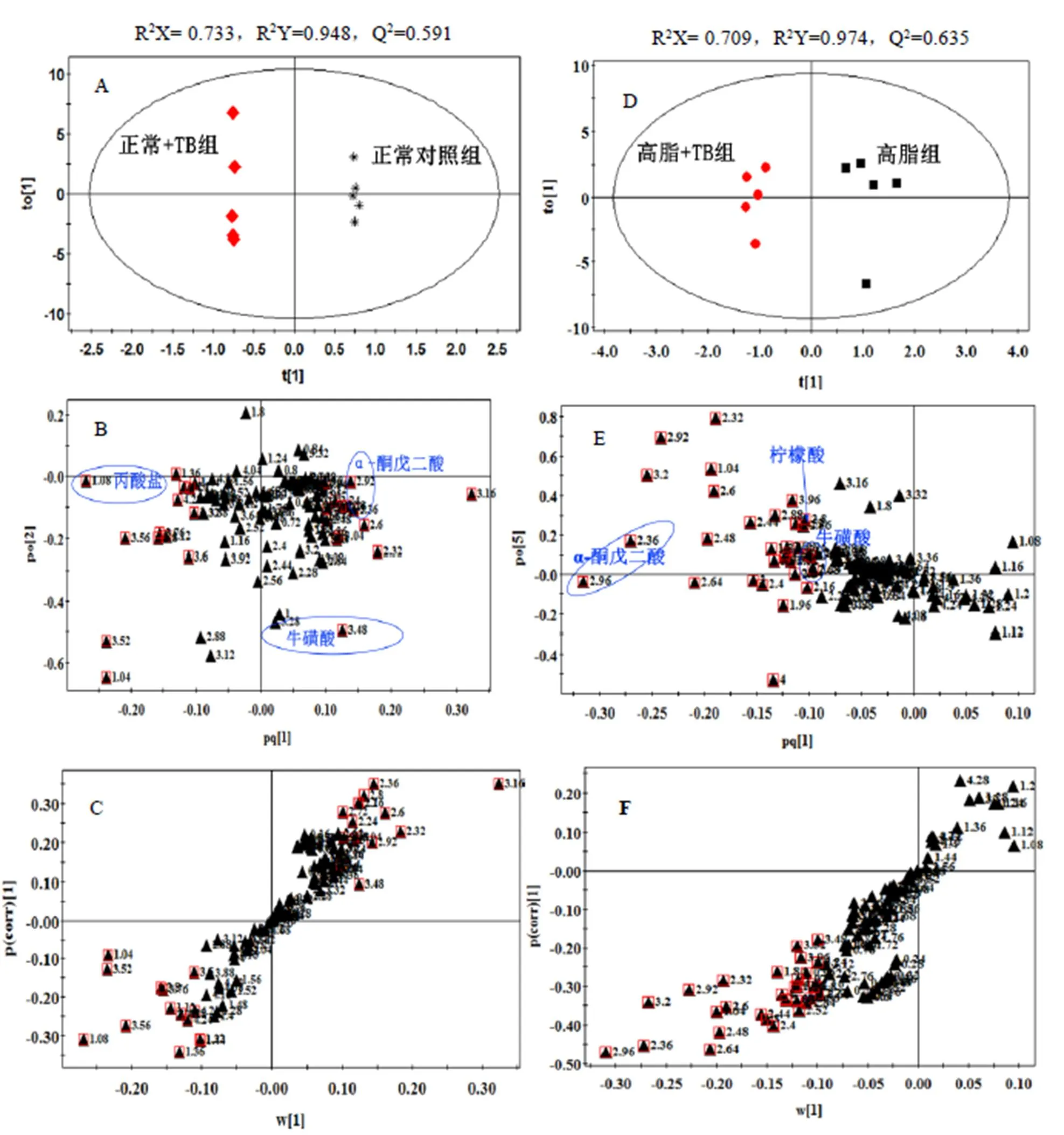
注:正常對照組和正常+TB組比較(A:得分圖,B:載荷圖,C:S-plot圖),高脂組和高脂+TB組比較(D:得分圖,E:載 荷圖,F:S-plot圖)。正常對照組與高脂組為對照組,載荷圖中數字代表化學位移,紅色方框代表VIP值>1的化學位移。
根據得分矩陣主成分1可以區分正常+TB組和正常對照組,高脂+TB組和高脂組,對應積分矩陣圖可見積分值集中分布于散點圖的橢圓內(95%可信區間),不存在特異點,兩組的分布區域完全分開,說明普洱茶茶褐素對飼喂不同飼料的大鼠尿液均產生了影響。相應的OPLS-DA載荷圖和S-plot圖,其中每個點代表1個譜峰段。通常在樣本分組方向上如果譜峰段偏離零點越遠,表明這個譜峰段對分類的貢獻越大,越有可能是潛在的特征代謝物,部分相關代謝物見圖2載荷圖中標注。
2.3 茶褐素對尿液內源性化合物的影響
在OPLS-DA模型中得出的與茶褐素代謝相關度較高的化合物,其濃度變化以及VIP (Variable importance in the projection)值列于表2。VIP值大于1的代謝物被認為是對組別分類貢獻較大的物質,VIP值越大,貢獻越大。從表2可以看出,正常對照組和高脂組大鼠分別灌胃普洱茶茶褐素后,有多種代謝物發生明顯變化。正常對照組和正常+TB組比較中,丙酸鹽、蛋氨酸、α-酮戊二酸、檸檬酸、牛磺酸等對兩組差異貢獻較大。高脂組和高脂+TB組比較中,纈氨酸、β-羥基丁酸鹽、α-酮戊二酸、檸檬酸、牛磺酸、甘氨酸等對兩組差異貢獻較大。這些代謝物涉及到的代謝途徑主要包括氨基酸代謝、能量代謝、三羧酸循環和氧化應激等。
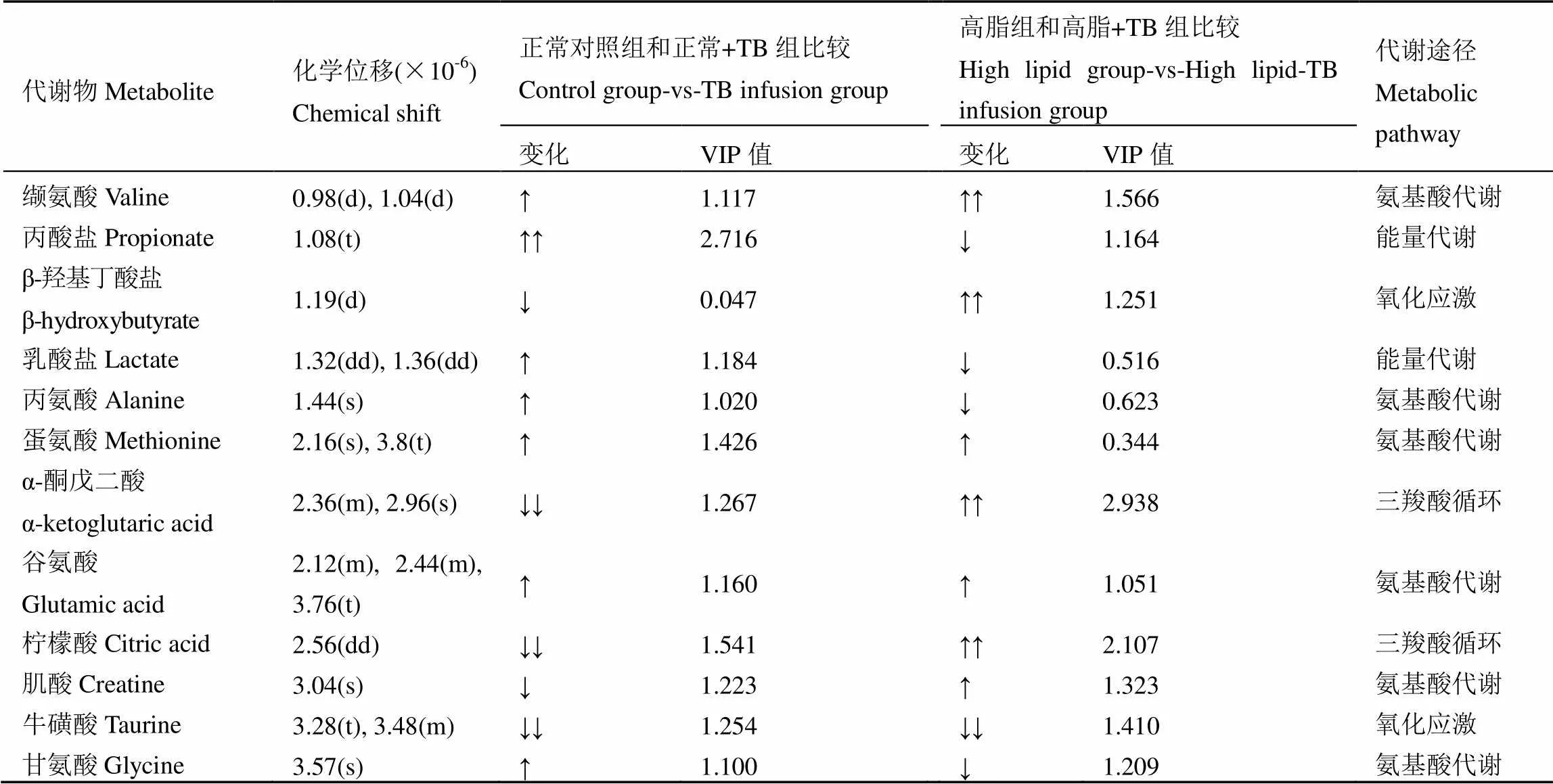
表2 Chenomx NMR Suite確認的尿液樣品中代謝物質
注:s為單峰,d為雙重峰,t為三重峰,m為多重峰,dd為2×2峰。↑表示增加,↑↑表示相對于對照組顯著增加(<0.05);↓表示降低,↓↓表示相對于對照組顯著降低(<0.05),正常對照組和高脂組為對照組。
Note: s, d, t, m, dd represent single peak, double peaks, triple peaks, multiple peaks and 2×2 peaks, respectively. Metabolites marked with ↑ are increased and those marked with ↑↑ are significantly increased in comparison to the control (<0.05). Metabolites marked with ↓ are decreased and those marked with ↓↓ are significantly decreased in comparison to the respective group (<0.05), before vs is the comparative group.
2.4不同組別大鼠尿液中的差異代謝物
采用SPSS軟件對上述貢獻較大的代謝物進一步處理,圖3為經過檢驗的差異代謝物在4組大鼠尿液中的含量比較。相對于正常對照組,正常+TB組大鼠尿液中丙酸鹽顯著升高(<0.05),α-酮戊二酸、檸檬酸、牛磺酸顯著降低(<0.05);相對于高脂組,高脂+TB組大鼠尿液中纈氨酸、α-酮戊二酸、檸檬酸、β-羥基丁酸鹽顯著升高(<0.05);牛磺酸顯著降低(<0.05);相對于正常對照組,高脂組大鼠尿液中丙酸鹽、α-酮戊二酸顯著升高(<0.05),纈氨酸、牛磺酸顯著降低(<0.05);相對于正常+TB組,高脂+TB組大鼠尿液中檸檬酸、α-酮戊二酸、β-羥基丁酸鹽顯著升高(<0.05),牛磺酸顯著降低(<0.05)。
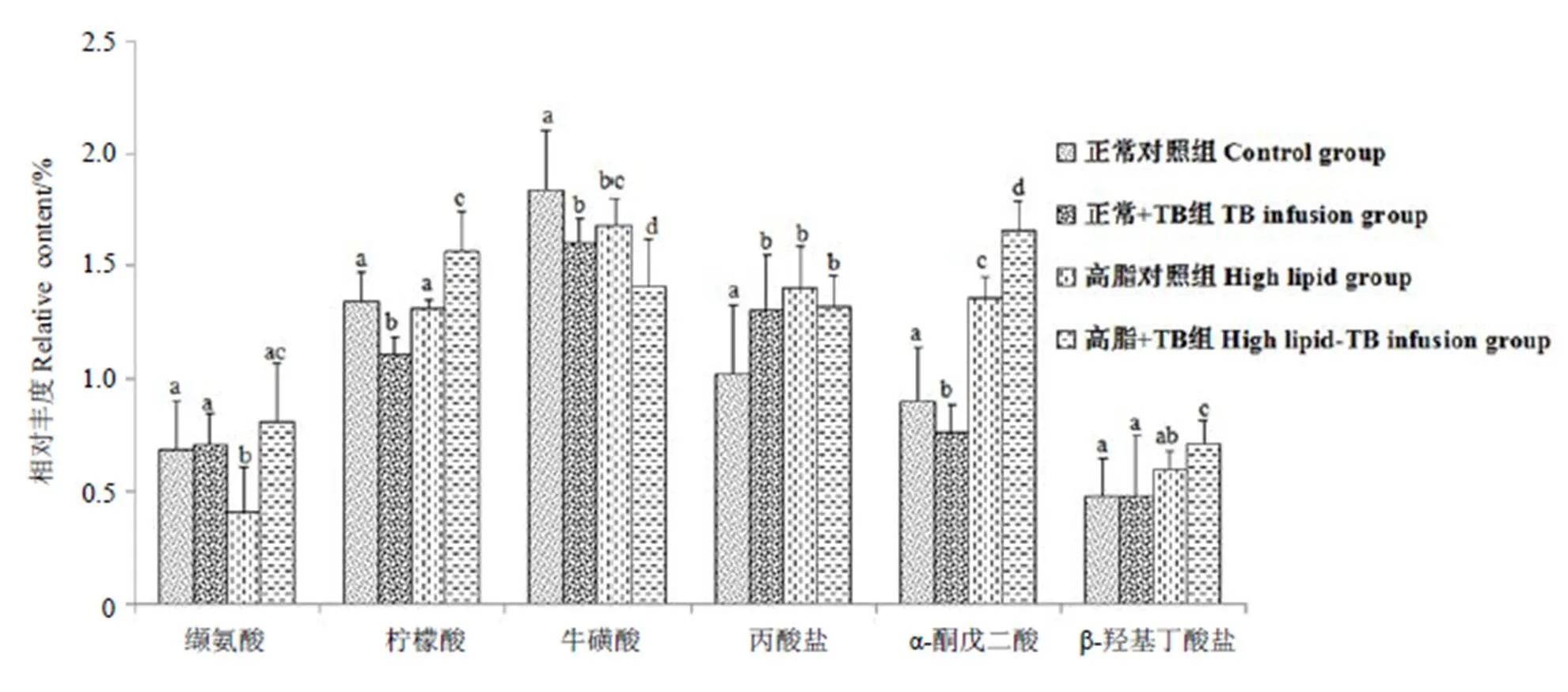
注:同一化合物對應的組別小寫字母不同,代表差異顯著,P<0.05。
3 討論
自1999年以來,基于相關儀器和分析技術的快速提升,代謝組學研究發展迅速,發表的相關科學文獻和綜述的數量呈指數上升趨勢[26-28]。本實驗運用1H-NMR代謝組學技術對灌胃普洱茶茶褐素(TB)后大鼠尿液中內源性代謝產物的變化及其降血脂機制進行探討。
由試驗可知,不同組別大鼠尿液的核磁氫譜有一定差別,經過OPLS-DA的進一步分析和篩選,發現纈氨酸、丙酸鹽等代謝物的不同變化和涉及到的代謝途徑。最后經過檢驗統計學分析,確定纈氨酸、檸檬酸、牛磺酸、丙酸鹽、α-酮戊二酸、β-羥基丁酸為主要的差異代謝物。
已知丙酸鹽具有抑制膽固醇合成的功能[29]。據研究表明,乳酸鹽、丙酸鹽和氨基酸的增加有利于丙酮酸鹽的產生[30]。Stanko等[31]考察了丙酮酸鹽對身體的影響,結果顯示人體補充丙酮酸鹽后,脂肪消耗有明顯的增加趨勢。尿液中的檸檬酸、α-酮戊二酸是三羧酸循環的重要中間產物。由草酰乙酸和乙酰CoA合成檸檬酸是三羧酸循環的重要調節點,由檸檬酸經脫氫脫羧后生成α-酮戊二酸,是三羧酸循環中的限速步驟。
纈氨酸是人體必需的8種氨基酸和生糖氨基酸之一,牛磺酸是一種由胱氨酸轉化而來的含硫的β-氨基酸,這兩種氨基酸都能調節血糖,促進肌細胞對葡萄糖和氨基酸的攝取和利用。其中,牛磺酸還可以加速糖酵解,增加糖原異生[32]。牛磺酸與膽酸結合成牛磺膽酸,參與脂類的消化吸收[33]。同時有報道指出,高脂飲食動物由于肝內膽固醇堆積造成牛磺酸結合的膽汁酸排泄增加,導致尿中牛磺酸減少[34]。Gong等[3]發現普洱茶茶褐素不僅可以促進膽固醇的轉化,還可以促進大鼠體內膽固醇的排泄。β-羥基丁酸鹽是肝臟內脂肪酸氧化的一種產物,Thiess等[35]發現高脂飲食條件下,貓血清中β-羥基丁酸鹽和膽固醇等顯著升高。牛磺酸和β-羥基丁酸鹽的變化表明了氧化應激的產生[36-37]。
丙酸鹽、檸檬酸和α-酮戊二酸涉及到能量代謝,正常+TB組相對于正常對照組,丙酸鹽、檸檬酸和α-酮戊二酸都有顯著變化,說明正常飲食條件下,茶褐素會影響大鼠體內的能量代謝;高脂+TB組相對于高脂組,α-酮戊二酸、檸檬酸顯著升高(<0.05),與正常+TB組對比正常對照組的變化不同,有可能是高脂飼料的飼喂條件下,茶褐素加速了大鼠體內三羧酸循環過程,產生了更多的能量進行脂肪代謝。
正常+TB組相對于正常對照組,高脂+TB組相對于高脂組的牛磺酸含量均顯著減少(<0.05),很有可能是茶褐素調節牛磺酸更多地與膽酸結合,消化吸收脂類成分。高脂+TB組相對于高脂組,β-羥基丁酸鹽含量顯著升高(<0.05),這可能與茶褐素調節大鼠體內脂肪酸代謝有關。此外,高脂+TB組大鼠尿液中纈氨酸含量相對于高脂組顯著升高(<0.05),反映出高脂飲食條件下,普洱茶茶褐素可以調節大鼠體內的氨基酸代謝。
4結論
本文利用基于1H-NMR的代謝組學技術,探討了普洱茶茶褐素對大鼠尿液代謝產物的影響及其降血脂機制。篩選出纈氨酸、檸檬酸、牛磺酸、丙酸鹽、α-酮戊二酸、β-羥基丁酸為普洱茶茶褐素在大鼠體內的標志性代謝物。普洱茶茶褐素通過這些代謝物,影響到大鼠機體的氨基酸代謝、能量代謝、脂類代謝和三羧酸循環等代謝途徑。這些標志性代謝化合物和相關的代謝途徑,初步揭示了普洱茶茶褐素在生物體內的代謝和作用機制,為解釋普洱茶的降血脂機制提供了新的思路。
參考文獻
[1] 龔加順, 周紅杰, 張新富, 等. 云南曬青綠毛茶的微生物固態發酵及成分變化研究[J]. 茶葉科學, 2005, 25(4): 300-306.
[2] Hou Y, Shao WF, Xiao R, et al. Pu-erh tea aqueous extracts lower atherosclerotic risk factors in a rat hyperlipidemia model [J]. Experimental Gerontology, 2009, 44 (6/7): 434-439.
[3] Gong JS, Peng CX, Chen T, et al. Effects of theabrownin from Pu-erh Tea on the metabolism of serum lipids in rats: Mechanism of action [J]. Journal of Food Science, 2010, 75(6): 182-189.
[4] Yan SJ, Wang L, Li Z, et al. Inhibition of advanced glycation end product formation by Pu-erh tea ameliorates progression of experimental diabetic nephropathy [J]. Journal of Agricultural and Food Chemistry, 2012, 60(16): 4102-4110.
[5] 秦誼, 龔加順, 張惠芬, 等. 普洱茶茶褐素提取工藝及理化性的初步研究[J]. 林產化學與工業, 2009, 29: 95-98.
[6] 龔加順, 陳文品, 周紅杰, 等. 云南普洱茶特征成分的功能與毒理學評價[J]. 茶葉科學, 2007, 27(3): 201-2l0.
[7] Wang QP, Peng CX, Gong JS. Effects of enzymatic action on the formation of theabrownin during solid state fermentation of Pu-erh tea [J]. J Sci Food Agric, 2011, 13(91): 2412-2418.
[8] 周紅杰, 秘鳴, 韓俊. 普洱茶的功效及品質形成機理研究進展[J]. 茶葉科學, 2003, 23 (2): 75-77.
[9] 郭韋韋. 普洱茶減肥功效評價與研究[D]. 昆明: 昆明醫學院, 2011: 29-38.
[10] 熊昌云. 普洱茶降脂減肥功效及作用機理研究[D]. 杭州: 浙江大學, 2012: 25-93.
[11] 陳婷. 普洱茶茶褐素降血脂功效及其作用機制研究[D]. 云南: 云南農業大學, 2009: 25-50.
[12] 王秋萍, 龔加順. “紫娟” 普洱茶茶褐素對高脂飲食大鼠生長發育的影響[J]. 茶葉科學, 2012, 32(1): 87-94.
[13] 高斌, 彭春秀, 龔加順, 等. 普洱茶茶褐素對大鼠激素敏感性脂肪酶活性及其mRNA表達的影響[J]. 營養學報, 2010, 4(32): 362-366.
[14] Nicholson JK, Connelly J, Lindon JC, et al .Metabonomics: a platform for studying drug toxicity and gene function [J]. Nat Rev Drug Discov, 2002, 1(2): 153-161.
[15] Azmi J, Griffin JL, Shore RF, et al. Chemometric analysis of biofluids following toxicant induced hepatotoxicity: a metabonomic approach to distinguish the effects of 1-naphthylisothiocyanate from its products [J]. Xenobiotica, 2005, 35(8): 839-852.
[16] Griffin JL. Metabonomics: NMR spectroscopy and pattern recognition analysis of body fluids and tissues for characterization of xenobiotic toxicity and disease diagnosis [J]. Current Opinion in Chemical Biology, 2003, 7(5): 648-654.
[17] 楊大鵬, 史文斌, 陳一江, 等. 不同微生物發酵的云南普洱茶樣中茶褐素提取物的化學成分分析[J]. 林產化學與工業, 2010, 30(1): 49-52.
[18] 敬明武, 葛宇杰, 劉科亮. 茶色素膠囊對大鼠輔助調節血脂的研究[J]. 中國現代醫生, 2007, 45(5): 18-19.
[19] 中華人民共和國衛生部. 保健食品檢驗與評價技術規范[M]. 北京: 人民衛生出版, 2003: 2.
[20] 劉樹民, 崔立然. 代謝組學技術在中藥毒性研究中的應用前景[J]. 毒理學雜志, 2008, 22(2): 155.
[21] Wilson ID, Nicholson JK. Solid phase extraction chromatography and NMR spectroscopy (SPEC-NMR) for the rapid identification of drug metabolites in urine [J]. J Pharm Biomed, 1988, 6(2): 151-165.
[22] Gartland KPR, Eason CT, Wade KE. Proton NMR spectroscopy of bile for onitoring the excretion of endogenous and xenobiotic metabolites: application to paraminophenol [J]. J PharmBiomed,1989, 7(6): 699-707.
[23] Tuli PK, Nicholson JK, Timbrell JAA. Study of the metabolism of dimethylformamide in the rat by high resolution proton NMR spectroscopy [J]. J Pharm Biomed, 1989, 7(4): 499-505.
[24] Wilson ID, Wade KE, Nicholson JK. Analysis of biological fluids by high-field nuclear magnetic resonance spectroscopy [J]. Trends Anal Chem, 1989, 8(10): 368-374.
[25] Liang X, Chen X, Liang Q, et al. Metabonomic study of Chinese medicine Shuanglong formula as an effective treatment for myocardial infarction in rats [J]. J Proteome Res, 2011, 10(2): 790-799.
[26] Sumner LW, Mendes P, Dixon RA. Plant metabolomics: largescale phytochem is try in the functional genomics era [J]. Phytochemistry, 2003, 62(6): 817-836.
[27] Rochfort S. Metabolomics reviewed: a new “omics” platform technology for systems biology and implications for natural products research [J]. J Nat Prod, 2005, 68(12): 1813-1820.
[28] Dettmer K, Aronov PA, Hammock BD. Mass spectrometry–based metabolomics [J]. Mass Spectrom Rev, 2007, 26(1): 51-78.
[29] 林金鴛, 許勁松. 菊粉的功能與應用[J]. 四川食品與發酵, 1999(4): 57-59.
[30] Yoshikawa H, Tajiri Y, Sako Y, et al. Effects of free fatty acids on beta-cell functions: a possible involvement of peroxisome proliferator activated receptors alpha or pancreatic/duodenal homeobox [J]. Metabolism, 2001, 50(5): 613-618.
[31] Stanko RT, Adibi SA. Inhibition of lipid accumulation and enhancement of energy expediture by the addition of pyruvate and dihydroxyacetone to a rat diet [J]. Metabolism, 1986, 35(2): 182-186.
[32] Rahman MM, Park HM, Kim SJ, et al. Taurine prevent shypertension and increases exercise capacity in rats with fructose-induced hypertension [J]. Am J Hypertens, 2011, 24(5): 574-581.
[33] Gavachan CL, Holmes E, Len ZE, et al. An NMR-based metabonomic approach to investigate the biochemical consequences of genetic strain differences;application to the C57BL10J and Alpk:Apfcd mouse [J]. FEBS Lett, 2000, 484(3): 169.
[34] Rull A, Vinaixa M, Angel Rodriguez M, et al. Metabolic phenotyping of genetically modified mice: An NMR metabonomic approach [J]. Biochimie, 2009, 91(8): 1053-1057.
[35] Thiess S, Becskei C, Tomsa K, et al. Effects of a high carbohydrate and high fat diet on plasma metabolite levels and on iv glucose tolerance test in intact and neutered male cats [J]. J Feline Med Surg, 2004, 4(6): 207-218.
[36] Shimazu T, Hirschey MD, Newman J, et al. Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor [J]. Science, 2013, 339(11): 211-214.
[37] Jiang L, Huang J, Wang Y, et al. Metabonomic Analysis Reveals the CCl4-Induced Systems Alterations for Multiple Rat Organs [J]. J Proteome Res, 2012, 11(7): 3848-3859.
Metabolomic Analysis of Rat Urine after Intragastric Infusion of Pu-erh Theabrownins
LIU Jian1, PENG Chunxiu2, SHENG Jun1, GAO Bin1, GONG Jiashun1*
1. Faculty of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 2. Horticultural Department, Yunnan Agricultural University, Kunming 650201, China
The study was aimed to understand the effects of Pu-erh theabrownin (TB) (Mw>50?kDa) on the metabolism of rat urine by nuclear magnetic resonance (NMR)-based metabolomics. Rats were divided into four groups including rats receiving a basic diet alone (control group), a basic diet and intragastric infusion of Pu-erh TBs (TB infusion group), a high-lipid diet alone (high lipid group) and high-lipid diet and intragastric infusion of Pu-erh TBs (high lipid-TB infusion group) for 14 d. Urine samples were analyzed by biochemical assays, NMR and orthogonal partial least-square-discriminant analysis (OPLS-DA) to identify differential metabolism among these groups. The results showed that considerable differences in metabolite profiles of rat urine were detected between control group and TB infusion group, and between high lipid group and high lipid-TB infusion group. Valine, citric acid, taurine, propionate, α-ketoglutaric acid and β-hydroxybutyrate were identified as metabolic markers of Pu-erh TB. Besides, Pu-erh TBwas likely to influence several metabolic pathways in rat, including amino acid metabolism, energy metabolism, tricarboxylic acid cycle, lipid metabolism and oxidativestress.
theabrownins, metabolomics, NMR
TS272.5+4;Q946.84+1
A
1000-369X(2016)05-491-09
2016-02-25
2016-05-30
國家自然科學基金資助項目(No. 31260195、30960241、30760152)
劉建,男,碩士,主要從事營養與食品安全研究,E-mail:sanliujian@126.com。
gong199@163.com

