基于轉錄組測序對茶樹GST基因表達的研究
張亞真,韋康,王麗鴛,成浩
?
基于轉錄組測序對茶樹基因表達的研究
張亞真,韋康*,王麗鴛,成浩
中國農業科學院茶葉研究所國家茶樹改良中心農業部茶樹生物學與資源利用重點實驗室,浙江杭州 310008
谷胱甘肽轉移酶(Glutathione-transferases,)在植物體內普遍存在,是一類具有多種生物學功能的超家族蛋白酶。本研究通過對中黃2號、龍井43在正常光照和遮蔭處理下的轉錄組測序,篩選獲得了49個基因家族成員,并對其中19個在芽葉中表達量較高的基因進行了序列分析和聚類分析。另外對表達量較高的8個候選基因進行熒光定量表達分析,研究它們在龍井43不同葉位中的表達模式。結果表明這些基因在一芽一葉到第六葉中均有表達,但各自呈現出不同的變化規律。在龍井43一芽一葉到第六葉中的表達量逐漸上升,可能與植物抗脅迫有關,而的表達量則顯著下降,可能與花青素代謝有關。
茶樹;轉錄組測序;谷胱甘肽轉移酶;表達分析
谷胱甘肽轉移酶()是一類由多基因編碼、具有多種功能的超家族蛋白酶,普遍存在于動物、植物及微生物中。根據基因結構及蛋白同源性可分為8類,即phi(F型)、tau(U型)、zeta(Z型)、theta(T型)、lambda(L型)、脫氫抗壞血酸還原酶(Dehydroascorbate reductase, DHAR)、四氯代氫醌脫鹵素酶(Tetrachlorohy droquione dehalogenase, TCHQD)和微粒體GST(Membrane-associated proteins in eicosanoid and glutathione metabolism, MAPEG),除微粒體GST外,其他7類均為可溶性GST,且GSTF和GSTU一般只存在于植物體內,含量較高,種類也最為豐富[1]。自20世紀70年代在玉米中首次發現GST以來[2],許多植物中的GST也都相繼被發掘。目前,基因已在17種植物中得到克隆和研究[3],如擬南芥中有54個基因,水稻59個,玉米42個,大豆26個[4]。
雖然家族數量眾多,序列差異較大,但具有相似的三維結構,一般是由兩個亞基組成的同源或異源二聚體,且每個亞基都具有兩個基本的功能域:位于N端的谷胱甘肽結合位點(G-site)和位于C端的疏水性底物作用位點(H-site)[4]。不同種類基因的差異主要體現在G位點功能和H位點結合底物的不同,由此決定了基因具有解毒、調節植物次級代謝[5]和參與植物生長發育、細胞信號轉導及細胞凋亡等多種功能[6-9]。
茶樹作為我國重要的經濟作物,在生長發育的不同階段,往往會受到多種生物或非生物脅迫,如病原菌侵害、干旱、高溫等,由此造成茶葉產量和品質的下降;另一方面,茶葉對人體具有多種營養價值和保健功效,而類黃酮物質是其首要的生物活性成分,占鮮葉干重的18%~36%[10]。近年來,已有大量研究表明,在多種植物體內與抗脅迫和類黃酮等次生代謝產物緊密相關,而茶樹中有關基因家族只有少量研究,完整序列也僅有2條(登錄號分別為FJ014478、KF612020),在茶樹體內的相關功能研究則更為缺乏。因此,本研究在對不同處理下龍井43和中黃2號進行轉錄組測序的基礎上,獲得基因,再經過進一步篩選、生物信息學分析和不同組織部位的表達分析,以明確候選基因的時空表達規律,為以后開展基因克隆及功能的研究提供理論基礎。
1 材料與方法
1.1 材料
以種植于中國農業科學院茶葉研究所的龍井43和中黃2號為轉錄組測序材料,一組經遮蔭處理(20?m×20?m遮陽網覆蓋,遮光率為80%±5%),另一組不遮蔭(CK)。7?d后采一芽一葉,液氮速凍后于-80℃冰箱保存,用于轉錄組測序。
用于熒光定量PCR的材料為種植于中國農業科學院茶葉研究所的龍井43,選取生長勢相對一致的正常植株,于2015年8月7日采摘一芽一葉、第二葉、第三葉、第四葉、第五葉、第六葉,液氮速凍后于-80℃冰箱保存。
1.2 CsGSTs的篩選及其差異表達分析
根據Wei等[11]的方法對4組樣品(龍井43對照、龍井43遮蔭、中黃2號對照、中黃2號遮蔭)的測序結果進行分析,主要是將序列重新組裝和進行功能注釋,篩選得到基因。
1.3 CsGSTs序列分析及聚類分析
將得到的序列在NCBI網站上利用ORF Finder和BLASTX工具進行保守結構域分析;并與擬南芥基因家族成員進行BLASTX比對;然后根據RPKM (Reads Per kb Million reads) 最大值大于10進一步篩選,得到的序列,經修飾后用MEGA6進行多序列比對和聚類分析。
1.4 總RNA提取及cDNA合成
茶樹葉片總RNA提取方法參照天根公司提供的多糖多酚植物總RNA提取試劑盒進行,然后以500?ng RNA為模板,根據天根Fast Quant RT Kit(with gDNase)提供的的方法反轉錄成cDNA,稀釋至統一濃度(40?ng·μL-1),作為熒光定量模板。
1.5 CsGSTs基因熒光定量PCR分析
以龍井43一芽一葉、第二葉、第三葉、第四葉、第五葉、第六葉的cDNA為模板,選取RPKM值較高的基因進行熒光定量PCR分析。根據前期轉錄組測序獲得的基因序列片段,使用NCBI在線Prime-blast軟件設計熒光定量特異引物(表1)。采用相對定量的方法,以GAPDH為內參基因,分析基因的表達量。反應體系為SYBR Premix Ex Taq 10mL,ROX DyeⅡ 0.4mL,10mmol·L-1上、下游引物各0.8mL,cDNA 2mL,加水至終體積20mL,反應在ABI PRISM 7500實時定量PCR儀上進行。反應程序如下:95℃預變性30?s,95℃變性5?s,62℃退火延伸34?s,40個循環,反應結束后分析熒光值變化曲線和融解曲線。4次技術性重復,結果采用2-??CT算法分析。

表1 實時熒光定量PCR引物
2 結果與分析
2.1 CsGSTs基因的篩選結果及表達情況
根據轉錄組測序結果篩選得到49個基因,按照基因序列號從小到大進行命名,并對其進行亞家族分類。4組轉錄組數據中,以RPKM最高值進行統計(表2),結果表明,49個基因可分為7個亞家族,其中近一半基因屬于U型(25個:)其次是F型(10個:),T型(6個:),DHAR型(3個:),Z型(2個:),TCHQD型(2個:),MAPEG型最少(1個:)。按照基因表達水平進行分析,結果表明,12.24%的基因為超高表達水平(RPKM≥100),主要是U型和F型;26.53%的基因為高表達水平(10≤RPKM<100);42.86%的基因為中表達水平(1≤RPKM<10);18.37%的基因為低表達水平(0<RPKM<1),總體來說,基因在茶樹芽葉中表達量較為豐富。
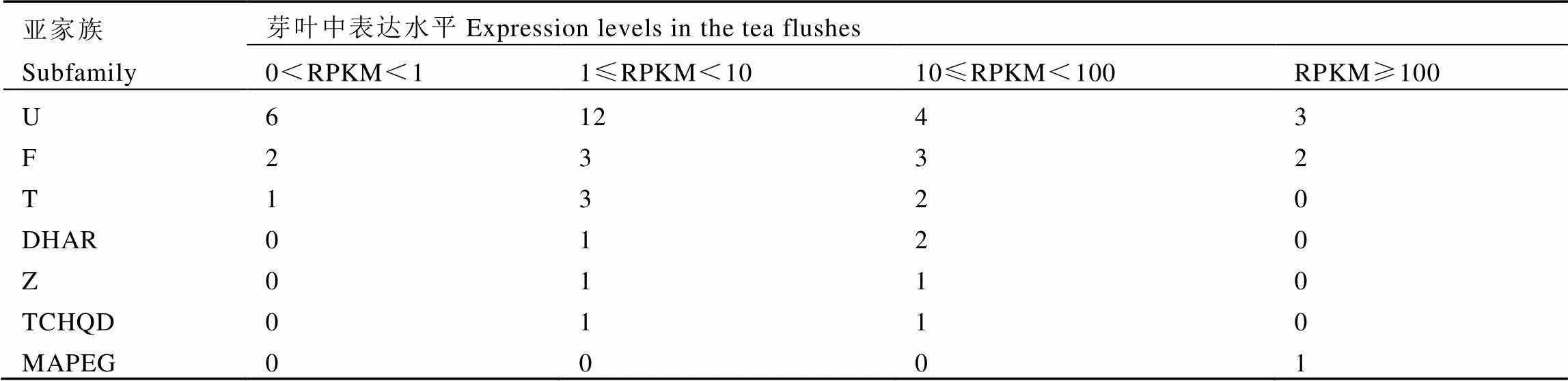
表2 不同亞家族CsGSTs基因的RPKM值分布
亞家族中基因的表達量差異較大(圖1),大部分為中低表達水平。其中,以的RPKM值最高,在中黃2號對照組中甚至高達650,其次是、和。大部分基因在經過遮蔭處理后,表達量均有一定程度的下降,如、和;、和的RPKM值在品種之間的差異明顯大于處理之間的差異,如在不同品種對照組間的表達差異達到6倍以上。
CsGSTF亞家族的表達情況如圖2所示。其中以的表達量最高,4組數據中RPKM的平均值在470左右。中黃2號品種,大部分基因的表達量經遮蔭處理后略有上升;而龍井43多數基因的表達量在遮蔭后則略有降低,尤其是,對照組與處理組的RPKM值相差3倍,說明茶樹基因的表達具有一定的品種差異。
其他CsGSTs亞家族的表達情況如圖3所示。大部分基因為中高表達水平,以MAPEG亞家族的表達量最高;GSTT亞家族中,的表達量最高,RPKM最大值約為50;DHAR亞家族中,最高,RPKM最大值接近100;而Z型和TCHQD型的RPKM值則相對較低;大部分基因在不同品種和處理之間的表達量變化較小,相對穩定。
2.2 CsGSTs的序列分析及聚類分析
進一步對RPKM最高值大于10且包含完整ORF閱讀框的19個基因進行分析表明,(7個)和(5個)仍占主導地位(表3)。其中3個基因與AtGSTU19的序列相似度較高,說明這類基因可能在茶樹芽葉中具有重要作用。
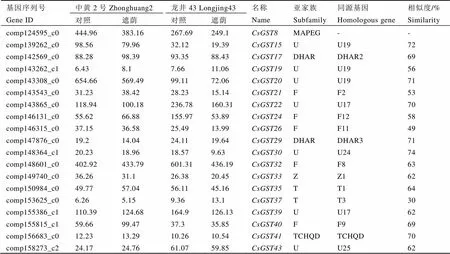
表3CsGSTs基因的RPKM值及BLASTX結果
基于氨基酸序列對這19個基因進行系統進化分析(圖4),結果與BLASTX分類結果基本一致。和被聚在相距較遠的兩個分支中。除CsGSTT基因外,同屬一個亞家族的基因都聚在一起,說明不同亞家族基因之間的序列差異較大。
2.3 CsGSTs基因的表達分析
選取RPKM值較高的8個基因(CsGST8、、、、、、和),分別測定它們在龍井43不同葉位的表達量(圖5)。結果表明,這8個基因在一芽一葉到第六葉中均有表達,但表達量及其變化規律不同。除和外,其他基因在一芽一葉中的表達量均小于在其他葉位的表達量。其中,的表達量隨葉片成熟度的增加明顯下降,在第四葉中的表達量只有一芽一葉的1%,第六葉中僅檢測到微量的表達。而的表達量變化規律則完全相反,隨著葉子成熟度的增加,表達量逐漸上升,第六葉中的表達量為一芽一葉的15.86倍。其他基因的表達規律并不明顯:除在第六葉中表達量略有下降外,總體有一定的上升趨勢;CsGST8與的表達量變化相對穩定。、、的表達量變化規律相似,在第二葉或第四葉的表達量達到最高,整體呈波動變化。
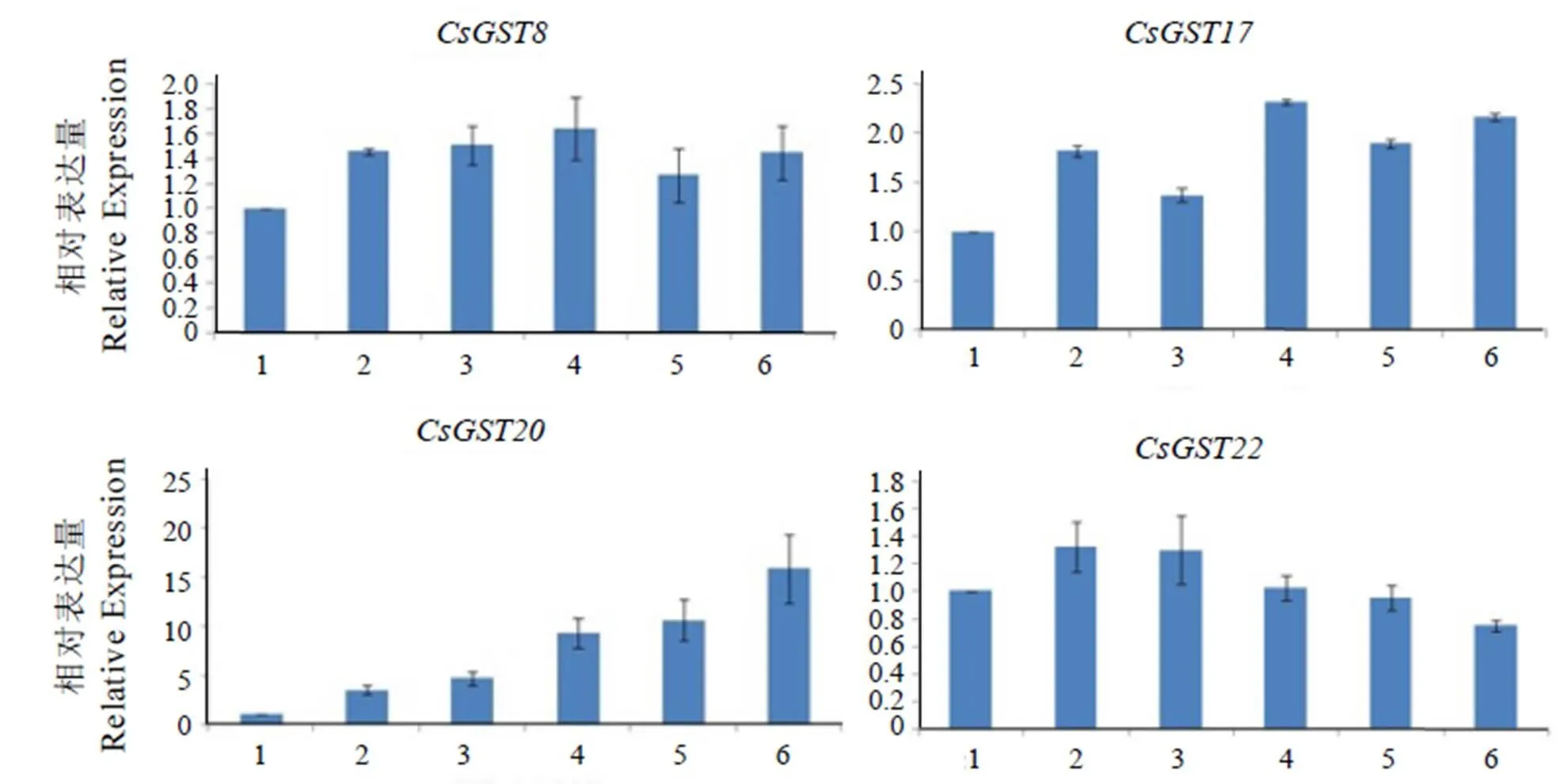
注:1代表一芽一葉;2代表第二葉;3代表第三葉;4代表第四葉;5代表第五葉;6代表第六葉。
Notes:1 represents a bud with a leaf, 2 represents the second leaf, 3 represents the third leaf, 4 represents the fourth leaf, 5 represents the fifth leaf, 6 represents the sixth leaf.
圖5在龍井43不同葉位的表達量
Fig. 5 Relative expression ofin different leaf positions of Longjing43
3 小結與討論
本研究主要通過轉錄組測序、生物信息學分析和實時熒光定量PCR等試驗對茶樹中基因進行了篩選和分析。前期轉錄組測序篩選獲得了49個差異表達的基因,它們的表達量變化范圍較大(表2),同一基因在不同品種和處理之間的RPKM值也不盡相同(圖1~圖3)。大部分基因在經遮蔭處理后的表達量有一定程度下降(圖1);而基因在不同品種中對遮蔭有不同的響應:中黃2號大多數基因的表達量在遮蔭后略有上升,而龍井43中基因的表達量在遮蔭后普遍降低(圖2);其他亞家族成員在不同品種和處理之間的表達量則相對穩定(圖3)。
部分基因的表達具有明顯的品種差異,尤其是,它在兩個品種之間的RPKM值相差6倍以上(圖1);qRT-PCR結果表明,基因的表達隨葉子成熟度的增加而顯著上升,一芽一葉與第六葉中的表達量甚至相差16倍。與擬南芥()的相似度達71%,研究表明,與植物抗脅迫能力緊密相關,如抗旱和抗鹽脅迫[12-14]。一方面,可能作為抗氧化酶直接與活性氧(Reactive Oxygen Species, ROS)反應,減少細胞損傷[15],提高植物抗性;另一方面,還可能作為脅迫調控因子,當植物受到脅迫時可激活脅迫響應途徑,使相應的抗氧化酶活性提高,間接參與植物抗脅迫反應[14]。可能與的功能相似,通過減少ROS在植物體內的積累,直接或間接參與植物抗逆反應。
而則對遮蔭處理較為敏感,與龍井43對照組相比,遮蔭組的RPKM值明顯下降(圖2)。qRT-PCR結果表明,基因的表達量隨葉子成熟度的增加而急劇下降,在第六葉中僅有微量表達。與擬南芥中的相似度最高,諸多研究表明,作為轉運蛋白,可將花青素和原花青素從合成部位(主要是細胞質)運至液泡并累積[16-18],這樣不僅能減少產物對反應的抑制作用,促進花青素和原花青素的合成,還可以減少類黃酮等次級代謝產物對細胞的毒害作用[19]。Hu等[20]發現荔枝()中(F型)也與花青素累積相關。茶樹體內的多酚類主要集中分布在新梢生長旺盛的部分,也隨著葉子成熟度的增加而逐漸減少[21-23],這與的表達量變化規律也相對一致。此外,Wang等人的研究表明中黃2號中類黃酮如花青素和兒茶素的含量顯著低于龍井43[24],且經遮蔭處理后,會促進茶樹氮代謝,碳代謝相應減弱,導致類黃酮途徑中多酚類含量降低[21],這與轉錄組測序中的RPKM值變化規律也相對一致。因此與功能相似,也可能作為轉運蛋白參與類黃酮物質從細胞質到液泡中的轉運和累積,從而影響茶樹體內花青素等類黃酮物質的代謝。
是僅有的MAPEG型的GST,表達量相對穩定。目前,植物中的MAPEG蛋白大部分都具有谷胱甘肽轉移酶的活性[25],但難溶于水,與其他幾類可溶性GST蛋白相比,它在大部分植物中的酶活性相對較低[26]。因此,Basantani等[3]認為在正常生長環境條件下,此類基因可能無明顯功能,但經一定條件誘導后可發揮重要作用;的表達量變化也較小,與擬南芥AtGSTU17的序列相似度較高。AtGSTU17可通過影響谷胱甘肽庫的平衡來參與調節光信號傳導和植物生長發育等過程[27];Chen等[28]還發現在干旱和鹽脅迫中,AtGSTU17還可作為負調節因子,低表達量或基因缺失有利于提高植物抗性。與擬南芥中AtGSTF8的相似度最高。研究表明,在多種生物和非生物脅迫條件下,包括H2O2[29]、水楊酸[30]、生長素、除草劑和微生物侵染[31]等,AtGSTF8均可被誘導表達,還可作為早期氧化脅迫反應信號[32],參與植物抗氧化脅迫反應。而、、雖然分別屬于DHAR型、Z型、T型,但表達規律相似,在第二葉和第四葉的表達量較高。植物中的DHAR型GST具有巰基轉移酶活性,可作為氧化還原酶參與抗壞血酸循環[33],水稻[34]和蝴蝶蘭[35]中的DHAR還與植物抗高溫脅迫有關;Z型GST主要是作為馬來酰乙酰乙酸異構酶,參與植物體內酪氨酸代謝[36-37],此外,水稻中還可被茉莉酸誘導,可能參與抗脅迫反應[38];T型具有谷胱甘肽過氧化物酶活性,在植物抗氧化脅迫反應中,可減少有機過氧化物的生成,減少細胞損傷[39]。
由于是由眾多基因組成的龐大而復雜的家族,其編碼產物也具有多種功能。雖然家族成員之間存在著功能冗余的現象,但每一個基因在不同物種中可能都具有一定的特異性和特定的表達模式[40]。結合以上轉錄組測序和實時熒光定量PCR的結果,推測茶樹中的成員亦是如此:在不同茶樹品種、組織部位或不同處理下,即使同屬一個亞家族,不同基因之間的表達模式和功能也可能不盡相同。因此在茶樹中是否具有轉運花青素或抗脅迫等類似功能,仍需進一步研究。
參考文獻
[1] Mohsenzadeh S, Esmaeili M, Moosavi F, et al. Plant glutathione-transferase classification, structure and evolution [J]. African Journal of Biotechnology, 2011, 10(42): 8160-8165.
[2] Shimabukuro RH, Swanson HR, Walsh WC. Glutathione conjugation: atrazine detoxification mechanism in corn [J]. Plant Physiology, 1970, 46(1): 103-107.
[3] 馬立功, 孟慶林, 張勻華, 等. 向日葵谷胱甘肽-S-轉移酶基因的克隆及抗病功能研究[J]. 中國油料作物學報, 2015, 37(5): 635-643.
[4] Basantani M, Srivastava A. Plant glutathione transferases—a decade falls short [J]. Canadian Journal of Botany, 2007, 85(5): 443-456.
[5] Dixon DP, Skipsey M, Edwards R. Roles for glutathione transferases in plant secondary metabolism [J]. Phytochemistry, 2010, 71(71): 338-350.
[6] Bilang J, Sturm A. Cloning and characterization of a glutathione-transferase that can be photolabeled with 5-Azido-indole-3-acetic acid [J]. Plant Physiology, 1995, 109(1): 253-260.
[7] Dixon DP, Lapthorn A, Madesis P, et al. Bingding and glutathione conjugation of porphyrinogens by plant glutathione transferases [J]. The Journal of Biological Chemistry, 2008, 283(29): 20268-20276.
[8] Loyall L, Uchida K, Braun S, et al. Glutathione and a UV light-induced glutathione-transferases are involved in signaling to chalcone synthase in cell cultures [J]. Plant Cell, 2000, 12(10): 1939-1950.
[9] Kampranis SC, Damianova R, Atallah M, et al. A novel plant glutathione-transferase/peroxidase suppresses bax lethality in yeast [J]. The Journal of Biological Chemistry, 2000, 275(38): 29207-29216.
[10] 夏濤, 高麗萍. 類黃酮及茶兒茶素生物合成途徑及其調控研究進展[J]. 中國農業科學, 2009, 42(8): 2899-2908.
[11] Wei K, Wang LY, Wu LY, et al. Transcriptome analysis of indole-3-butyric acid-induced adventitious root formation in nodal cuttings of(L.) [J]. PLoS ONE, 2014, 9(9): e107201.
[12] Bianchi MW, Roux C, Vartanian N. Drought regulation of GST8, encoding the Arabidopsis homologue of ParC/Nt107 glutathione tranferase/peroxidase [J]. Physiologia plantarum, 2002, 116(1): 96-105.
[13] Wagner U, Edwards R, Dixon DP, et al. Probing the diversity of the Arabidopsis glutathione-transferase gene family [J]. Plant Molecular Biology, 2002, 49(5): 515-532.
[14] Xu J, Tian YS, Xing XJ, et al. Over-expression ofprovides tolerance to salt, drought and methy viologen stresses in Arabidopsis [J]. Physiologia Plantarum, 2015, 156(2): 164-175.
[15] Jiang Y, Yang B, Harris NS, et al. Comparative proteomic analysis of Arabidopsis roots [J]. Journal of Experimental Botany, 2007, 58(13): 3591-3607.
[16] Kitamura S, Shikazono N, Tanaka A. Transparent testa 19 is involved in the accumulation of both anthocyanins and proanthocyanidins in Arabidopsis [J]. The Plant Journal, 2004, 37(1): 104-114.
[17] Sun Y, Li H, Huang JR. Arabidopsis TT19 function as a carrier to transport anthocyanin from the cytosol to tonoplasts [J]. Molecular Plant, 2012, 5(2): 387-400.
[18] Li X, Gao P, Cui DJ, et al. The Arabidopsis tt19-4 mutant differentially accumulates proanthocyanidin and anthocyanin through a 3′amino acid substitution in glutathione-transferase [J]. Plant Cell and Environment, 2010, 34(3): 374-388.
[19] Zhao J. Flavonoid transport mechanisms: how to go, and with whom [J]. Trends in Plant Science, 2015, 20(9): 576-585.
[20] Hu B, Zhao J, Lai B, et al.is an anthocyanin-related glutathione-transferase gene in Litchi chinensis Sonn [J]. Plant Cell Rep, 2016. DOI: 10.1007/s00299-015-1924-4.
[21] 宛曉春. 茶葉生物化學[M]. 北京: 中國農業出版社, 2003: 132-140.
[22] 張琳, 何曉葉, 李建科. 紫陽富硒地區茶葉中茶多酚及硒含量不同季節與葉片分布規律[J]. 農產品加工, 2014, 10: 13-15.
[23] 游見明, 曹新志. 福林酚法測定茶樹中茶多酚的分布水平[J]. 湖北農業科學, 2013, 52(10): 2417-2419.
[24] Wang L, Yue C, Cao HL, et al. Biochemical and transcriptome analysis of a novel chlorophyll-deficient chlorina tea plant cultivar [J]. BMC Plant Biology, 2014, 14(1): 1-13.
[25] Bresell A, Weinander R, Lunsqvist G, et al. Bioinformatic and enzymatic characterization of the MAPEG superfamily [J]. FEBS Journal, 2005, 272(7): 1688-1703.
[26] Pflugmacher S, Schroder P, Sandermann H Jr. Taxonomic distribution of plant glutathione-transferases acting on xenobiotics [J]. Phytochemistry, 2000, 54(3): 267-273.
[27] Jiang HW, Liu MJ, Chen IC, et al. A glutathione-transferase regulated by light and hormones participates in the modulation of Arabidopsis seedling development [J]. Plant Physiology, 2010, 154(4): 1646-1658.
[28] Chen JH, Jiang HW, Hsieh EJ, et al. Drought and salt stress tolerance of an Arabidopsis glutathione-transferase U17 knockout mutant are attributed to the combined effect of glutathione and abscisic acid [J]. Plant Physiology, 2012, 158(1): 340-351.
[29] Chen WQ, Chao G, Singh KB. The promoter of a H2O2-inducible, Arabidopsis glutathione-transferase gene contains closely linked OBF- and OBP1-binding sites [J]. The Plant Journal, 1996, 10(6): 955-966.
[30] Chen W, Singh KB. The auxin, hydrogen peroxide and salicylic acid induced expression of the Arabidopsis GST6 promoter is mediated in part by an ocs element [J]. The Plant Journal, 1999, 19(6): 667-677.
[31] Kovtun Y, Chiu WL, Tena G, et al. Functional analysis of oxidative stress-activated mitogen-activated protein kinase cascade in plants [J]. Proc Natl Acad Sci, 2000, 97(6): 2940-2945.
[32] Thatcher LF, Carrie C, Andersson CR, et al. Differential gene expression and subcellular targeting of Arabidopsis glutathione-transferase F8 is achieved through alternative transcription start sites [J]. The Journal of Biological Chemistry, 2007, 282(39): 28915-28928.
[33] Dixon DP, Davis BG, Edwards R. Functional divergence in the glutathione transferase superfamily in plants [J]. The Journal of Biological Chemistry, 2002, 277(34): 30859-30869.
[34] Urano J, Nakagawa T, Maki Y, et al. Molecular cloning and characterization of a rice dehydroascorbate reductase [J]. Federation of European Biochemical Societies, 2000, 466(1): 107-111.
[35] Ali MB, Hahn EJ, Paek KY. Effects of temperature on oxidative stress defense systems, lipid peroxidation and lipoxygenase activity in[J]. Plant Physiology and Biochemistry, 2005, 43(3): 213-223.
[36] Dixon DP, Cole DJ, Edwards R. Characterisation of a zeta class glutathione transferase fromwith a putative role in tyrosine catabolism [J]. Archives of Biochemistry and Biophysics, 2000, 384(2): 407-412.
[37] Thom R, Dixon DP, Edwards R, et al. The structure of a zeta class glutathione-transferase from: characterisation of a GST with novel active-site architecture and a putative role in tyrosine catabolism [J]. Journal of Molecular Biology, 2001, 308(5): 949-962.
[38] Tsuchiya T, Takesawa T, Kanzaki H, et al. Genomic structure and differential expression of two tandem-arranged GSTZ genes in rice [J]. Gene, 2004, 335(23): 141-149.
[39] Reumann S, Quan S, Aung K, et al. In-depth proteome analysis ofleaf peroxisomes combined with in vivo subcellular targeting verification indicates novel metabolic and regulatory functions of peroxisomes [J]. Plant Physiology, 2009, 150(1): 125-143.
[40] Sappl PG, Carroll AJ, Clifton R, et al. Theglutathione transferase gene family displays complex stress regulation and co-silencing multiple genes results in altered metabolic sensitivity to oxidative stress [J]. The Plant Journal, 2009, 58(1): 53-68.
Analysis ofGenes in Tea Plant () Based on Transcriptome Analysis
ZHANG Yazhen, WEI Kang*, WANG Liyuan, CHENG Hao
Tea Research Institute, Chinese Academy of Agricultural Sciences; National Center for Tea Improvement; Key Laboratory of Tea Biology and Resources Utilization, Ministry of Agriculture, Hangzhou 310008, China
Glutathione-transferases (GSTs) belong to a superfamily of multifunctional enzymes and are ubiquitous in plants. Forty ninegenes were identified by transcriptome analysis of Zhonghuang2 and Longjing43 under control and shading treatment. Nineteenwith relatively high expression levels in buds were used for sequence and phylogenetic tree analysis. Real-time fluorescence quantitative PCR (qRT-PCR) was performed to analyze the expression patterns of 8 candidate genes in different leaf positions of Longjing43. The results showed thatwere expressed in all tested leaves, but exhibited different expression patterns.showed an increasing expression from a bud with a leaf to the sixth leaf, suggesting a potential role in stress resistance. On the other hand, the expression level ofdropped significantly, suggesting thatmight participate in anthocyanin accumulation in tea plants.
tea plant (), transcriptome analysis, GST, expression analysis
S571.1;Q51
A
1000-369X(2016)05-513-10
2016-04-14
2016-05-20
現代農業(茶葉)產業技術體系(CARS-23)、國家自然科學基金項目(31470396)、浙江省自然科學基金項目(LY14C020001)。
張亞真,女,碩士研究生,主要從事茶樹分子生物學研究。
weikang@tricaas.com

