結直腸癌患者腸道菌群特點及對手術和化療的影響
平貫芳,熊萬成,賀德棟,赫 鵬
結直腸癌是消化系統較為常見的惡性腫瘤類型之一,其發生、發展與機體的免疫功能、腸道慢性炎癥以及飲食等因素有關。正常機體的腸道內存在種類與數量眾多的微生物群落,即腸道菌群,在與宿主的共同進化中,腸道菌群與機體形成了一個共生的穩態系統,可保護腸道上皮、減少炎性反應,對宿主的免疫穩態、生長、發育均有極為重要的作用[1-2]。
當腸道菌群失調時,其種類與數量上的平衡被打破,對機體的保護作用削弱,可導致宿主發生代謝異常以及其他疾病。腫瘤作為一種系統性復雜性疾病,與免疫和代謝等密切相關。研究顯示,腸道菌群與多種惡性腫瘤的發生、發展有關,已成為研究的熱點[3-4]。為探討腸道菌群在結直腸癌患者中的分布特點及其與臨床治療的關系,現報道如下。
1 材料與方法
1.1臨床資料采用前瞻性病例對照分析,選取2014年1月至2016年1月新鄉醫學院第一附屬醫院普外科就診的經病理學證實的結直腸癌患者136例,其中手術治療者82例,隨機分為A組、B組;保守治療者54例,隨機分為C組、D組。選取同期經我院體檢健康者100例為對照組。各組受試者年齡、性別資料差異無統計學意義(P>0.05),見表1。
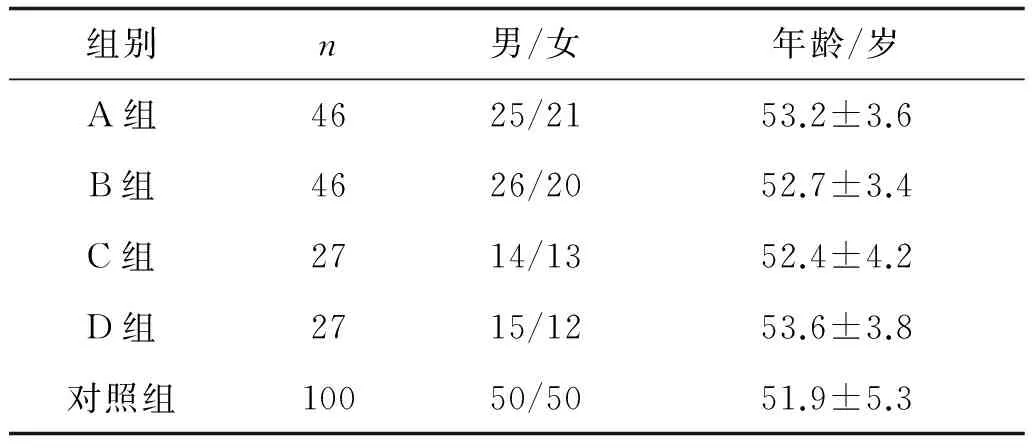
表1 各組受試者年齡、性別資料比較
1.2納入與排除標準
1.2.1結直腸癌組①經病理學診斷為結腸癌或直腸癌;②手術治療者為Ⅰ~Ⅲb期,保守患者為Ⅲc~Ⅳ期;③排除近1個月內服用微生態制劑者;④預期壽命>6個月。
1.2.2健康對照組①無消化道疾病;②排除近1個月內服用微生態制劑者。
1.3方法
1.3.1標本采集治療前和治療后排便通暢后,留取新鮮糞便3~5 g,無菌容器盛裝,立即送檢。對照組僅在研究初始階段留取糞便標本。
1.3.2指標檢測取新鮮糞便標本0.5 g,加入4.5 mL稀釋液,充分振蕩,10倍稀釋法連續稀釋至1 000 mL后,接種于各培養基進行培養。每種菌落在分離后進行鑒定,并計算出每克糞便中雙歧桿菌、類桿菌、梭桿菌、腸桿菌、腸球菌、乳桿菌的活菌數(CFU·g-1)。
1.3.3干預方法A組和C組在術后或化療開始階段口服腸道菌群調節藥物雙歧桿菌乳桿菌三聯活菌片(內蒙古雙奇藥業股份有限公司,國藥準字S19980004),2 g,每日3次,持續服用,療程不限。B組、D組及對照組未服用上述藥物。
1.4觀察指標手術患者術后隨訪12個月,記錄腫瘤復發和生存情況。保守患者治療后3個月,評估臨床療效;隨訪12個月,記錄生存情況。
1.5臨床療效標準化療療效參照WHO實體瘤客觀療效標準[5],①完全緩解(complete response,CR):可見病灶完全消失,且至少維持4周;②部分緩解(partial response,PR):瘤體水平最大徑與垂直最大徑乘積較前縮小>50%,且至少維持4周;③疾病穩定(stable disease,SD):瘤體兩徑乘積較前縮小<50%,或較前增大≤25%,且未見新病灶出現;④疾病進展(progressive disease,PD):病灶的兩徑乘積增大>25%,或出現新轉移灶。有效(response rate,RR)=CR+PR,疾病控制率(disease control rate,DCR)=CR+PR+SD。
1.6統計學方法采用SPSS19.0軟件,治療前后比較采用配對樣本t檢驗,多組間比較采用單因素方差分析,兩組間比較采用SNK方法,計數資料行χ2檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1各組腸道菌群比較治療前A、B、C、D組患者較對照組腸道中乳酸桿菌、雙歧桿菌、類桿菌數量減少(均P<0.05),而腸桿菌、腸球菌、梭桿菌增多(均P<0.05)。治療后,A、B組腸道中乳酸桿菌、雙歧桿菌、類桿菌數量較前增加(均P<0.05),而腸桿菌、腸球菌、梭桿菌較治療前減少(均P<0.05);C、D組及對照組上述菌種數量未見明顯變化,見表2-3。
2.2雙歧桿菌乳桿菌三聯活菌治療與結直腸癌臨床療效比較①結直腸癌治療有效率(RR)比較:治療后3個月,C組CR 8例,PR 11例,SD 6例,PD 2例,RR為70.4%,DCR為88.9%。D組CR 4例,PR 7例,SD 7例,PD 9例,RR為40.7%,DCR為66.7%。C組RR和DCR均優于D組(均P<0.05)。②腫瘤復發率比較:隨訪12個月,A組復發4例(9.8%),B組復發12例(29.3%)。A組復發率低于B組(P<0.05)。③截止隨訪結束,A組死亡3例(7.3%),B組死亡6例(14.6%),C組死亡7例(25.9%),D組死亡16例(59.3%)。A、B組死亡率無統計學差異(P>0.05),但D組死亡率高于C組(P<0.05)。
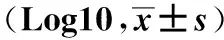
表2 治療前各組受試者糞便中不同菌種數目 CFU·g-1
注:①與對照組比較,P<0.05。A組:手術治療+雙歧桿菌乳桿菌三聯活菌片;B組:手術治療;C組:保守治療+雙歧桿菌乳桿菌三聯活菌片;D組:保守治療。
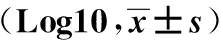
表3 治療后各組受試者糞便中不同菌種數目 CFU·g-1
注:①與B組比較,P<0.05;②與D組比較,P<0.05。A組:手術治療+雙歧桿菌乳桿菌三聯活菌片;B組:手術治療;C組:保守治療+雙歧桿菌乳桿菌三聯活菌片;D組:保守治療。
3 討論
腸道微生態包括細菌、真菌、原生動物,是指在腸道這個特殊微生態環境內寄居的全部微生物。腸道菌群對宿主人體的物質代謝、消化吸收和免疫防御均可產生影響,且互相制約、互相依存,形成一個相對穩定的生態平衡,維持正常免疫耐受,促進免疫系統的形成和穩定,參與機體的多項生理活動[4]。惡性腫瘤的產生與機體的免疫功能具有緊密關系,而腸道菌群對維持人體的正常免疫功能具有重要的作用。研究證實,腸道菌群與動物腸道惡性腫瘤的發生有關,且通過調節腸道菌群可影響治療效果[6-7]。
本研究中,通過對結直腸癌患者糞便中不同腸道菌群數進行檢測,結果顯示其乳酸桿菌、雙歧桿菌、類桿菌數量較正常人群減少,而腸桿菌、腸球菌、梭桿菌增多。研究認為,結直腸癌患者腸道中的腸桿菌能夠產生活性氧、活性氮、亞硝基化合物、β-葡萄糖醛酸酶以及精胺氧化酶等多種有毒代謝產物,上述物質可誘導腸道黏膜細胞DNA損傷,進而誘發結直腸癌變[8-9]。此外,腸上皮細胞內DNA錯配修復蛋白是修復腸道細胞損傷的主要物質,而致病性大腸桿菌(NC101)可編碼聚酮肽基因毒素“Colibactin”,導致其表達下調,進而引起DNA損傷,誘發腫瘤[10]。Candela等對結直腸癌患者進行研究顯示,腫瘤局部炎癥因子的水平與梭桿菌數量呈正相關,且癌組織在細菌多樣性上表現出總體下降,而梭桿菌、芽孢桿菌、柔嫩梭菌等機會致病菌明顯多于癌旁組織[11]。結直腸癌患者腸道內乳酸桿菌、雙歧桿菌、類桿菌數量較正常人群減少可能是誘發腫瘤的另一原因。Vetizou等研究顯示,對于惡性黑色素瘤小鼠,口服雙歧桿菌可獲得與PD-L1單克隆抗體相似的治療效果,聯合應用效果更佳[12]。
雙歧桿菌可通過增強樹突細胞的功能、激活CD8+T細胞,提高機體抗腫瘤免疫反應,而長期攝入富含乳酸桿菌的食物可降低結直腸癌的發生風險[13]。本研究對不同治療方案的結直腸癌患者口服雙歧桿菌乳桿菌三聯活菌片調節腸道菌群,其腸道中乳酸桿菌、雙歧桿菌、類桿菌數量較前增加,而腸桿菌、腸球菌、梭桿菌較前減少。治療后3個月,保守治療患者中,服用調節腸道菌群藥物的患者治療有效率優于未服用者。對于手術患者,隨訪12個月,服用調節腸道菌群藥物的患者復發率也低于未服用者。提示通過調節腸道菌群平衡,可能有助于提高機體免疫功能,進而提高機體抗腫瘤能力,改善預后。
總之,結直腸癌是較為常見的消化道惡性腫瘤,結直腸癌患者存在明顯的腸道菌群失調,調節腸道菌群有助于提高結直腸癌的治療效果及降低其腫瘤復發率。但由于本研究納入病例及隨訪時間的局限性,故研究結果可能存在一定偏倚,有待于繼續深入研究。
[1] GaglianiN,Hu B,Huber S,et al.The fire within: microbes inflame tumors[J].Cell,2014,157(4):776-783.
[2] Zitvogel L,Galluzzi L,Viaud S,et al.Cancer and the gut microbiota: an unexpected link[J].Sci Transl Med,2015,7(271):1-10.
[3] Shanahan F.The colonic microbiota in health and disease[J].Curr Opin Gastroenterol,2013,29(1): 49-54.
[4] Perez-Chanona E,Trinchieri G.The role of microbiota in cancer therapy[J]. Curr Opin Immunol,2016,4(39):75-81.
[5] Hershman D,Jacobson JS,McBride R,et al.Effectiveness of platinum-based chemotherapy among elderly patients with advanced ovarian cancer[J].Gynecol Oncol,2004,94(2):540-549.
[6] Iida N,Dzutsev A,Stewart CA,et al.Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment[J].Science,2013,342(6161):967-970.
[7] Viaud S,Saccheri F,Mignot G,et al.The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide[J].Science,2013,342(6161):971-976.
[8] Goodwin AC,Destefano Shields CE,Wu S,et al.Polyamine catabolism contributes to enterotoxigenic bacteroides fragilis-induced colon tumorigenesis[J].Proc Natl Acad Sci U S A,2011,108(37):15354-15359.
[9] Azcarate-Peril MA,Sikes M,Bruno-Barcena JM.The intestinal microbiota,gastrointestinal environment and colorectal cancer: a putative role for probiotics in prevention of colorectal cancer [J].Am J Physiol Gastrointest Liver Physiol,2011,301(3):401-424.
[10]Cao H,Luo S,Xu M,et al.The secondary bile acid,deoxycholate accelerates intestinal adenoma-adenocarcinoma sequence in Apc (min/+) mice through enhancing Wnt signaling[J].Fam Cancer,2014,13(4):563-571.
[11]Candela M,Tur Roni S,Biagi E,et al.Inflammation and colorectal cancer,when microbiota-host mutualism breaks[J].World J Gastroenterol,2014,20(4):908-922.
[12]Vetizou M,Pitt JM,Daillere R,et al.Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota[J].Science,2015,350(6264):1079-1084.
[13]Pala V,Sieri S,Berrino F,et al.Yogurt consumption and risk of colorectal cancer in the Italian European prospective investigation into cancer and nutrition cohort[J].Int J Cancer,2011,129(11):2712-2719.

