瑞舒伐他汀對ox-LDL 誘導的內皮細胞損傷中Sphk1/S1P/NF-κB信號通路的影響
王曉楠 周 葉 于曉紅 高 越
(杭州市第一人民醫院老年病科,浙江 杭州 310006)
瑞舒伐他汀對ox-LDL 誘導的內皮細胞損傷中Sphk1/S1P/NF-κB信號通路的影響
王曉楠 周 葉 于曉紅 高 越
(杭州市第一人民醫院老年病科,浙江 杭州 310006)
目的 探討經氧化低密度脂蛋白(ox-LDL)刺激后,人臍靜脈內皮細胞鞘氨醇激酶(Sphk)1、1-磷酸鞘氨醇(S1P)、基質金屬蛋白酶(MMP)-3、核轉錄因子(NF)-κB p65表達的變化及瑞舒伐他汀(Rt)對ox-LDL 誘導的內皮細胞損傷中Sphk1-S1P信號通路的影響。方法 實驗分為空白對照組,ox-LDL(50 μg/ml)處理組,Rt(0.1、1、10 μg/ml)干預組,RT-PCR檢測細胞Sphk1、S1P、 MMP-3因子水平;Western印跡檢測細胞NF-κB p65蛋白表達;觀察藥物干預后細胞Sphk1、S1P、MMP-3、NF-κB p65因子的變化。MTT檢測細胞增殖活性。結果 ox-LDL處理組細胞Sphk1、S1P、NF-κB p65、MMP-3的表達均顯著高于空白對照組(P<0.05),Rt各干預組較ox-LDL處理組降低(P<0.05)。ox-LDL處理組細胞增殖明顯受抑制,Rt各干預組細胞增殖率均較ox-LDL處理組顯著上升(P<0.001)。結論 Sphk1-S1P 信號傳導通路的激活,導致下游炎癥因子NF-κB p65、MMP-3 的高表達,參與ox-LDL 誘導的內皮細胞損傷過程,Rt可能通過抑制Sphk1/S1P 信號傳導通路介導的與炎癥有關的血管損傷,延緩動脈粥樣硬化的進程。
瑞舒伐他汀;動脈粥樣硬化;ox-LDL;Sphk1;S1P;NF-κB p65
動脈粥樣硬化(AS)是一種炎癥性疾病〔1〕,多種信號路徑對此炎癥反應有啟動、維持及抑制作用,其病理表現為血管內皮功能紊亂,單核/巨噬細胞侵入血管壁,吞噬脂質形成泡沫細胞;平滑肌細胞去分化,增殖趨化和遷移加強;血小板激活;粥樣斑塊內新生血管形成等。近年來研究發現,鞘氨醇激酶(Sphk)1、1-磷酸鞘氨醇(S1P)、核轉錄因子(NF)-κB p65信號通路在一些伴隨炎癥性疾病中表達,在炎癥、腫瘤、阿爾茨海默病中,S1P都是重要的細胞內靶點,它的作用比既往所了解的更復雜,對于疾病治療學的進展有重要影響〔2〕。在該信號通路中,NF-κB扮演了重要的炎癥“中介”作用,而Sphk1-S1P信號通路在調節細胞遷移、增殖、凋亡等過程中具有重要作用〔3,4〕,且S1P3受體可介導NF-κB激活和促進黏附分子表達〔5〕。本研究旨在觀察瑞舒伐他汀(Rt)對人臍靜脈內皮細胞損傷中Sphk1/S1P/NF-κB信號通路的影響,探討其抗As的可能靶點及機制。
1 材料與方法
1.1 試劑與材料 人臍靜脈內皮細胞株(HUVEC),Rt(Sigma),F12K培養液(Hyclone),胎牛血清(Hyclone),MTT(Sigma),0.25%胰酶(索來寶),DMSO(Sigma),SYBRGreen PCR試劑盒(Thermo F-415XL),逆轉錄試劑盒(Thermo #K1622),蛋白酶抑制套裝(Roche),BCA蛋白定量試劑盒(Thermo),HRP標記的二抗(聯科生物),NF-κB p65一抗(proteintech)等。
1.2 方法
1.2.1 細胞培養 HUVEC培養在10%胎牛血清DMEM液中,觀察ox-LDL及Rt對HUVEC中Sphk1、S1P、NF-κB p65、基質金屬蛋白酶(MMP)-3的表達及細胞增殖率的影響。
1.2.2 實驗分組 實驗分為空白對照組,ox-LDL處理組(50 μg/ml,與人臍靜脈內皮細胞共同培養24 h)、不同濃度Rt組(0.1、1、10 μg/ml Rt干預1 h,再與ox-LDL 50 μg/ml與HUVEC共同培養24 h)。
1.2.3 MTT檢測細胞增殖活性 HUVEC以5×103個/孔接種于96孔板,細胞培養板置于37℃,5%CO2培養箱過夜,按照質量比1∶1分別取siRNA與DMN納米微粒輕輕混勻。室溫靜置20 min,形成磁性納米顆粒復合物,在96孔板中每孔加入100 μl新鮮培養液和1 μl復合物并混勻,在37℃、5%CO2培養箱中的10、100、500 mT磁場下培養48 h;將96孔板進行MTT染色,λ=570 nm,測定OD值,計算各組細胞增殖率。
1.2.4 RT-PCR檢測 步驟遵循試劑盒說明書,純化HUVEC的RNA,配制RT反應液,反轉錄反應條件:37℃ 15 min,85℃ 5 s;引物設計:S1P正義5'-ACGCTGGACGATGGGTT-3',反義5'-CGCCGATGCTGAGGTTTA-3';MMP-3正義5'-AGTTTGCTCAGCCTATCC-3',反義5'-CTGTATGTAAGGTGGGTTT-3';Sphk1正義5'-GTGCCCGACGAGGACTTT-3',反義5'-CACGCAACCGCTGACCAT-3' ;反應體系:每孔板SYBR Premix Ex Taq 10 μl,PCR正義引物(10 μmol/L)1 μl,PCR反義引物(10 μmol/L)1 μl,cDNA模板1 μl,ddH2O 7 μl混合均勻;使用ABI7500RT-PCR儀,PCR板置于RT-PCR儀上進行PCR反應,預變性:95℃、30 s;40個循環:95℃ 5 s、60℃ 34 s;溶解曲線:95℃ 15 s、60℃ 1 min、95℃ 15 s。結果數據采用2-△△CT法進行分析。
1.2.5 Western印跡檢測 細胞轉染:HUVEC以1×105個/孔接種于6孔板中,置于37℃,5%CO2培養箱中培養過夜,取8 μg ST14高表達質粒(10 μl)加入至490 μl無血清的Opti-MEM中,混勻;取5 μl Lipo 2000溶于495 μl無血清的Opti-MEM中,混勻,在室溫下孵育5 min;將兩種混合物在室溫下孵育20 min形成復合物;取1 ml復合物分別加入6孔板,在37℃、5%CO2培養箱中培養6 h后棄上清液并正常培養,37℃、5%CO2培養箱中孵育48 h。細胞蛋白上清液的制備和濃度檢測:棄上清,磷酸鹽緩沖液(PBS)洗滌2次后每孔加入100 μl RIPA裂解液,收集裂解液離心后取部分上清蛋白用BCA蛋白定量試劑盒測定蛋白濃度。Western印跡檢測總蛋白中目的蛋白表達:行灌膠后,取各個處理組蛋白提取液,調整蛋白濃度為6 μg/μl和等體積2×上樣緩沖液混合,將上樣液于100℃沸水中煮沸5 min,再冰上驟冷,3 000 r/min離心1 min;每孔加上樣液15 μl,留一孔加10 μl預染的Marker。80 V恒壓電泳,約20 min,當指示劑溴酚藍進入分離膠后改用110 V恒壓電泳,當指示劑到達距凝膠下端約0.5 cm處時關閉電源,取出膠板;電泳即將結束前,預先將PVDF膜浸泡在甲醇中15 s,然后用ddH2O漂洗2 min,浸泡于轉移緩沖液中5 min后進行轉膜。轉膜結束后,快速取出PVDF膜,放入5%BSA室溫封閉2 h;于搖床上用TBST洗膜5 min×3次;孵育袋中加入TBST稀釋的NF-κB p65和β-actin 4℃孵育過夜;TBST洗膜5 min×3次,TBST洗膜10 min×3次。膜于化學發光檢測試劑反應至暗處出現亮條帶,暗室中用X膠片感光、顯影、定影。
1.3 統計學分析 采用SPSS13.0軟件行t檢驗。
2 結 果
2.1 各組HUVEC的增殖率比較 ox-LDL處理組HUVEC增殖〔(-24.14±0.18)%〕明顯受抑制,與空白對照組〔(100.00±0.11)%〕比較差異有統計學意義(P<0.001)。與ox-LDL處理組比較,Rt 0.1 μg/ml組細胞增殖率〔(12.67±0.20)%〕顯著上升;Rt 1 μg/ml和10 μg/ml組〔(24.88±0.13)%,(22.39±0.08)%〕也明顯上升,且1 μg/ml組增殖率最大,差異有統計學意義(P<0.001)。
2.2 各組HUVEC細胞中Sphk1、S1P、MMP-3的表達量比較 與空白對照組比較,ox-LDL處理組及Rt各劑量組Sphk1、S1P、MMP-3的表達量均升高。與ox-LDL處理組比較,Rt各劑量組細胞中Sphk1、S1P、MMP-3表達減低(P<0.05)。Rt 1、10 μg/ml組較Rt 0.1 μg/ml組S1P、MMP-3表達降低(P<0.05)。見表1。
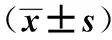
表1 各組細胞中S1P、MMP-3、 Sphk1基因的相對表達量比較
1)與空白對照組比較,2)與ox-LDL處理組比較,3)與Rt 0.1 μg/ml組比較:均P<0.05
2.3 各組HUVEC中NF-κB p65表達量比較 見圖1。與空白對照組(0.068 821)比較,ox-LDL處理組能顯著增強NF-κB p65的相對表達量(0.314 125);與ox-LDL處理組比較,Rt各劑量組NF-κB p65的相對表達量有所下降(Rt 0.1 μg/ml組:0.152 506,Rt 1 μg/ml組:0.112 706,Rt 10 μg/ml組:0.101 093),并且這種作用隨著Rt劑量的提高而加強。

1~5:空白對照組、ox-LDL處理組、Rt 0.1 μg/ml組、Rt 1 μg/ml組、Rt 10 μg/ml組圖1 各組細胞NF-κB p65的Western印跡結果
3 討 論
AS是一種慢性心血管疾病,高脂血癥、糖尿病,高血壓、吸煙等多種因素均可導致其發生,其發病機制是以脂質浸潤學說和損傷反應學說為基礎的炎癥理論〔6〕。AS 是脂質積累于動脈內壁而形成的局部斑塊的病理變化過程,主要經由炎癥反應介導,并伴有氧化應激的發生。多種炎癥因子之間的相互作用參與了AS的發生、發展、斑塊破裂、血栓形成的全過程。
Sphk1 是近年來發現的鞘脂代謝平衡的重要限速酶,Sphk1 催化反應的產物S1P 是一個同時具有細胞內第二信使和細胞外第一信使雙重功能的脂類生物活性分子。S1P促AS功能表現為:(1)由S1P3受體介導NF-κB激活和促進黏附分子表達〔5〕;(2)S1P協同凝血酶促進EC3組織因子表達〔7〕。冠脈阻塞患者血清S1P濃度升高,血清S1P水平升高是臨床冠脈狹窄發生和嚴重程度的強指針〔8〕。Alvarez等〔9〕研究發現S1P 通過特異性結合在TRAF2的N-末端RING功能域上,最終激活NF-κB 信號通路。同時有研究發現在AS部位和纖維斑塊部位均發現了激活的NF-κB,而正常的血管很少或沒有NF-κB表達,證明NF-κB 在AS的發生、發展過程中起重要作用〔10,11〕。NF-κB可以調節一系列基因的表達,并可介導MMPs等的產生。它是細胞因子、黏附分子和生長因子間重要的聯絡因子,可導致硬化斑塊的形成、生長和斑塊破裂。本研究表明,Sphk1-S1P 信號通路被異常激活可能參與了AS的病理進程。他汀類藥物屬于膽固醇生物合成抑制劑,具有降低ox-LDL 的作用,還具備減弱氧化應激和免疫反應的程度,提高內皮細胞功能,穩定動脈粥樣斑塊等〔12〕。多項臨床研究證實〔13,14〕,他汀類藥物具有多重的抗感染作用而并非單一的調脂功能。Rt通過抑制炎性趨化因子、黏附分子和炎性細胞因子的表達,降低C反應蛋白(CRP)表達水平,參與改善AS的病理過程。大量研究顯示,Rt通過多方面作用發揮抗感染效應:(1)能下調CD40L;(2)亦能通過上調單核細胞過氧化物酶體增殖激活受體(PPAR)-γ,進而下調MMP-9的表達,改善炎性反應;(3)可干預COX-2及前列腺素的合成〔15〕;(4)通過影響循環中單核細胞的TLR-4、CD14表達水平而下調CRP〔16〕。4.抑制INF-γ誘導的巨噬細胞表面主要組織相容抗原(MHC)Ⅱ的表達,并能抑制巨噬細胞表面刺激信號的表達〔17〕;(5)Sironi等〔18〕表明,在腦卒中模型大鼠中,使用Rt干預可降低MCP-1、TGF-β、IL-1、P-選擇素的表達水平,從而抑制炎癥反應;(6)另外,CCR2可被Rt下調,減輕炎性反應對內皮細胞的損傷作用。
本研究結果顯示Rt可通過抑制Sphk1/S1P/NF-κB信號通路,減輕炎癥反應,內皮細胞增殖,進而穩定AS斑塊,延緩AS斑塊的進展。同時也說明了他汀類藥物對抗AS炎性反應是通過多種途徑實現的。
1 Libby P,Ridker PM,Maseri A.Inflammation and atherosclerosis〔J〕.Circulation,2002;105(1):135-43.
2 Obinata H,Hla T.Sphingosine 1-phosphate in coagulation and inflammation〔J〕.Semin Immunopathol,2012;34(1):73-91.
3 Rosen H,Goetzl EJ.Sphingosine1-phosphate and its receptors:an autocrine and paracrine network〔J〕.Nat Rev Immunol,2005;5(7):560.
4 Maceyka M,Payne SG,Milstien S,etal.Sphingosine kinase,sphingosin-e-1 phosphate,and apoptosis〔J〕.Biochim Biophy Acta,2002;1585(2-3):193.
5 Kimura T,Tomura H,Mogi C,etal.Sphingosine 1-phosphate receptors mediate stimulatory and inhibitory signalings for expression of adhesion molecules in endothelial cells〔J〕.Cell Signal,2006;18(6):841-50.
6 邵文祥.Ox-LDL 在動脈粥樣硬化形成早期的作用機制〔D〕.南昌:南昌大學,2012.
7 Okajima F,Sato K,Kimura T.Anti-atherogenic actions of high-density lipoprotein through sphingosine 1-phosphate receptors and scavenger receptor class B type I〔J〕.Endocr J,2009;56(3):317-34.
8 Deutschman DH,Carstens JS,Klepper RL,etal.Predicting obstructive coronary artery disease with serum sphingosine-1-phosphate〔J〕.Am Heart J,2003;146(1):62-8.
9 Alvarez SE,Harikumar KB,Hait NC,etal.Sphingosine-1-phosphate is a missing cofactor for the E3 ubiquitin ligase TRAF2〔J〕.Nature,2010;465(7301):1084-8.
10 李 靜,孫 雷,莊永杰,等.單核細胞趨化蛋白-1 和核因子-κB 與巨噬細胞浸潤及動脈粥樣硬化斑塊形成的關系〔J〕.大連醫科大學學報,2007;19(1):14-6.
11 Morita M,Yano S,Yamaguchi T,etal.Advanced glycation end products-induced reactive oxygen species generation is partly through NF-kappa B activation in human aortic endothelial cells〔J〕.J Diabetes Comp,2013;27(1):11-5.
12 Liao JK.Clinical implications for statin pleiotropy〔J〕.Curr Opin Lipidol,2005;16(6):624-9.
13 Katsiki N,Athyros VG,Mikhailidis DP.Statin therapy and cardiovascular outcomes after coronary evascularization in the elderly〔J〕.Atherosclerosis,2015;238(2):182-4.
14 Gencer B,Auer R,Nanchen D,etal.Expected impact of applying new 2013 AHA/ACC cholesterol guidelines criteria on the recommended lipid target achievement after acute coronary syndromes〔J〕.Atherosclerosis,2014;239(1):118-24.
15 Ridker PM,Danielson E,Fonseca FA,etal.Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein〔J〕.N Engl J Med,2008;359(21):2195-207.
16 Coen PM,Flvnn MG,Markofski MM,etal.Adding exercise to rosuvastatin treatment:influence on C-reactive protein,monocyte toll-like receptor 4 expression,and inflammatory monocyte (CD14CD16)population〔J〕.Metabolism,2010;59(12):1775-83.
17 Radigan KA,Urich D,Misharin AV,etal.The effect of rosuvastatin in a murine model of influenza A infection〔J〕.PLoS One,2012;7(4):e35788.
18 Sironi L,Gianazza E,Gelosa P,etal.Rosuvastatin,but not simvastatin,provide end-organ protection in stroke-prone rats by anti-inflammatory effects〔J〕.Arterioscler Thromb Vasc Biol,2005;25(3):598-603.
〔2016-12-17修回〕
(編輯 滕欣航)
杭州市衛生科技計劃項目(2013A17)
高 越(1967-),男,教授,主要從事老年病研究。
王曉楠(1974-),女,碩士,副主任醫師,主要從事老年心血管病研究。
R54
A
1005-9202(2017)08-1897-03;
10.3969/j.issn.1005-9202.2017.08.032

