8-異前列腺素、血管內皮素在慢性阻塞性肺疾病急性加重合并肺動脈高壓患者中的應用價值
朱立成, 尚云飛
(南通大學附屬南通第三醫院 呼吸科, 江蘇 南通, 226000)
?
8-異前列腺素、血管內皮素在慢性阻塞性肺疾病急性加重合并肺動脈高壓患者中的應用價值
朱立成, 尚云飛
(南通大學附屬南通第三醫院 呼吸科, 江蘇 南通, 226000)
目的 探討8-異前列腺素、血管內皮素(ET-1)聯合檢測在慢性阻塞性肺疾病急性加重(AECOPD)合并肺動脈高壓(PAH)患者中的價值。方法 將40例AECOPD合并PAH患者按隨機數字表法分為治療組和對照組。另取20例AECOPD不合并PAH的患者作為對照,根據肺動脈壓力水平進行分組,分析各組間的相關性及指標變化情況。結果 單純AECOPD組與合并PAH組患者血清中8-iso-PG、內皮素(ET-1)水平存在顯著差異(P<0.01)。相關分析結果顯示, AECOPD合并PAH組中8-iso-PG、ET-1水平與FEV1、FVC、p(CO2)無相關性(P>0.05), 與p(O2)呈線性負相關(P<0.05), 與肺動脈壓力呈正相關(P<0.05)。不同肺動脈壓力組血清8-iso-PG及ET-1水平差異有統計學意義(P<0.05)。治療組及對照組血清中8-iso-PG、ET-1均顯著降低, FEV1、FVC較治療前水平顯著上升(P<0.05), PASP水平顯著下降(P<0.05)。結論 8-iso-PG可以作為一個氧化應激的良好標記物,聯合檢測8-iso-PG、ET-1可以作為AECOPD合并PAH病情程度及治療評估的良好指標。
8-異前列腺素; 血管內皮素; 慢性阻塞性肺疾病; 肺動脈高壓; 氧化應激; N-乙酰半胱氨酸
慢性阻塞性肺疾病(COPD)是呼吸科常見的慢性反復發作性疾病,嚴重影響患者的生命質量[1]。8-異前列腺素(8-iso-PG)僅在氧化應激水平升高時大量生成,是一種能夠準確穩定反映患者體內氧化應激狀態的特異性標記物[2]。血管內皮素在低氧性肺血管收縮、肺血管重構中發揮重要的調節作用,動物試驗[3-5]證明抑制氧化應激能夠改善肺血管重塑或者阻止肺動脈高壓的發展。本研究探討8-iso-PG、ET-1在慢性阻塞性肺疾病急性加重期(AECOPD)合并肺動脈高壓(PAH)病情檢測中的應用價值,現報告如下。
1 資料與方法
1.1 一般資料
選取2014年12月—2016年5月本院呼吸科住院的AECOPD合并PAH患者40例。使用隨機數字表法分為治療組、對照組各20例。治療組男15例,女5例,年齡52~82歲,平均年齡(72.87±7.31)歲,病程4~16年,平均(8.12±3.12)年; 對照組男16例,女4例,年齡53~81歲,平均(73.02±6.93)歲,病程3~15年,平均(7.92±2.86)年。2組患者一般資料無顯著差異(P>0.05),具有可比性。另選取20例住院部單純AECOPD不合并PAH的患者作為參照病例。診斷標準: ① 根據《慢性阻塞性肺疾病診治指南》(2013年修訂版)[1]中慢性阻塞性肺疾病診斷及急性加重期相關標準制定。② 年齡18~85歲。③ 肺動脈高壓診斷標準: 參照2009年歐洲心臟病學會(ESC)指南[6]: 以心超檢查中的PASP值分為3組,正常PAH組: PASP<35 mmHg; 輕度PAH組: PASP≥35~<50 mmHg; 中度PAH組: PASP≥50~<70 mmHg; 重度PAH組: PASP≥70 mmHg。④ 自愿加入并簽署知情同意書。排除標準: ① 合并其他慢性呼吸系統疾病,如肺栓塞、肺癌、支氣管哮喘等; ② 左心功能不全、心肌梗死、冠心病、房顫等心血管疾病; ③ 肝腎疾病,如慢性肝病及腎功能不全等疾病,精神異常者; ④ 內分泌及代謝系統疾病,如甲狀腺功能亢進等; ⑤ 其他惡性腫瘤疾病等; ⑥ 孕婦、哺乳期婦女、過敏體質者。
1.2 方法
所有入選患者均按《慢性阻塞性肺疾病診治指南》[1]并按照衛生部慢性阻塞性肺疾病臨床路徑管理方案給予吸氧、抗生素使用、抗炎解痙平喘、止咳化痰及糾正酸堿水電解質紊亂等常規治療。治療組在前常規治療的基礎上,使用較大劑量乙酰半胱氨酸泡騰片(富露施)600 mg,3次/d口服; 對照組僅給予常規治療,不給予乙酰半胱氨酸泡騰片。療程為14 d。
1.3 觀察項目
① 記錄患者年齡、性別等基本信息資料,治療前后常規檢查如血常規、肝腎功能、CRP、CRPH、PCT、凝血功能、血氣分析化驗指標,行胸部CT、心電圖、肺功能、心超等輔助檢查。② 8-iso-PG、血管內皮素ET-1的測定: 取清晨空腹肘靜脈血3 mL, 室溫靜置1 h后2 000 r/min離心15 min, 吸取血清于Ependof管中, -80 ℃冰箱保存待測。采用ELISA法測定血清中8-iso-PG和血管內皮素ET-1濃度。所有標本嚴格按照ELISA試劑盒說明書測定方法操作。③ 心臟彩超的測定: 采用彩色多普勒心超機測定三尖瓣最大返流速度(V),據簡化伯努利公式肺動脈收縮壓(PASP)=4V2+右心房壓。右心房增大時PASP=4V2+10, 右心房正常時PASP=4V2+5。
1.4 統計學分析
應用SPSS 22.0統計軟件分析數據,計量資料以均數±標準差表示,同組治療前后比較采用配對t檢驗,兩組間均數比較采用獨立t檢驗,相關性分析采用Pearson法,以P<0.05為差異有統計學意義。
2 結 果
單純AECOPD組血清8-iso-PG、ET-1水平分別為(22.42±1.68)、(75.04±3.95) ng/L,低于合并PAH組的(34.54±5.79)、(86.55±4.36) ng/L, 差異有統計學意義(P<0.01)。8-iso-PG、ET-1水平與FEV1、FVC、p(CO2)、p(O2)、PASP采用Pearson相關分析,結果顯示AECOPD合并PAH組中8-iso-PG、ET-1水平與肺功能中FEV1、FVC及血氣p(CO2)無相關性(P>0.05), 與p(O2)呈線性負相關(P<0.05),與肺動脈壓力呈正相關(r=0.462,P<0.01;r=0.397,P<0.05)。說明肺功能、血氣分析部分指標在病情評估中不能作為很好的評價指標,而8-iso-PG、ET-1與肺動脈壓力存在相關性可以作為參考。見表1。

表1 AECOPD合并PAH組中8-iso-PG、ET-1與相關臨床指標的相關性分析
重度PAH組血清8-iso-PG及ET-1水平均顯著高于單純AECOPD組及輕中度PAH組(P<0.05); 中度PAH組血清8-iso-PG及ET-1水平顯著高于合并輕度PAH組和單純AECOPD組(P<0.05); 合并輕度PAH組8-iso-PG及ET-1水平顯著高于單純AECOPD組(P<0.05)。見表2。2組治療前血清中8-iso-PG、ET-1比較差異無統計學意義(P>0.05); 治療后,2組血清中8-iso-PG、ET-1均顯著降低,且治療組顯著優于對照組(P<0.05), 見表3。2組治療前FEV1、FVC、PASP無顯著差異 (P>0.05); 治療后, 2組的FEV1、FVC較治療前顯著改善(P<0.05), PASP水平顯著下降(P<0.05),且治療組的改善結果顯著優于對照組(P<0.05)。見表4。

表2 4組研究對象血清中8-iso-PG、ET-1水平及PASP的比較
與單純AECOPD組比較, *P<0.05; 與合并輕度PAH組比較, #P<0.05; 與合并中度PAH組比較, △P<0.05。
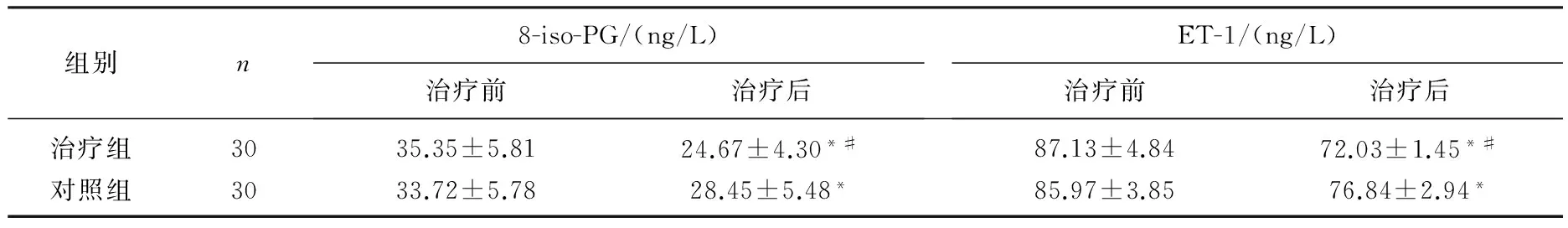
表3 2組治療前后血清中8-iso-PG、ET-1水平的比較
與治療前比較, *P<0.05; 與對照組比較, #P<0.05。

表4 2組治療前后FEV1、FVC、PASP的比較
與治療前比較, *P<0.05; 與對照組比較, #P<0.05。
3 討 論
氧化應激是COPD重要的發病機制,多種類型肺動脈高壓中也都存在著氧化應激狀態[7-11], 與肺血管重塑、肺血管調節失常均相關[2, 12-13], 伴隨著氧化應激的增加 ROS相應增加激活相關炎癥細胞,巨噬細胞釋放炎性介質,促進氣道上皮細胞損傷或平滑肌細胞增殖,這些影響最終可能形成氣流限制、氣道狹窄和血管重建,最終形成PAH的發生發展[14-17]。DeMarco等[3]做了氧化應激的動物模型,發現轉基因(mRren2)27大鼠肺動脈壓升高、肺血管重塑,而抑制氧化應激可以控制肺動脈高壓的發展。
8-iso-PG僅在氧化應激加重時大量生成,血清、尿、呼出氣均能檢測到,與肺動脈高壓的發病機制相關,故可以選為評價指標,內皮損傷是導致肺動脈重構的重要機制,肺血管重塑又可導致COPD肺動脈高壓,血漿內皮素水平與肺動脈高壓呈正相關[18],氧化應激又是低壓缺氧性肺動脈高壓及血管重塑的重要機制之一[19-22]。在選擇治療藥物方面,N-乙酰半胱氨酸(NAC)隨著其在臨床中越來越廣泛的使用和研究,不僅具有溶解痰液作用,而且還具有較強的抗氧化特性和細胞保護作用[23-25], 動物試驗中能降低缺氧后大鼠平均肺動脈壓及右心室收縮壓及改善肺血管重塑[26]。利用新生羊PAH模型, Teng等[5]發現應用N-乙酰半胱氨酸可有效降低羊肺動脈高壓內皮細胞凋亡數量,故理論上N-乙酰半胱氨酸有可能干預慢阻肺急性加重期合并肺動脈高壓患者的肺動脈壓水平。
本研究相關分析結果提示,肺功能、血氣分析部分指標在病情評估中的作用有限或不能很好應用,而8-iso-PG、ET-1水平與肺動脈壓力呈正相關,乙酰半胱氨酸泡騰片治療可以調整此類患者的氧化應激及血管內皮素水平,肺動脈壓力PASP得到改善, 8-iso-PG可以作為一個氧化應激的良好標記物,聯合監測8-iso-PG、ET-1可以作為AECOPD合并PAH病情程度的監測及治療評估的有效指標,對于疾病的早期診斷和預后判斷有著重要的臨床意義。 乙酰半胱氨酸泡騰片的作用理論上推測機制為通過抑制AECOPD合并PAH患者氧化應激水平改善了患者的肺血管重塑及肺血管收縮,進而可能改善了此類患者肺動脈高壓。
[1] 中華醫學會呼吸病學分會慢性阻塞性肺疾病學組. 慢性阻塞性肺疾病診治指南(2013年修訂版)[J]. 中華結核和呼吸雜志,2013, 36(4): 255-264.
[2] 陶學芳, 楊金榮, 鄭曉燕, 等. 慢性阻塞性肺疾病患者氧化應激與血清基質金屬蛋白酶9的關系及其在并發肺動脈高壓中的作用[J]. 浙江醫學, 2010, 32(12): 1795-1797.
[3] Demarco V G, Habibi J, Whaley-Connel A T, et al. Oxidative Stress contributes to pulmonary hypertension in the transgenic (mRen2)27 rat[J]. Am J Heart Circ Mol Physiol, 2008, 294(6): 2659-2668.
[4] 曾群麗, 李振華, 胡振紅, 等. 氧化應激在低壓缺氧性肺動脈高壓形成中的作用[J]. 臨床軍醫雜志, 2012, 40(4): 762-764.
[5] Teng R J, Eis A, Bakhutashvili I, et al. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297(1): l84-195.
[6] 徐凌, 柴晶晶, 蔡柏薔. 2009年歐洲呼吸學會和歐洲心臟病學會肺動脈高壓指南解讀[J]. 國際呼吸雜志, 2013, 30(8): 449-457.
[7] Stockley RA. Biomarkers in chronic obstructive pulmonary disease: confusing or useful?[J]. Int J Chron Obstruct Pulmon Dis, 2014, 9(1): 163-177.
[8] 王娜娜, 孟自力, 陳亮, 等. 慢性阻塞性肺疾病并發肺動脈高壓血清標志物研究[J]. 臨床肺科雜志, 2016, 21(6): 1051-1055.
[9] Peterson K M, Aly A, Lerman A, et al. Improved surviva1 of mesenchymal strom al cell after hypoxia preconditioning: role of oxidative stress[J]. Life Sei, 2011, 88(1/2): 65-73.
[10] Fuchs B, Dietrich A, Gudermann T, et al. The role of classical transient receptor potential channels in the regulation of hypoxie pulmonary vasoconstriction[J]. Adv Exp Med Biol, 2010, 661: 187-200.
[11] Brennan L A, Steinhorn R H, Wedgwood S, et al. Increased superoxide generation is associated with pulmonary hypertension in fetal lambs: a role of NADPH oxidase[J]. Circ Res, 2003, 92(6): 683-691.
[12] Doruk S, Ozyurt H, Inonu H, et al. Oxidative status in the lungs associated with tobacco smoke exposure[J]. Clin Chem Lab Med, 2011, 49(12): 2007-2012.
[13] 錢晨, 姚堅. 阿托伐他汀對肺心病患者血清中8-iso-PG水平的影響[J]. 臨床肺科雜志, 2014, 19(8): 1435-1437.
[14] Demareo V G, Whaley-Connell A T, Sowers J R, et al. Contribution of oxidative stress to pulmonary arterial hypertension[J]. World J Cardiol, 2010, 2(10): 316-324.
[15] Yen C H, Leu S, Lin Y C, et al. Sildenafil limits monocrotaline-induced pulmonary hypertension in rats through suppression of pulmonary vascular remodeling[J]. J Cardiovasc Pharmacol, 2010, 55(6): 574-584.
[16] Grobe A C, Wells S M, Benavidez E, et al. Increased oxidative stress in lambs with increased pulmonary blood flow and pulmonary hypertension: role of NADPH oxidase and endothelial NO synthase[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(6): 1069-1077.
[17] Wunderlich C, Schmeisser A, Heerwagen C, et al. Chronic NOS inhibition prevents adverse lung remodeling and pulmonary arterial hypertension in caveolin-1 knockout mice[J]. Pulm Pharmacol Ther, 2008, 21(3): 507-515.
[18] Bern R L, Mehta S, Kcosh A, et al. Sitaxsentan treatment for patients with pulmonary arterial hypertension discontinuing bosentan[J]. J Heart lung Transplant, 2007, 26(1): 63-69.
[19] Awad N, Khatib N, Ginsberg Y, et al. N-acetyl-cysteine(NAC) attenuates LPS-induced maternal and amniotic fluid oxidative stress and inflammatory responses in the preterm gestation[J]. Am J Obstet Gynecol, 2011, 204(5): e15-20.
[20] 高怡, 鐘麗萍, 謝慧玲, 等. 慢性阻塞性肺疾病患者心肺運動試驗安全性分析[J]. 中國實用內科雜志, 2013(S1): 85-85.
[21] 買尼沙木·亞生. 乙酰半胱氨酸輔助治療慢性阻塞性肺疾病急性加重期患者的療效及其對氧化應激、肺功能的影響[J]. 實用臨床醫藥雜志, 2014, 18(17): 47-51.
[22] 王惠霞, 魏勝全, 梁淑玲. 多沙普侖治療慢性阻塞性肺疾病急性加重期合并Ⅱ型呼吸衰竭患者的療效觀察[J]. 實用臨床醫藥雜志, 2014, 18(11): 118-120.
[23] 閻紅娥, 張堯, 鮑文華, 等. 慢性阻塞性肺疾病患者血清中IL-32、8-iso-PGF2α的變化及意義[J]. 黑龍江醫藥科學, 2014, 37(2): 6-7.
[24] 鐘小東, 陳學清, 王晨, 等. 右美托咪啶聯合舒芬太尼在ICU慢性阻塞性肺疾病急性加重期患者有創機械通氣中的應用[J]. 中華全科醫學, 2015(5): 766-768.
[25] 贠春梅, 劉華, 敬金煥. 丹參注射液聯合布地奈德/福莫特羅對老年AECOPD患者血氣指標、血液流變學、內皮細胞功能的影響[J]. 中華全科醫學, 2015, 13(7): 1057-1059.
[26] 史鵬, 安東善. 布地奈德混懸液和異丙托溴銨溶液霧化吸入治療慢性阻塞性肺疾病急性加重期臨床觀察[J]. 吉林醫學, 2012, 33(31): 6740-6741.
Value of 8-iso-PG and endothelin detections in treatment of patients with acute exacerbation of chronic obstructive pulmonary disease complicated with pulmonary hypertension
ZHU Licheng, SHANG Yunfei
(DepartmentofRespiratory,NantongThirdHospitalAffiliatedtoNantongUniversity,Nantong,Jiangsu, 226006)
Objective To explore the value of 8-iso-PG and endothelin (ET-1) detections in treatment of patients with acute exacerbation of chronic obstructive pulmonary disease (AECOPD) complicated with pulmonary hypertension (PAH). Methods A total of 40 AECOPD patients with pulmonary hypertension were randomly divided into treatment group and control group, another 20 COPD patients without pulmonary hypertension were selected as control group. According to the level of pulmonary arterial pressure, the patients were divided into subgroups, and correlation and changes of indexes were compared among groups. Results There were significant differences between the AECOPD group and combined PAH group in serum 8-iso-PG and endothelin levels (P<0.01). Correlation analysis showed that the levels of 8-iso-PG and ET-1 in the combined PAH group were not correlated with FVC,p(CO2) and FEV1(P>0.05), but there was a negative linear correlation withp(O2) and was positively correlated with pulmonary artery pressure (P<0.05). There were significant differences in 8-iso-PG and ET-1 levels among different PAH groups (P<0.01). After treatment, levels of ET-1 and 8-iso-PG significantly reduced, FEV1and FVC significantly increased (P<0.05), and the level of PASP reduced significantly in treatment group and control group (P<0.05). Conclusion 8-iso-PG can be used as a good marker of oxidative stress, and the combined detection of 8-iso-PG and ET-1 can be used as a good index for evaluating the severity and treatment of patients with AECOPD and PAH.
8-iso-PG; ET-1; chronic obstructive pulmonary disease; pulmonary hypertension; oxidative stress; N-acetylcysteine
2017-01-18
R 441.8
A
1672-2353(2017)09-035-04
10.7619/jcmp.201709009

