腺苷酸激活蛋白激酶與肥胖大鼠肝臟脂質沉積的關系
龔美蓉 陳鳳麗 曹 晨 孫亦農
(南京中醫藥大學第二臨床醫學院,江蘇 南京 210023)
腺苷酸激活蛋白激酶與肥胖大鼠肝臟脂質沉積的關系
龔美蓉 陳鳳麗 曹 晨 孫亦農
(南京中醫藥大學第二臨床醫學院,江蘇 南京 210023)
目的 探討肥胖大鼠肝臟組織腺苷酸激活蛋白激酶(AMPK)的表達及其對肝臟脂質沉積的影響。方法 選用18只剛斷乳的SPF級SD雄性大鼠,隨機挑選6只普通飼料喂養為正常組,另一組12只高脂飼料喂養,12 w后成功建立肥胖模型大鼠6只。分別檢測體重、Lee指數、內臟脂肪、肝濕重等指標。通過油紅O染色和檢測肝臟甘油三酯(TG)、總膽固醇(TC)含量評估兩組大鼠肝臟脂質沉積的情況。采用Western印跡檢測大鼠肝臟磷酸化(p)-AMPK/AMPK、p-ACC/ACC水平。結果 與正常組大鼠相比,肥胖組大鼠體重與Lee指數、附睪脂肪、腎周脂肪量、肝濕重、肝臟內TG與TC含量均顯著升高,油紅O染色結果顯示肥胖組肝臟脂質沉積較正常組明顯增多。Western印跡結果顯示,與正常組大鼠比較,肥胖組大鼠肝臟p-AMPK/AMPK和p-ACC/ACC表達明顯降低。兩組大鼠肝臟組織中p-AMPK、p-ACC表達水平與肝臟TG、TC呈負相關。結論 高脂飲食誘導食源性肥胖大鼠可降低AMPK的活性,從而導致肝臟組織TG、TC合成增加,脂質在肝臟組織中沉積增加。
腺苷酸激活蛋白激酶;脂質沉積
中老年人的肥胖發病率隨著年齡的增長而明顯升高。肝臟作為機體重要的代謝器官,肥胖患者易出現肝臟脂質異位沉積,從而導致肝臟脂代謝紊亂〔1〕。腺苷酸激活蛋白激酶(AMPK)是一種絲/蘇氨酸蛋白激酶,在機體中廣泛存在。AMPK是調節脂代謝的重要靶點,也成為防治肥胖的一個新靶點〔2〕。本研究觀察高脂飲食誘導的肥胖大鼠肝臟中AMPK活性及脂質沉積相關指標的變化,并探討二者之間的關系。
1 材料與方法
1.1 實驗動物 選用18只剛斷乳的SPF級SD雄性大鼠,體重約70 g,購于上海斯萊克實驗動物有限責任公司(動物許可證號:SCXK(滬)2012-0002)。
1.2 儀器與試劑 高速低溫離心機、核酸蛋白測定儀(Eppendorf公司),酶標儀(Biotek公司),冰凍切片機(Leica公司),垂直電泳槽與濕轉儀(Bio-RAD公司),甘油三酯(TG)試劑盒、總膽固醇(TC)試劑盒(南京建成),油紅O染料(Sigma),一抗〔磷酸化(p)-AMPK/AMPK,p-ACC/ACC;cell signaling〕,二抗(cell signaling)。
1.3 肥胖大鼠模型的建立 參照孫志等〔3〕提供的實驗性肥胖造模方法,將所有大鼠予以普通飼料適應性喂養1 w,隨機挑選6只,用普通飼料喂養,納入正常組;另一組12只,用蘇州雙獅實驗動物飼料科技有限公司提供的高脂飼料喂養12 w,將體重超過普食組20%的大鼠定為肥胖大鼠模型,成功建立肥胖模型6只,納入肥胖組。大鼠自由攝食飲水,每周稱重一次。
1.4 標本采集 12 w喂養結束后,禁食過夜,處死大鼠,分離并秤取附睪脂肪、腎周脂肪、肝臟質量。肝臟組織迅速置于液氮中冷凍后,-80℃保存待測。
1.5 氯仿-甲醇法測定肝臟中TG、TC 取肝臟組織100 mg置于勻漿器中,加入緩沖液1 ml(氯仿∶甲醇=2∶1)勻漿,充分后將勻漿液放到2 ml EP管中室溫過夜。再加入0.6%NaCl混勻后常溫離心2 000 r/min、10 min,分層為水相和有機相,將有機相轉移至新的EP管中,加入250 μl乙醇溶解。根據相應試劑盒指導操作,測定肝臟組織中TG、TC含量。
1.6 油紅O染色 制作大鼠肝臟組織冰凍切片,厚約30 μm,室溫干燥30~60 min,將切片浸入60%異丙醇中5 min后,油紅O染色10 min,置于60℃烘箱中。60%異丙醇中漂洗50 s,磷酸鹽緩沖液(PBS)漂洗3次。蘇木素染色3 min,自來水漂洗3 min,觀察到返藍即可取出。置于雙氧水(ddH2O)中甘油封片,光學顯微鏡下觀察。
1.7 Western印跡檢測蛋白水平 稱取肝臟組織100 mg,加入1 ml RIPA試劑(裂解液,PMSF,磷酸酶抑制劑),置于冰上進行勻漿,組織細胞充分裂解后,4℃離心,12 000 r/min、30 min,取上清并分裝為500 μl,保持于-80℃冰箱中。用二喹啉甲酸(BCA)法測定上清液中蛋白含量。聚丙烯酰胺凝膠電泳分離,轉膜,分別加入一抗:p-AMPK/AMPK(1∶1 000)、抗p-ACC/ACC (1∶1 000)4℃過夜,PBST洗膜3次,封閉1 h;PBST洗膜3次,二抗(1∶2 000)常溫孵育2 h;PBST洗膜3次,用化學增強發光法(ECL)試劑盒進行發光檢測。用Adobe Photoshop CS5圖像分析軟件測定目的蛋白條帶與對照蛋白條帶的面積與灰度值,計算各蛋白的相對表達量。
1.8 統計學方法 應用SPSS16.0軟件,兩組間比較采用兩個獨立樣本t檢驗,相關性分析采用Pearson相關檢驗。
2 結 果
2.1 兩組大鼠體重、體長、Lee指數的比較 高脂喂養結束時,與正常組相比,肥胖組的體重與Lee指數顯著升高(P<0.01)。見表1。
2.2 兩組大鼠不同部位脂肪量與肝濕重的比較 肥胖組大鼠附睪脂肪、腎周脂肪量明顯高于正常組大鼠(P<0.01)。與正常組相比,肥胖組的肝濕重顯著升高(P<0.01)。肝臟指數兩組大鼠之間差異無統計學意義(P>0.05)。見表2。
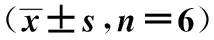
表1 兩組大鼠體重、體長、Lee指數的比較
與正常組比較:1)P<0.01;下表同
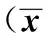
表2 兩組大鼠脂肪量及肝濕重的比較±s,n=6)
2.3 兩組大鼠肝臟脂質含量的比較 與正常組相比,肥胖組肝臟內TG與TC的含量顯著升高(P<0.01)。見表3。

表3 兩組大鼠肝臟脂質含量的比較
2.4 兩組大鼠肝臟脂質沉積的比較 與正常組相比,肥胖組大鼠肝臟脂滴明顯增多,可以清晰地看到細胞質中脂滴被油紅O染成紅色,分布在細胞質中,表明肝臟細胞中出現脂質沉積。見圖1。

圖1 兩組大鼠肝臟脂質沉積(×40,油紅O)
2.5 兩組大鼠肝臟組織AMPK活性比較 與正常組(設為1)相比,肥胖組肝臟中p-AMPK/AMPK水平(0.52±0.05)顯著下降(P<0.01)。見圖2。
2.6 兩組大鼠肝臟組織ACC的活性比較 與正常組(設為1)相比,肥胖組肝臟中p-ACC/ACC水平(0.67±0.01)顯著下降(P<0.01)。見圖3。

圖2 兩組大鼠肝臟AMPK磷酸化水平比較

圖3 兩組大鼠肝臟ACC磷酸化水平的比較
2.7 AMPK活性與肝臟脂質指標、p-ACC的相關性分析 兩組大鼠肝臟組織中p-AMPK與肝臟TG、TCL呈負相關(r=-0.6,P<0.01;r=-0.34,P<0.05),與p-ACC呈正相關(r=0.982,P<0.01)。p-ACC與肝臟TG、TC呈負相關(r=-0.6,P<0.01;r=-0.602,P<0.01)。
3 討 論
肥胖時機體能量代謝與能量調控出現紊亂,導致體內脂肪堆積過多或分布異常〔4〕;其發病機制復雜,涉及的因素包括遺傳、精神、內分泌、環境等〔5〕。AMPK是一種絲/蘇氨酸蛋白激酶,在真核細胞廣泛存在〔6〕,因其被AMP/ATP比值調控,準確地開啟ATP分解、關閉ATP合成,因此被比喻為“細胞能量調節器”〔7〕。肝臟中AMPK被激活可抑制脂肪酸的合成,促進脂肪酸的氧化分解;反之,AMPK去磷酸化失去活性,機體脂質合成增加。當AMP /ATP 比值增加(如細胞缺氧、饑餓、運動等因素的影響),AMPK因其172 位Thr 磷酸化而被激活〔8〕。
肥胖病與能量代謝的平衡失調密切相關。Wang等〔9〕發現,ob/ob小鼠心肌p-AMPK水平明顯下降,當使用藥物之后,心肌中p-AMPK水平上升,可改善異位脂質沉積。高脂飲食可以誘導肥胖癥、胰島素抵抗等疾病的發生〔10〕。本研究結果提示肥胖大鼠出現明顯的脂代謝紊亂,肥胖大鼠肝臟中明顯出現了脂質沉積。此外,肥胖組大鼠肝臟組織中p-AMPK表達顯著降低,提示長期高脂飲食降低了大鼠肝臟組織中的AMPK活性。同時觀察到肥胖組大鼠p-ACC表達顯著降低,ACC的催化活性增加,促進脂肪酸的合成。
有研究表明ACC是脂肪酸合成的關鍵酶,是AMPK的重要底物,激活的AMPK可使ACC的79位蘇氨酸磷酸化,抑制ACC的催化活性,從而降低丙二酰輔酶A 的濃度進而抑制脂肪酸的合成〔11〕。推測高脂飲食喂養的大鼠p-AMPK表達下降,從而引起AMPK活性降低,使得p-ACC表達下降,ACC的催化活性增加一方面促進了脂肪酸的合成作用〔12〕,另一方面在ACC作用下合成的丙二酰輔酶A增加,可抑制線粒體中CPT-1 的活性,使進入線粒體中進行β氧化的長鏈乙酰輔酶A含量降低,抑制脂肪酸氧化,促使大鼠肝臟脂質沉積增加,形成肥胖〔13〕。肝臟細胞中TG與TCL含量增加,會引起肝臟細胞對胰島素的敏感性與反應性降低,容易引發2型糖尿病〔14〕。
綜上所述,AMPK是調節脂代謝的重要靶點,也成為防治肥胖的一個新靶點。研究開發AMPK激動劑、激活AMPK活性,將會是一個有效的防治肥胖的治療方案。
1 任 華,衣雪潔.長期有氧運動對肥胖大鼠肝臟LKB1-AMPK-ACC信號傳導通路的影響〔J〕.沈陽體育學院學報,2015;4:92-7.
2 Imai K,Inukai K,Ikegami Y,etal.LKB1,an upstream AMPK kinase,regulates glucose and lipid metabolism in cultured liver and muscle cells〔J〕.Biochem Biophys Res Commun,2006;351(3):595-601.
3 孫 志,張中成,劉志誠.營養性肥胖動物模型的實驗研究〔J〕.中國藥理學通報,2002;18(4):466-7.
4 Hamre K.Obesity:multiple factors contribute〔J〕.Nature,2013;493(7433):480.
5 Morton GJ,Cummings DE,Baskin DG,etal.Central nervous system control of food intake and body weight〔J〕.Nature,2006;443(7109):289-95.
6 Winder WW.Energy-sensing and signaling by AMP-activated protein kinase in skeletal muscle〔J〕.J Appli Physiol,2001;91(3):1017-28.
7 Hardie DG,Schaffer BE,Brunet A.AMPK:An energy-sensing pathway with multiple inputs and outputs〔J〕.Trends Cell Biol,2016;26(3):190-201.
8 Hardie DG,Ashford ML.AMPK:regulating energy balance at the cellular and whole body levels〔J〕.Physiology (Bethesda),2014;29(2):99-107.
9 Wang MY,Unger RH.Role of PP2C in cardiac lipid accumulation in obese rodents and its prevention by troglitazone〔J〕.Am J Physiol Endocrinol Metab,2005;288(1):E216-E221.
10 肖海濤,裴曉萌,李 顯,等.高脂飼料誘導的肥胖傾向和肥胖抵抗傾向大鼠內臟脂肪visfatin和AMPK表達及其相互關系〔J〕.中國運動醫學雜志,2008;27(2):170-3.
11 Pan CH,Tsai CH,Lin WH,etal.Ethanolic extract of vitis thunbergii exhibits lipid lowering properties via modulation of the AMPK-ACC pathway in hypercholesterolemic rabbits〔J〕.Evid Based Complement Alternat Med,2012;2012(8):436786.
12 Zhao ZS,Lee YJ,Kim SK,etal.Malonyl-CoA decarboxylase(MCD)and acetyl-CoA carboxylase(ACC)may not be regulated by AMP-activated protein kinase(AMPK)in high-fat fed prediabetic OLETF rat treated with PPAR-gamma and alpha agonists〔J〕.Diabetes,2004;53:A562.
13 Kim MK,Kim SH,Yu HS,etal.The effect of clozapine on the AMPK-ACC-CPT1 pathway in the rat frontal cortex〔J〕.Int J Neuropsychopharmacol,2012;15(7):907-17.
14 Cool B,Zinker B,Chiou W,etal.Identification and characterization of a small molecule AMPK activator that treats key components of type 2 diabetes and the metabolic syndrome〔J〕.Cell Metab,2006;3(6):403-16.
〔2016-11-15修回〕
(編輯 袁左鳴)
Expression of AMP-activated protein kinase in the liver and the relationship with lipid deposition
GONG Mei-Rong, CHEN Feng-Li, CAO Chen,etal.
The Second Clinical Medical College, Nanjing University of Chinese Medicine, Nanjing 210023, Jiangsu, China
Objective To explore the expressions of AMP-activated protein kinase in the liver and the relationship with lipid deposition.Methods 18 SPF SD male rats were chosen and then randomly divided into normal (n=6) and high-fat groups (n=12). After successful modeling, 6 rats were in obese group (n=6). Rat weight, visceral fat and liver weight were compared. Lipid deposition was evaluated by oil red O dye and total cholesterol (TC) and triglyceride (TG) were measured. The expression of AMP activated protein kinase (AMPK) and acetyl-CoA carboxylase (ACC) in the liver were measured by Western blot.Results Compared with those of normal group, body weight, epididymal fat, perirenal fat, liver weight, TG and TC levels in the liver of obese group were significantly increased . The lipid deposition in the liver of obese rat was significantly increased compared with that of normal group. The phosphorylation AMPK (pAMPK) and ACC (pACC) were decreased in the liver of the obese group. The expression of pAMPK and pACC were negatively correlated with TG and TC level in the liver.Conclusions High-fat diet could induce obese, and then reduce AMPK activity, increase TG and TC level in the liver and result in lipid deposition in the liver.
AMPK; Obese rat; Lipid deposition
國家自然科學基金 (81202742,81403481,81403114)
龔美蓉(1973-),女,博士,助理研究員,主要從事針刺減肥理論及實驗研究。
R589.2
A
1005-9202(2017)11-2603-03;
10.3969/j.issn.1005-9202.2017.11.002

