《原子核外電子的運動》教學中有關問題的探討
周婕

摘 要:《原子核外電子的運動》(蘇教版選修3)的內容純理論部分,十分抽象,盡管教學的要求有限,讓學生弄懂和運用這些知識決非易事。教學過程中學生往往難以理解,似懂非懂,在中學階段且無法用實驗來驗證。怎樣用淺顯易懂的方法幫助學生理解和掌握這部分知識?筆者在教學過程中重點對以下幾個問題進行討論和強化,頗有效果,記錄于后,以饗讀者。
關鍵詞:電子云;能層;能級;構造原理;幾種表達式
中圖分類號:G633.7文獻標識碼:A 文章編號:1992-7711(2017)12-007-2
一、電子云到底是什么?
電子云決不是電子在運動中產生的云霧,電子在核外運動過程中是不產生云霧的。電子是一種微觀粒子,在原子極小的空間(直徑約10-10米)內作高速運動。核外電子的運動與宏觀物體運動不同,沒有確定的方向和軌跡,只能用電子云描述它在原子核外空間某處出現機會的大小。
對宏觀物體的運動,例如火車在軌道上奔馳,人造衛星按一定軌道圍繞地球運行,都可以測定或根據一定的數據計算出它們在某一時刻所在的位置和速度,并能描繪出它們的運動軌跡。而核外電子在核外空間所處的位置及其運動速度不能同時準確地確定,也就是不能描繪出它的運動軌跡。在量子力學中采用統計的方法,即對一個電子多次的行為或許多電子的一次行為進行總的研究,可以統計出電子在核外空間某單位體積中出現機會的多少,這個機會在數學上稱為概率密度。例如氫原子核外有一個電子,這個電子在核外好像是毫無規則地運動,一會兒在這里出現,一會兒在那里出現,但是對這個電子的千百萬次運動狀態統計而言,電子在核外空間的運動是有規律的,在一個球形區域里經常出現,如一團帶負電荷的云霧,籠罩在原子核的周圍,人們將其稱之為電子云。倘若有一高速攝像機跟蹤電子并拍攝運動過程,將拍攝后的映像重疊便可得到電子云圖像。從圖像可看出,電子總是繞核作高速無規則運動,且近核區域出現頻率最大,遠核區域出現機會較少,也可以說,電子云是電子繞核運動過程中的概率分布圖。有一點須強調,電子云上的小黑點決不是電子數,而是電子在核外某個區域運動中留下的痕跡。
例1.氫原子的電子云圖中,小黑點離原子核近的區域較密,它表示( )
A.該區域電子較多
B.該區域電子出現的概率較大
C.電子只在該區域運動
D.電子在該區域運動速度快
答案:B
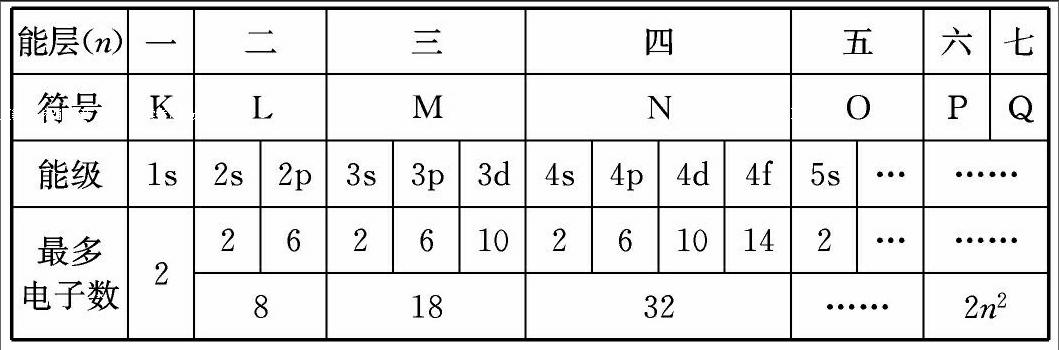
二、怎樣理解能層(電子層)?
能層又稱電子層,它是用來描述核外多電子的原子其電子運動情況的。在含有多個電子的原子中,各個電子的自身能量是不相等的,但能量相近是完全可能的,因此我們把能量相近的一組電子置于同一能層上運動,所以就有了能層(電子層)的出現。從離核的距離由近及遠分別為K、L、M、N、O、P、Q(或一、二、三、四、五、六、七層)。隨著人類對世界的不斷探索,如果又發現了若干種新元素,則能層將繼續擴大至R,S,T……(八、九、十層……)。就好像根據我們同學各自接受教育的年份和知識儲備一樣分為小學、初中、高中、大學等學段。電子自身能量最低的一組電子只能在近核的最內層運動,依能量從低到高序列,進入離核由近到遠的不同區域運動。同理,電子自身能量最高的一組電子在最遠核區域即最外能層上運動,在最外能層上運動的電子是得還是失,決定其元素的化學性質。能層(電子層)的層數由核外電子的數目決定。
例2.下面關于原子核外電子的運動規律敘述正確的是( )
A.原子核外多電子是分層運動的
B.能量低的電子在離核遠的區域運動
C.所有電子在同一區域里運動
D.能量高的電子在離核遠的區域運動
答案:A、D
三、如何理解能級(電子亞層)?
能級又稱電子亞層,它是用來描述同一能層上電子運動狀態的,如上所述同一能層上的電子自身能量相近而并非相等,這些電子又是怎樣運動的?就好像我們都是高中學段,但又有高一、高二和高三之分。能層相當于高中部,能級只是高中部的某一個年級。同一能級又分為幾個種類,分別為s、p、d、f……,其能量依次升高,它們又叫做能級的原子軌道。這些能級的原子軌道又對應不同的形狀,ns能級為球形,np能級為紡錘形,nd能級為梅花瓣形,nf能級為不規則形,但不是每一能層均有相同種類的能級,能級的種類數由能層決定。例如:第一能層只有1s能級,第二能層有2s和2p能級,第三能層有3s、3p和3d能級,第四能層有4s、4p、4d和4f能級,原子軌道種類數與電子層序數相等,即第n層就有n種軌道。除了s電子云是球形外,其余能級的電子云都有方向,有幾個方向就有幾個軌道。s電子云是球形對稱的,只有1個軌道,p電子云在空間有x、y、z 3個伸展方向,所以有3個軌道,分別記作:px、py、pz。d電子云有5個伸展方向,有5個軌道,f電子云有7個伸展方向,有7個軌道。它們的能量完全相同,電子云形狀也基本相同。無論何種類型的軌道,一個軌道最多只能填充2個自旋方向相反的電子。
需要強調的是不同能層的相同能級,能層數越大,能量越高,例如:同為s能級,其能量1s<2s<3s<4s,同為p能級,其能量4p>3p>2p。
例3.下列有關說法正確的是( )
A.各能級的原子軌道數按s、p、d、f順序分別為1、3、5、7
B.各能層含有的電子數為一定為2n2
C.各能層的能級都是從s能級開始至f能級結束
D.同一能層上電子的能量一定相等
答案:A
四、關于構造原理的再提煉
原子核外的多電子按構造原理依次布入運動軌道,但由于能級能量會發生交錯的現象,例如:E3d>E4S;E6S 同樣又可以用數字組記憶為:1、22、33、434、545、6456、7567。這樣學生對于構造原理就易掌握,且書寫電子排布式時就不會出錯。 有一點須注意,在寫電子排布式時,絕不能把同一能層的不同能級分開寫,例如23號元素釩的電子排布式應寫成:V 1s22s22p63s23p63d34s2,決不能寫成:V 1s22s22p63s23p64s23d3,盡管排布時電子先進入4s軌道,再進入3d軌道。 五、關于核外電子的幾種表達式 1.原子結構示意圖 書寫簡單,十分明了,例如鈉原子結構示意圖中:,圓圈表示原子核,圓圈中的數字表示核電核數(質子數),弧形表示電子層,弧形上的數字表示該層的電子數,且能清晰地看出該元素原子核外有幾個電子層,最外層上有幾個電子,同時能推斷出該元素在周期表中位置。但該表示法局限性很大,它只能表示主族元素和0族元素,對于副族元素卻無能為力。 2.原子核外電子排布式 利用構造原理,按軌道能量從小到大(注意能量交錯現象)依次將電子排入軌道,在書寫過程中要注意兩個原理和一個規則,例如K 1s22s22p63s23p64s1,該表達式的優點在于周期表中的所有元素均適用,且通過電子排布式準確地推斷出該元素在周期表中位置,并推斷其性質。 3.軌道表示式 其原理和核外電子排布式相同,且形象地將電子運動軌道用小方框或小圓圈表示,直接用↑↓表示在這個軌道中的兩個電子的不同運動方向,直觀、形象。至于何種方式表示,按題意要求作出正確選擇。 《原子核外電子的運動》相關內容的掌握須通盤考慮,應用須周密思考,在電子排布過程中特別要注意一些特殊情況,只有多練、多思才能學好。

