追根求源
【摘要】提出從選定的零水準(zhǔn)出發(fā),通過追根求源,列舉出相關(guān)質(zhì)子轉(zhuǎn)移方程式,進(jìn)而書寫出混合溶液的質(zhì)子平衡式;并從試題命制角度進(jìn)行深入思考分析,分類歸納總結(jié),從而化難為易,實(shí)施意義教學(xué)。
【關(guān)鍵詞】混合溶液;質(zhì)子平衡式
質(zhì)子平衡式作為酸堿溶液中H+求算的基礎(chǔ),已成為電解質(zhì)溶液教學(xué)的重點(diǎn)和難點(diǎn),也是歷屆各地高考命題的熱點(diǎn)。對(duì)于只含一種溶質(zhì)的溶液,簡單的酸堿平衡體系(如CH3COOH溶液),電荷平衡式就是質(zhì)子平衡式;復(fù)雜酸堿平衡體系(如NaHCO3溶液),可通過聯(lián)立物料平衡式和電荷平衡式求得,還可以根據(jù)酸堿平衡體系的組成通過狀態(tài)對(duì)比直接書寫。然而,對(duì)于含有多種溶質(zhì)的酸堿平衡體系(如Na2CO3和NaHCO3的混合溶液),大學(xué)分析化學(xué)中介紹得很少,中學(xué)教材中更是沒有,但近幾年的高考和模擬試題中的出現(xiàn)率卻越來越高,目前解決此類問題時(shí)一般都是采用上述聯(lián)立方程的方法解決[1][2]。由于大家都已意識(shí)到這種方法存在耗時(shí)多、錯(cuò)誤率高、化學(xué)含義不明等不足,近日,解決此類問題的新的方法正在不斷被挖掘[3]。筆者學(xué)習(xí)后以為平衡式及推導(dǎo)過程化學(xué)含義不明等不足仍未得到很好解決,因而將已經(jīng)過一輪教學(xué)實(shí)踐的“追根求源直寫法”介紹給大家。筆者以為,通過追根求源,能實(shí)現(xiàn)混合溶液質(zhì)子平衡式的快速書寫,且書寫過程能很好地體現(xiàn)微粒觀、守恒觀等化學(xué)觀念。
一、基本思想
依據(jù)酸堿質(zhì)子理論,酸堿反應(yīng)的實(shí)質(zhì)是質(zhì)子的轉(zhuǎn)移,在酸堿反應(yīng)中,酸失去的質(zhì)子數(shù)與堿得到的質(zhì)子數(shù)一定相等,無論是單溶質(zhì)酸堿平衡體系,還是多溶質(zhì)酸堿平衡體系。因而,多溶質(zhì)酸堿平衡體系中存在的H+的量應(yīng)為失質(zhì)子物質(zhì)(即酸)提供質(zhì)子的量與得質(zhì)子物質(zhì)(即堿)消耗質(zhì)子的量之差,或體系中存在的OH-的量應(yīng)為堿提供OH-的量與酸消耗OH-的量之差。
二、基本步驟
第一步,選定零水準(zhǔn)。通常以溶液中大量存在的并參與質(zhì)子轉(zhuǎn)移的組分(一般為各溶質(zhì)和水)為零水準(zhǔn)。
第二步,確定質(zhì)子轉(zhuǎn)移。從零水準(zhǔn)出發(fā),寫出所有相關(guān)的得失H+或OH-的方程式。
第三步,書寫質(zhì)子平衡式。根據(jù)質(zhì)子得失守恒原則,依據(jù)上述基本思想建立等式,注意濃度前的系數(shù),得質(zhì)子的物質(zhì)比參考水準(zhǔn)多幾個(gè)H+,此物質(zhì)濃度前的系數(shù)即為幾;失質(zhì)子的物質(zhì)比參考水準(zhǔn)少幾個(gè)H+,此物質(zhì)濃度前的系數(shù)則為幾。得失OH-亦然。
三、方法舉例
(一)混合酸(堿)溶液
常見的混合酸溶液有強(qiáng)酸與強(qiáng)酸混合溶液,弱酸與弱酸混合溶液,強(qiáng)酸與弱酸混合溶液;常見的混合堿溶液有強(qiáng)堿與強(qiáng)堿混合溶液,弱堿與弱堿混合溶液,強(qiáng)堿與弱堿混合溶液等。
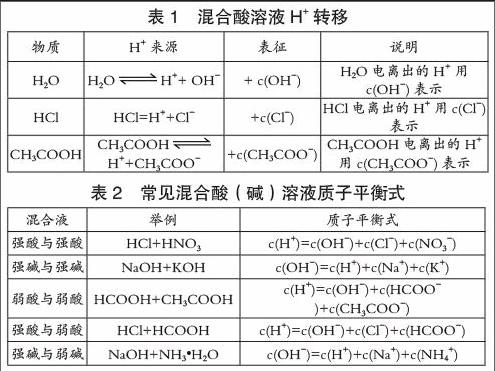
例1 試寫出c1mol/L HCl與c2mol/LCH3COOH混合溶液的質(zhì)子平衡式。
解析:選定零水準(zhǔn)為HCl、CH3COOH和H2O,提供H+的物質(zhì)及數(shù)目如表1所示。
質(zhì)子平衡式為:c(H+)= c(OH-)+ c(Cl-)+c(CH3COO-)
反思與命題策略:
(1)該類質(zhì)子平衡式形式上與電荷平衡式相同,但二者含義不同。
(2)命題時(shí)可根據(jù)HCl與CH3COOH之間的濃度關(guān)系進(jìn)行式變換,如當(dāng)c1=c2時(shí),c(Cl-)= c(CH3COO-)+ c(CH3COOH),將此物料守恒關(guān)系代入上述質(zhì)子平衡式,可得下列質(zhì)子平衡式變式:c(H+)= c(OH-)+ c(CH3COOH)+2c(CH3COO-)。
(3)其他常見混合酸(堿)溶液質(zhì)子平衡式如表2所示。
(二)強(qiáng)酸(堿)與強(qiáng)酸(堿)弱堿(酸)鹽混合溶液
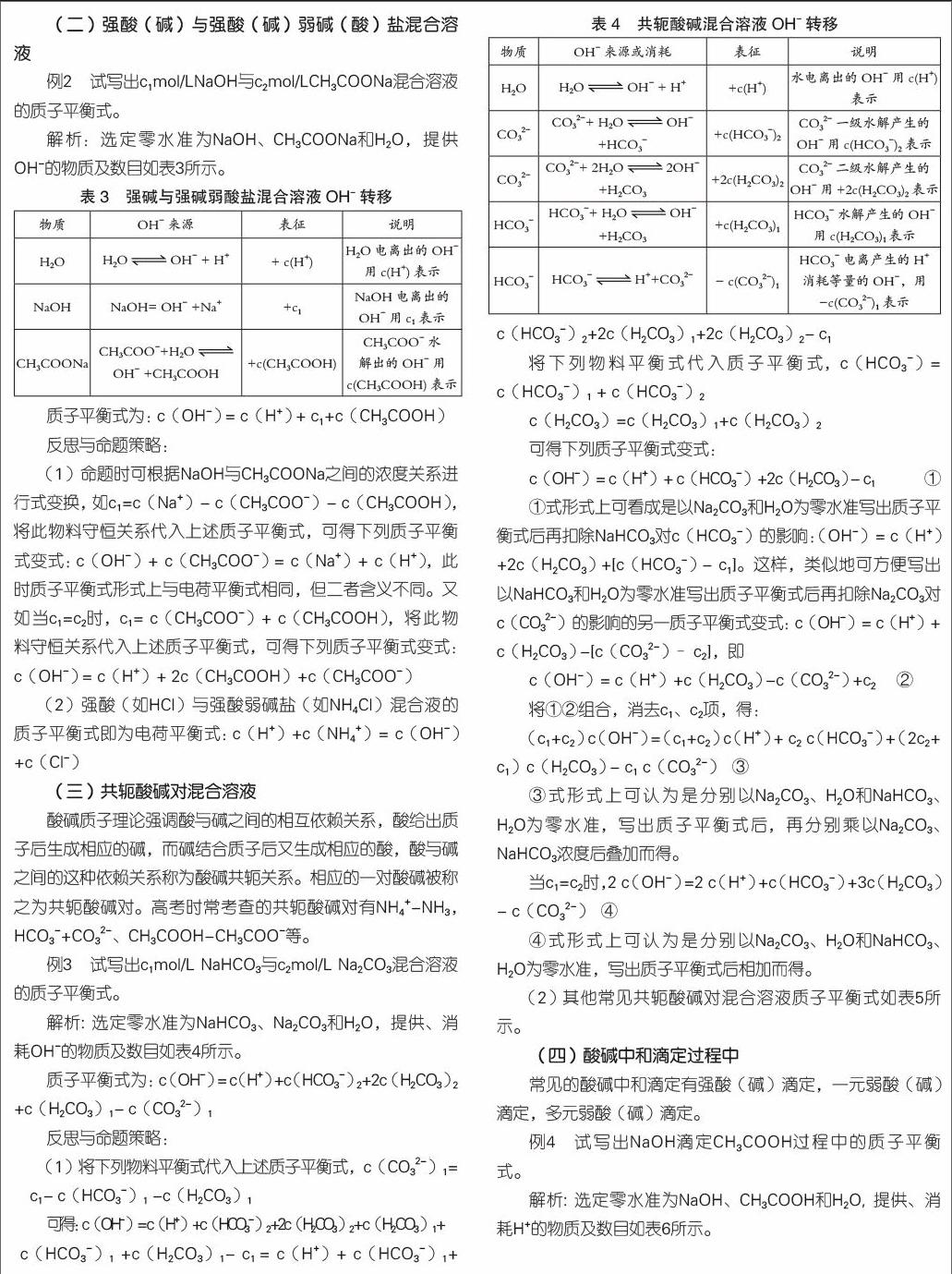
例2 試寫出c1mol/LNaOH與c2mol/LCH3COONa混合溶液的質(zhì)子平衡式。
解析:選定零水準(zhǔn)為NaOH、CH3COONa和H2O,提供OH-的物質(zhì)及數(shù)目如表3所示。
質(zhì)子平衡式為:c(OH-) = c(H+) + c1+c(CH3COOH)
反思與命題策略:
(1)命題時(shí)可根據(jù)NaOH與CH3COONa之間的濃度關(guān)系進(jìn)行式變換,如c1=c(Na+)- c(CH3COO-)- c(CH3COOH),將此物料守恒關(guān)系代入上述質(zhì)子平衡式,可得下列質(zhì)子平衡式變式:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+),此時(shí)質(zhì)子平衡式形式上與電荷平衡式相同,但二者含義不同。又如當(dāng)c1=c2時(shí),c1= c(CH3COO-)+ c(CH3COOH),將此物料守恒關(guān)系代入上述質(zhì)子平衡式,可得下列質(zhì)子平衡式變式: c(OH-) = c(H+)+ 2c(CH3COOH)+c(CH3COO-)
(2)強(qiáng)酸(如HCl)與強(qiáng)酸弱堿鹽(如NH4Cl)混合液的質(zhì)子平衡式即為電荷平衡式:c(H+)+c(NH4+)= c(OH-)+c(Cl-)
(三)共軛酸堿對(duì)混合溶液
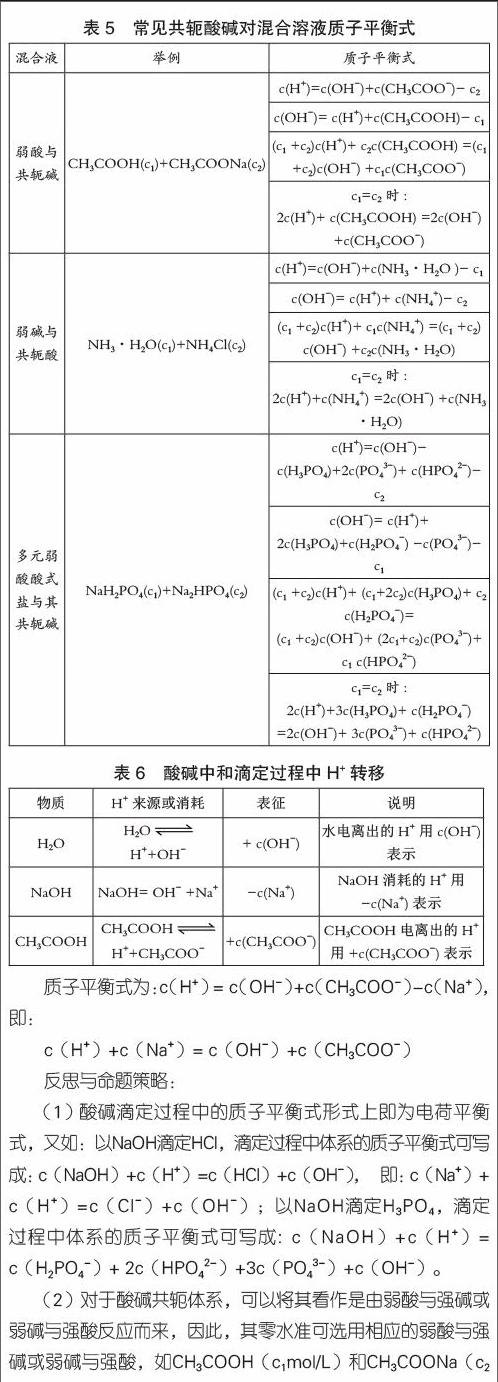
酸堿質(zhì)子理論強(qiáng)調(diào)酸與堿之間的相互依賴關(guān)系,酸給出質(zhì)子后生成相應(yīng)的堿,而堿結(jié)合質(zhì)子后又生成相應(yīng)的酸,酸與堿之間的這種依賴關(guān)系稱為酸堿共軛關(guān)系。相應(yīng)的一對(duì)酸堿被稱之為共軛酸堿對(duì)。高考時(shí)常考查的共軛酸堿對(duì)有NH4+-NH3,HCO3-+CO32-、CH3COOH-CH3COO-等。
例3 試寫出c1mol/L NaHCO3與c2mol/L Na2CO3混合溶液的質(zhì)子平衡式。
解析: 選定零水準(zhǔn)為NaHCO3、Na2CO3和H2O,提供、消耗OH-的物質(zhì)及數(shù)目如表4所示。
四、結(jié)束語
通過上述分析可以看出,書寫混合溶液的質(zhì)子平衡式關(guān)鍵是要仔細(xì)分析出體系中所有參與質(zhì)子轉(zhuǎn)移的反應(yīng)方程式,然后再結(jié)合H+或OH-的來龍去脈,直接書寫出有明確化學(xué)含義的質(zhì)子平衡式,有時(shí)還需結(jié)合試題情境作適當(dāng)變化。另外,從質(zhì)子平衡式書寫結(jié)果來看,可以歸納為兩類,如表7所示。
【參考文獻(xiàn)】
[1]曹旭琴.緩沖溶液中的離子平衡[J].化學(xué)教學(xué),2009(10):63-64.
[2]茆建軍.溶液中離子濃度大小比較的解題策略[J].化學(xué)教學(xué),2010(6):71-75.
[3]曾應(yīng)超.用組分分離法書寫混合溶液的質(zhì)子守恒式[J].化學(xué)教學(xué),2013(5):70-71.
作者簡介:
陳世明,中學(xué)高級(jí)教師。1990年8月至2011年8月在揚(yáng)中縣中工作;2011年8月至2014年8月在揚(yáng)中市新壩中學(xué)工作;2014年8月至今在揚(yáng)中市第二高級(jí)中學(xué)工作。揚(yáng)中市學(xué)科帶頭人、鎮(zhèn)江市骨干教師,江蘇省中小學(xué)優(yōu)秀班主任。

