易瑞沙與放療同期治療非小細胞肺癌腦轉移的臨床效果分析
滕 菲, 劉妙玲, 崔桂敏, 李延紅
(河北大學附屬醫院 放療科, 河北 保定, 071000)
易瑞沙與放療同期治療非小細胞肺癌腦轉移的臨床效果分析
滕 菲, 劉妙玲, 崔桂敏, 李延紅
(河北大學附屬醫院 放療科, 河北 保定, 071000)
目的 探討易瑞沙與放療同期治療非小細胞肺癌腦轉移的臨床效果。方法 選取非小細胞肺癌腦轉移患者78例,將患者隨機分為聯合組及常規組。所有患者均接受全腦放療及局部轉移灶放療。聯合組在放療基礎上服用易瑞沙250 mg, 1 次/d, 持續8周以上。比較2組的治療效果及不良反應。結果 聯合組患者的PR、RR及DCR均顯著高于常規組,而PD顯著低于常規組(P<0.05); 聯合組中,EGFR突變陽性患者有效率為91.30%, 顯著高于EGFR 突變陰性的62.50%(P<0.05)。聯合組治療后KPS評分、中位生存時間及生存率均顯著優于常規組(P<0.05); 聯合組痤瘡樣皮疹的發生率顯著高于常規組(P<0.05)。結論 易瑞沙聯合放療能夠提高NSCLC腦轉移患者的臨床療效、生活質量及生存期。
易瑞沙; 非小細胞肺癌; 腦轉移; 放療; 吉非替尼
在中國癌癥患者群體中, 70%以上肺癌是非小細胞肺癌(NSCLC)。NSCLC中早期患者在臨床上多采用手術或放射療法,但能夠根治的比例較低,大部分患者在早期進行手術病灶切除后,仍存在較高的遠期轉移復發風險[1]。原發性肺癌患者最常見的遠處轉移是腦轉移, NSCLC中腦轉移率約30%,預后較差,生存時間短[2]。由于血腦屏障限制了多數化療藥物的應用效果,因此臨床上多采用全腦放射療法、定向放療治療NSCLC患者,使得患者的中位生存時間(MST)提高到3~6個月[3-4]。分子靶向藥物是近幾年癌癥領域的研究熱點,其中較多研究[5]顯示,吉非替尼用于治療NSCLC患者的臨床療效確切,副反應輕,對 NSCLC 腦轉移有一定治療作用。有研究[6]認為吉非替尼可能對增強腦腫瘤放療反應的敏感性也有一定作用。本研究選取2014年1月—2015年12月本院診治的非小細胞肺癌腦轉移患者78例,探討Iressa聯合放療治療NSCLC的臨床療效,現報告如下。
1 資料與方法
1.1 一般資料
選取2014年1月—2015年12月本院診治的非小細胞肺癌腦轉移患者78例。將患者隨機分為聯合組及常規組。聯合組39例,男25例,年齡38~65歲,平均(57.2±3.1)歲; 吸煙21例; 轉移部位: 僅腦部9例,其他部位30例, EGFR 突變陽性23例。常規組39例,男23例,年齡36~65歲,平均(57.1±3.3)歲; 吸煙19例(48.72%); 轉移部位: 僅腦部8例,其他部位31例, EGFR 突變陽性21例。2組年齡、性別構成、EGFR 突變陽性等無顯著差異(P>0.05), 具有可比性。納入標準: ① 年齡≤65歲; ② 均經病理及影像學檢查確診; ③ 預計生存時間>1個月; ④ 病理確診為腺癌患者。排除標準: ① 藥物過敏或不能耐受治療者; ② 有手術治療史; ③年齡>65歲; ④ 存在其他嚴重器質性病變或有精神病史; ⑤ 非腺癌患者。
1.2 方法
所有患者均接受全腦放療及局部轉移灶放療,放射治療設備采用醫科達高能直線加速器,給予6 MV-X射線外照射,兩側野對穿照射, 1.5~2.0 Gy/次,每周5次,共3~4周,總劑量30~40 Gy。局部病灶縮野加量1.5~2.0 Gy/次,每周5次, 1.5~2周,總劑量15~20 Gy。聯合組在放療基礎上服用Iressa(阿斯利康制藥有限公司,國藥準字JX20030224), 250 mg/d, 口服,1次服用,持續8周以上。
1.3 療效評價
治療前后血清學檢查項目包括癌胚抗原(CEA)等指標。臨床療效分為疾病進展(PD)、穩定(SD)、部分緩解(PR)、完全緩解(CR), 參照WHO實體瘤療效評價標準(RECIST)[7]。評估2組患者12周后顱內轉移病灶的近期療效。將CR及PR患者統計入客觀有效率(RR), 而CR、PR及SD患者統計入疾病控制率(DCR)。生活質量評價參照KPS評分。
1.4 統計學分析
本研究中涉及的數據以SPSS 19.0進行處理,計量資料行t檢驗,計數資料行χ2檢驗,以Kaplan -Meier法進行平均生存時間分析,組間比較行Log-Rank時序檢驗。
2 結 果
2.1 治療12周后療效評價
治療過程中未見死亡病例,生存時間均超過12周。聯合組患者的PR(66.67%∶35.90%)、RR(79.49%∶51.28%)及DCR(94.87%∶74.36%)均高于常規組,而PD(5.13%∶25.64%)較低,差異有統計學意義(P<0.05), 見表1。聯合組中, EGFR 突變陽性患者有效率為91.30%(21/23), 而EGFR 突變陰性有效率為62.50%(10/16), 差異有統計學意義(P<0.05)。常規組中EGFR 突變陽性及陰性患者有效率分別為52.38%(11/21)、50.00%(9/18), 差異無統計學意義(P>0.05)。
2.2 治療前后血清 LTA、CEA變化
聯合組的CEA較治療前顯著下降,且顯著低于常規組(P<0.05), 見表2。
2.3 2組KPS評分及生存分析
本次隨訪時間3~15個月。聯合組的治療后KPS 評分、中位生存時間及生存率均顯著高于常規組(P<0.05), 見表3。
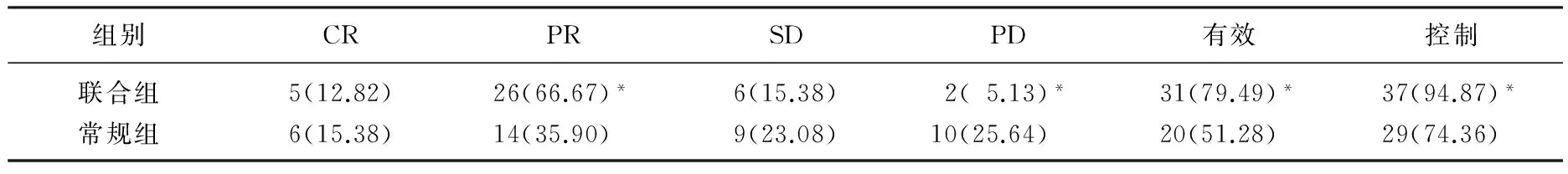
表1 聯合組與常規組患者治療12周后療效評價[n(%)]
與常規組比較, *P<0.05。
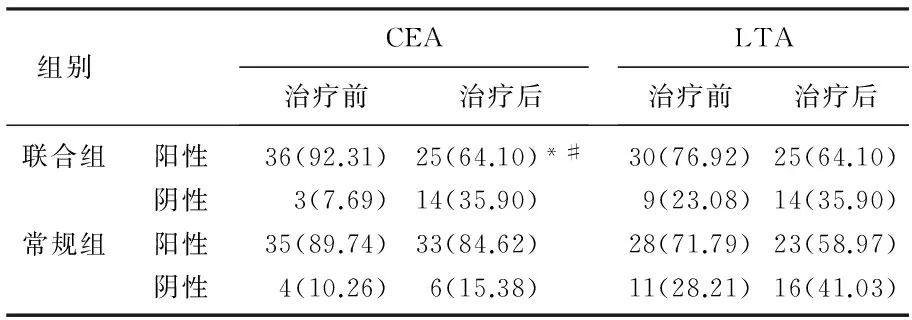
表2 患者治療前后血清 LTA、CEA變化[n(%)]
與治療前比較, *P<0.05; 與常規組比較, #P<0.05。

表3 聯合組與常規組患者KPS評分及生存分析
與常規組比較, *P<0.05。
2.4 治療后不良反應比較
聯合組的痤瘡樣皮疹的發生率顯著高于常規組(P<0.05), 見表4。
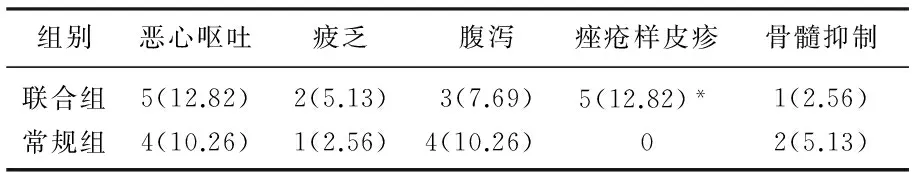
表4 聯合組及常規組治療后不良反應比較[n(%)]
與常規組比較, *P<0.05。
3 討 論
NSCLC在肺癌中比例較高,可達肺癌群體的70%~80%[8-9]。腦轉移是NSCLC患者發生遠處轉移的常見部位,相關流行病學統計[10]顯示,由于癥狀出現較為緩慢,有19.9%的 NSCLC 患者在初診時已經發生腦轉移。該類患者病變多處于中晚期,預后差,生存時間短。全腦放療則是目前用于治療顱內多發轉移病灶的標準方案,能在一定程度上提高患者的生存時間,但顱外其他病灶若不同時治療,則可能導致疾病進展。而少數肺癌腦轉移部位較為局限者,行手術、立體定向放射也可以達到良好的治療效果。
血腦屏障具有保護大腦免受外來有害物質經血液損傷腦組織的作用,但同時也限制了絕大多數放療藥物進入腦組織內發揮作用。臨床早期多采用鉑類藥物聯合放療為治療方式,但毒副作用強烈,多數患者難以耐受,生活質量低。吉非替尼能抑制表皮生長因子受體酪氨酸激酶的激活,從而抑制血管生成、促進腫瘤細胞凋亡[11]。 目前被列為晚期NSCLC治療的二、三線方案[12]。Liang等[13]研究顯示, NSCLC 患者行吉非替尼治療可有效提高生存期,其中位生存時間為9.5個月。多項研究[6, 14]顯示,吉非替尼能夠增強患者對放療的敏感性,從而提高療效。
吉非替尼應用于NSCLC 腦轉移的治療已有10多年,自Villano 等報道有效治療1例患者以來,大量相關研究[15-16]在臨床展開。本研究中,聯合組患者的PR、RR及DCR均顯著高于常規組,而PD顯著較低(P<0.05), 提示對NSCLC 腦轉移患者采取吉非替尼聯合放療方案能有效提高其臨床療效。聯合組治療后KPS 評分、中位生存時間及1年生存率均顯著優于常規組,表明吉非替尼聯合放療能提高患者生活質量,延長生存期,較放療有明顯的優勢。此外,痤瘡樣皮疹在聯合組發生率較高,為12.50%, 但患者耐受性較好,其他如骨髓抑制等毒副反應無明顯差異。而吉非替尼聯合放療的優點在于: ① 吉非替尼能少量透過血腦屏障,從而進入腦組織氣道治療作用; ② 吉非替尼可同時作用于顱內、外病灶,控制病情進展; ③ 放療對血腦屏障有一定破壞作用,增加了藥物透過率; ④ 吉非替尼的不良反應輕微,不增加患者負擔。
相關研究[17]顯示,血清 CEA在NSCLC 晚期患者中的表達水平較高,其陽性率可達 90%, 而有效治療后的 CEA 水平有所降低,因此認為CEA 水平可作為判斷晚期NSCLC 患者預后的有效指標。本研究中,聯合組治療后CEA陽性率降低,且低于常規組,反映出吉非替尼聯合放療可有效提高臨床療效。研究顯示,吉非替尼在不同人種中的敏感性存在較大差異,亞裔人群的敏感性較高,其中日本、中國等文獻[18-19]顯示EGFR 基因突變率在NSCLC患者中為20%~61%, 且與吉非替尼的療效存在相關性。因此可作為國內EGFR 敏感性突變患者的一線治療方案[20]。本次研究患者均經過 EGFR 基因檢測, EGFR 突變陽性率為55.70%(44/78), 其中聯合組EGFR突變陽性患者有效率顯著高于陰性患者(P<0.05), 提示EGFR 突變陽性的患者對吉非替尼治療敏感。
綜上所言,吉非替尼聯合放療治療NSCLC腦轉移能夠提高患者的臨床療效,并能夠提高其生活質量及生存期,同時吉非替尼對EGFR突變陽性患者療效較好。
[1] 強光亮, 郭永慶, 肖飛, 等. ⅢA-N2期非小細胞肺癌完全切除術后復發危險因素分析[J]. 中華醫學雜志, 2014, 94(41): 3239-3243.
[2] 黃忠連, 楊震, 李超. 非小細胞肺癌腦轉移放射治療的預后因素分析[J]. 安徽醫藥, 2012, 16(8): 1136-1139.
[3] Ma S, Xu Y, Deng Q, et al. Treatment of brain metastasis from non-small cell lung cancer with whole brain radiotherapy and Gefitinib in a Chinese population[J]. Lung Cancer, 2009, 65(2): 198-203.
[4] Morris P G, Reiner A S, Olga Rosenvald S, et al. Leptomeningeal metastasis from non-small cell lung cancer: survival and the impact of whole brain radiotherapy[J]. J Thorac Oncol, 2012, 7(2): 382-385.
[5] 楊揚, 李煩繁, 陳振東. 吉非替尼治療非小細胞肺癌生存期長于6個月患者的預后影響因素分析[J]. 安徽醫學, 2015, 36(2): 145-148.
[6] He S, Yin T, Li D, et al. Enhanced interaction between natural killer cells and lung cancer cells: involvement in gefitinib-mediated immunoregulation[J]. J Transl Med, 2013, 11(1): 1-11.
[7] Wolchok J D, Axel H, Steven O, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria[J]. Clin Cancer Res, 2009, 15(23): 7412-7420.
[8] Alessandro B, Francesco L, Giulia V, et al. Extended pneumonectomy for non-small cell lung cancer: morbidity, mortality, and long-term results[J]. J Thorac Cardiovasc Surg, 2007, 134(5): 1266-1272.
[9] Marco W, Lyudmila B, Rogier B, et al. Fluid biopsy for circulating tumor cell identification in patients with early-and late-stage non-small cell lung cancer: a glimpse into lung cancer biology[J]. Phys Biol, 2012, 9(1): 016005.
[10] 袁婕, 王捷忠. 非小細胞肺癌腦轉移放射治療進展[J]. 福建醫科大學學報, 2015(1): 62-66.
[11] Oh I J, Ban H J, Kim K S, et al. Retreatment of gefitinib in patients with non-small-cell lung cancer who previously controlled to gefitinib: A single-arm, open-label, phase II study[J]. Lung Cancer, 2012, 77(1): 121-127.
[12] 宋正波, 虞永峰, 陳智偉, 等. 晚期非小細胞肺癌吉非替尼二線和三線治療的療效比較[J]. 腫瘤, 2011, 31(1): 53-57.
[13] Liang S, Junfang T, Li T, et al. Risk of interstitial lung disease with gefitinib and erlotinib in advanced non-small cell lung cancer: a systematic review and meta-analysis of clinical trials[J]. Lung Cancer, 2014, 83(2): 231-239.
[14] Tomonobu K, Toshihiko A, Kayoko I, et al. Prospective study of gefitinib readministration after chemotherapy in patients with advanced non-small-cell lung cancer who previously responded to gefitinib[J]. Clin Lung Cancer, 2012, 13(6): 458-463.
[15] Zhengbo S, Yiping Z. Gefitinib and erlotinib for non-small cell lung cancer patients who fail to respond to radiotherapy for brain metastases[J]. J Clin Neurosci, 2014, 21(4): 591-595.
[16] 許建萍, 劉瀟衍, 楊晟, 等. 吉非替尼治療32例肺腺癌腦轉移的臨床經驗[J]. 中國肺癌雜志, 2015(9): 554-558.
[17] Jian W, Yun M, Zhi-Hua Z, et al. Expression and prognostic relevance of tumor carcinoembryonic antigen in stage IB non-small cell lung cancer[J]. J Thorac Dis, 2012, 4(5): 490-496.
[18] 林琳, 方平, 胡斌, 等. 非小細胞肺癌EGFR基因突變與吉非替尼療效的相關性研究[J]. 安徽醫學, 2012, 33(8): 947-950.
[19] Miyauchi E, Inoue A, Kobayashi K, et al. Efficacy of chemotherapy after first-line gefitinib therapy in EGFR mutation-positive advanced non-small cell lung cancer-data from a randomized Phase III study comparing gefitinib with carboplatin plus paclitaxel (NEJ002)[J]. Jpn J Clin Oncol, 2015, 45(7): 670-677.
[20] 金波, 張巖巍, 韓寶惠, 等. EGFR敏感突變的晚期肺腺癌一線放療與吉非替尼聯合治療的隨機對照研究[J]. 中國癌癥雜志, 2015(10): 761-767.
Clinical efficacy of iressa combined with radiotherapy in treatment of patients with non-small cell lung cancer and brain metastasis
TENG Fei, LIU Miaoling, CUI Guimin, LI Yanhong
(Department of Radiotherapy, The Affiliated Hospital of Hebei University, Baoding, Hebei, 071000)
Objective To explore the clinical efficacy of iressa combined with radiotherapy in treatment of patients with non-small cell lung cancer (NSCLC) and brain metastasis. Methods Totally 78 NSCLC patients with brain metastasis were selected and divided into combined group and conventional group. All the patients
whole brain radiotherapy and radiotherapy for local metastasis. The combined group was additionally treated with iressa 250 mg/d, one time per day, and this treatment lasted for more than 8 weeks. Effect and complications were compared between two groups. Results The PR rate, effective rate and disease control rate in the combined group were significantly higher than those in the conventional group, while the disease progression rate was significantly lower than the conventional group (P<0.05). In the combined group, the positive rate of EGFR mutation was 91.30%, which was significantly higher than 62.50% of the negative rate of EGFR mutation (P<0.05). The KPS score, mean survival time and survival rate after treatment in the combined group were significantly better than those in the conventional group (P<0.05). Conclusion Iressa combined with radiotherapy can effectively improve the clinical effect, the survival time and the quality of life in NSCLC patients with brain metastasis.
iressa; non-small cell lung cancer; brain metastasis; radiotherapy; gefitinib
2017-01-18
河北省石家莊市衛計委科技計劃項目(161460613)
劉妙玲
R 734.2
A
1672-2353(2017)15-088-04
10.7619/jcmp.201715024

