補骨脂酚經蛋白激酶Cε拮抗內皮細胞缺血再灌注損傷
王 壘,杜朝升,肖 軍,楊 健
(1軍委機關事務管理總局北極寺老干局門診部內科,北京 100191;2中國人民解放軍第518醫院內科;3中國人民解放軍第309醫院心血管內科;4中國人民解放軍第313醫院心血管內科;*通訊作者,E-mail:yangjian31313@126.com,#共同通訊作者,E-mail:xxxjjj6288@sina.com)
補骨脂酚經蛋白激酶Cε拮抗內皮細胞缺血再灌注損傷
王 壘1,杜朝升2,肖 軍3#,楊 健4*
(1軍委機關事務管理總局北極寺老干局門診部內科,北京 100191;2中國人民解放軍第518醫院內科;3中國人民解放軍第309醫院心血管內科;4中國人民解放軍第313醫院心血管內科;*通訊作者,E-mail:yangjian31313@126.com,#共同通訊作者,E-mail:xxxjjj6288@sina.com)
目的 研究補骨脂酚(BAK)對血管內皮細胞模擬缺血再灌注損傷(SIR)的保護作用及其分子機制。 方法 用不同濃度BAK(2,5,10 μmol/L)預處理體外培養的人臍靜脈內皮細胞(HUVECs)24 h,接受模擬缺血再灌注(SIR)損傷(缺血45 min,再灌注4 h),用CCK-8法和TUNEL法分別檢測細胞活力和凋亡率,酶活性測定法檢測培養液中乳酸脫氫酶(LDH)活性,細胞中丙二醛(MDA)的含量及超氧化物歧化酶(SOD)的活性,DHE熒光探針檢測細胞中活性氧(ROS)的含量,Western blot法檢測細胞膜PKCε、細胞質PKCε、Bcl-2、Bax、cleaved caspase 3和gp91phox蛋白的表達水平。使用PKCε特異性阻斷劑εV1-2阻斷該信號通路,進一步探究PKCε信號通路在其中的作用。 結果 BAK預處理呈劑量依賴性地改善內皮細胞SIR損傷,且10 μmol/L劑量效果最佳。BAK預處理可明顯提高缺血再灌注損傷后內皮細胞活力,減少LDH釋放,增強細胞中SOD活性,降低MDA含量及gp91phox蛋白表達量,減少ROS的產生;促進抗凋亡蛋白Bcl-2的表達,抑制凋亡蛋白cleaved caspase 3,Bax的表達,降低再灌注損傷后細胞凋亡率;并且顯著促進PKCε膜轉位,而特異性阻斷PKCε信號通路可逆轉BAK的上述保護作用(均P<0.05)。 結論 BAK通過激活PKCε信號通路,進而增強細胞抗氧化應激和抗凋亡能力,最終緩解內皮細胞缺血再灌注損傷。
補骨脂酚; 人臍靜脈內皮細胞; 缺血再灌注損傷; 蛋白激酶C epsilon; 氧化應激; 凋亡
缺血性心臟病嚴重危害當今社會人類生命健康,其首要治療策略是及時恢復缺血心肌的血流灌注,然而血流再灌注易加重心肌組織結構損傷及能量代謝障礙,誘發心肌缺血再灌注損傷[1, 2]。這種損傷可導致血流障礙、心功能異常、炎癥反應、內皮細胞損傷、心肌細胞壞死和凋亡等[3, 4]。
血管內皮細胞介于血液與組織間,發揮著屏障作用,同時具有多種生理功能,對維持內環境的穩定起著積極作用。在體、離體器官缺血再灌損傷模型以及缺氧處理分離培養的內皮細胞研究均表明:內皮細胞是缺血再灌注損傷的重要靶器官,缺血再灌注可引起內皮細胞代謝、功能的改變,進而引起內皮細胞損傷甚至死亡[5]。
補骨脂酚(bakuchiol,BAK)是從豆科植物補骨脂種子中提取的、含有酚基的單萜化合物[6],對皮膚和肝臟具有一定的保護作用[7-9]。國內外研究發現BAK具有抗氧化應激[10, 11]、抗炎[12]、抗衰老[9,10]、降糖降血脂[13]等藥理學作用。氧化應激和炎癥反應在缺血再灌注損傷中扮演重要角色[14-16],這表明BAK在減輕缺血再灌注損傷中可能發揮重要作用。同時,也有研究證實蛋白激酶Cε(protein kinase C epsilon,PKCε)是內皮細胞自我保護性通路的重要上游調節分子,發揮著重要的抗炎、抗氧化應激和凋亡的作用[17],然而其是否介導BAK抗內皮細胞缺血再灌注損傷尚未見報道。為此,本研究采用模擬缺血液建立內皮細胞缺血再灌注損傷模型(simulated ischemia reperfusion,SIR),觀察BAK對內皮細胞缺血再灌注損傷的保護作用,并初步探討PKCε信號通路在其中的作用,為將其開發為缺血性心肌病及其并發癥的治療藥物提供理論和實驗基礎。
1 材料和方法
1.1 細胞株及主要試劑
人臍靜脈內皮細胞(ScienCell公司,美國);補骨脂酚(BAK),DAPI染液和超氧化物陰離子熒光探針(DHE)(Sigma-Aldrich公司,美國);質膜分離試劑盒(Thermo scientific公司,美國);原位缺口末端標記法(TUNEL)檢測試劑盒(Roche公司,美國);乳酸脫氫酶(LDH)、超氧化物歧化酶(SOD)和丙二醛(MDA)檢測試劑盒(南京建成生物工程研究所);CCK8細胞毒性檢測試劑盒(上海七海復泰生物科技有限公司);anti-PKCε和anti-gp91phox抗體(Santa Cruz公司,美國);anti-Bcl-2、anti-Bax、anti-cleaved caspase 3抗體(Cell Signaling公司,美國);anti-β-actin抗體(CMCTAG公司,美國);辣根過氧化物酶標記的羊抗兔、羊抗鼠IgG二抗(北京中杉金橋生物技術有限公司)。
1.2 主要實驗儀器
滅菌型CO2細胞培養箱(Thermo,HEPA class 100);激光掃描共聚焦顯微鏡(Olympus,FV10C-W3)、倒置顯微鏡(Olympus,TH4-200);高速低溫離心機(Eppendorf,Centrifuge 5424 R);Western blot電泳、轉膜(Bio-Rad,#1658034)及凝膠成像設備(Bio-Rad,1708265);酶標儀(SpectraMax,M5)。
1.3 HUVECs的培養及缺血再灌注模型的建立
HUVECs的培養用含10%胎牛血清的完全培養液在37 ℃,5%CO2培養箱內培養;缺血再灌注損傷通過模擬缺血液實現。待將細胞接種于培養板或培養瓶后,棄掉培養液,加入缺血液(含CaCl2·2H2O 0.9 mmol/L、MgCl20.49 mmol/L、NaCl 137 mmol/L、KCl 12 mmol/L、HEPES 4 mmol/L、脫氧葡萄糖 10 mmol/L、連二亞硫酸鈉 0.75 mmol/L、乳酸鈉 20 mmol/L,pH值調至6.5)避光置于37 ℃,5% CO2的培養箱內培養45 min,模擬缺血結束后更換正常DMEM在培養箱中繼續孵育4 h完成再灌注。
1.4 CCK-8法檢測各組HUVECs活力
①為觀察BAK不同藥物濃度對內皮細胞缺血再灌注損傷后的作用,將實驗分為5組:Con組;SIR組;BAK 2 μmol/L+SIR組;BAK 5 μmol/L+SIR組;BAK 10 μmol/L+SIR組,在SIR損傷前,BAK藥物預處理時間為24 h。②為觀察PKCε信號通路是否介導BAK抗內皮細胞SIR損傷的作用,在BAK處理前用PKCε特異性阻斷劑εV1-2預處理1 h以阻斷PKCε通路,實驗分組如下:SIR組;BAK+SIR組;εV1-2+BAK+SIR組;εV1-2+SIR組,觀察εV1-2對BAK抗內皮細胞SIR損傷的影響,εV1-2濃度為10 μmol/L(已證實該濃度本身對SIR后細胞活力無明顯影響)。將內皮細胞接種于96孔板上,每組8個復孔,各組細胞處理結束后,吸凈培養液,用磷酸鹽緩沖液(PBS)清洗3次,再加入100 μl無血清培養液和10 μl CCK-8檢測液,避光置于培養箱繼續孵育2 h,用酶標儀檢測各孔OD值(450 nm波長下吸光度值)。
1.5 DHE熒光探針檢測ROS含量
將HUVECs接種于共聚焦皿和96孔板上,各組細胞處理結束后,吸凈培養液,用PBS清洗3次,用含有5 μmol/L的DHE的無血清培養液和細胞一起避光在培養箱孵育30 min,進行熒光探針裝載,隨后用無血清的培養液洗滌細胞3次,用酶標儀檢測各孔OD值(535 nm波長下吸光度值)并用激光掃描共聚焦顯微鏡照相。
1.6 細胞凋亡的TUNEL法檢測
各組細胞處理結束后,吸凈培養液,用PBS小心洗滌3次。4%多聚甲醛4 ℃固定30 min,PBS漂洗3次。用0.1%的Triton X-100打孔10 min,再用PBS洗滌3遍。按照TUNEL檢測試劑盒說明書將1號和2號液混合配制,避光滴加在細胞上,37 ℃孵育2 h,PBS振蕩洗滌3遍。DAPI液染細胞核避光37 ℃孵育10 min,PBS振蕩洗滌3次。激光掃描共聚焦顯微鏡照相。以凋亡細胞數(綠色熒光)占總細胞數(藍色熒光)的百分比(%)表示細胞凋亡率(apoptotic index)。
1.7 LDH、SOD活性及MDA含量檢測
各組處理結束后,分別收集培養液和內皮細胞,按照LDH試劑盒方法測定培養液中LDH 活性。用PBS作為勻漿介質破碎細胞后離心取上清,按照試劑盒說明書檢測細胞中SOD活性及MDA含量。
1.8 Western blot檢測細胞PKCε通路及相關蛋白表達水平
細胞總蛋白的提取:各組細胞處理結束后,用PBS清洗并置于冰上,加入RIPA裂解液及蛋白酶抑制劑混合物,充分震蕩混勻,冰上裂解20 min并收集,隨后以12 000 r/min離心20 min。細胞裂解上清用BCA法測定蛋白濃度進行蛋白定量。
細胞膜、細胞質蛋白的提取:參照Thermo公司質膜分離試劑盒的方法進行,分別提取HUVECs細胞質和細胞膜蛋白,用BCA方法測定蛋白濃度進行蛋白定量。各組蛋白經聚丙烯酰胺變性凝膠電泳(SDS-PAGE)分離,并用濕轉法轉移到聚偏二氟乙烯膜(PVDF膜),5%脫脂牛奶室溫封閉2 h,分別孵育在PKCε(1 ∶500)、gp91phox(1 ∶500)、Bcl-2(1 ∶1 000)、Bax(1 ∶1 000)、cleaved caspase 3(1 ∶1 000)、β-actin(1 ∶4 000)抗體中4 ℃過夜。TBST洗脫3次,加入對應辣根過氧化物酶標記的羊抗兔、羊抗鼠IgG二抗,室溫孵育2 h,TBST洗脫3次,通過Bio-Rad照相系統采集照片,用ImageLab軟件對其進行分析,以β-actin作為內參,分別檢測gp91phox、Bcl-2、Bax和cleaved caspase 3蛋白表達情況,以胞膜PKCε與胞質PKCε蛋白表達量之比來表示PKCε的膜轉位情況。
1.9 統計學分析
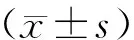
2 結果
2.1 補骨脂酚可減輕缺血再灌注后內皮細胞損傷及氧化應激水平
與Con組相比,SIR處理后HUVECs的存活率顯著降低, LDH的釋放量顯著增多,同時HUVECs損傷后貼壁能力明顯下降,脫落增加;并且SIR處理顯著降低了SOD活性,增加了MDA的含量(P<0.05);不同濃度的BAK預處理均可提高SIR損傷后HUVECs的存活率和貼壁能力,減少LDH的釋放及HUVECs的脫落,提高SOD活性,且MDA含量也顯著降低,其中BAK濃度為10 μmol/L作用效果最明顯(P<0.05,見圖1)。
2.2 補骨脂酚可增強缺血再灌注后內皮細胞PKCε的膜轉位水平并抑制其凋亡
與Con組相比,SIR處理顯著降低了HUVECs的PKCε膜轉位水平和抗凋亡蛋白Bcl-2的表達,而凋亡蛋白cleaved caspase 3和Bax表達量明顯增加(P<0.05);不同濃度的BAK預處理均可提高SIR損傷后HUVECs的PKCε膜轉位水平和抗凋亡蛋白Bcl-2的表達,并抑制凋亡蛋白cleaved caspase 3和Bax的表達,其中BAK濃度為10 μmol/L時作用效果最明顯(P<0.05,見圖2),后續實驗均采取此濃度進行藥物預處理。
2.3 補骨脂酚預處理通過PKCε信號通路減輕缺血再灌注后內皮細胞損傷及氧化應激水平
阻斷PKCε信號通路后發現,與BAK+SIR組相比,εV1-2+BAK+SIR組細胞存活率顯著下降,LDH釋放量明顯增加(P<0.05);并且細胞中SOD活力顯著下降,MDA含量、ROS生成量及氧化應激標志蛋白gp91phox表達量均顯著增加(P<0.05)。與SIR組相比,εV1-2+SIR組HUVECs細胞存活率、LDH釋放量、細胞中MDA含量、SOD、ROS生成量及gp91phox表達量均沒有顯著變化(P>0.05,見圖3)。

圖1 BAK對SIR損傷后內皮細胞活力、LDH活性及氧化應激水平的影響Figure 1 The effects of BAK treatment on the cell viability, LDH activity and oxidative stress level following SIR injury in HUVECs

與Con組相比,*P<0.05;與SIR組相比,#P<0.05;與BAK 10 μmol/L+SIR組相比,△P<0.05;1. Con組; 2. SIR組; 3. BAK 2 μmol/L+SIR組; 4. BAK 5 μmol/L+SIR組; 5. BAK 10 μmol/L+SIR組圖2 BAK對SIR損傷后內皮細胞凋亡相關蛋白表達及PKCε膜轉位的影響Figure 2 The effects of BAK treatment on the apoptosis-related protein expression and PKCε translocation following SIR injury in HUVECs
2.4 補骨脂酚預處理通過PKCε信號通路減輕缺血再灌注后內皮細胞凋亡水平
阻斷PKCε信號通路后發現,與BAK+SIR組相比,εV1-2+BAK+SIR組細胞的PKCε膜轉位水平明顯降低(P<0.05);同時細胞凋亡率明顯增加,抗凋亡蛋白Bcl-2表達下降,凋亡蛋白Bax、cleaved caspase 3表達增加(P<0.05)。與SIR組相比,εV1-2+SIR組Bcl-2、Bax、cleaved caspase 3蛋白表達和細胞凋亡率無顯著變化(P> 0.05,見圖4,5)。

1. SIR組;2. BAK+SIR組;3. εV1-2+BAK+SIR組;4. εV1-2+SIR組與SIR組相比,#P<0.05;與BAK+SIR組相比,*P<0.05;與εV1-2+BAK+SIR組相比,△P<0.05圖3 BAK與εV1-2處理對SIR損傷后內皮細胞活力、LDH活性及氧化應激水平的影響Figure 3 The effects of combination of BAK and εV1-2 on the cell viability, LDH activity and oxidative stress level following SIR injury in HUVECs

圖4 細胞凋亡的TUNEL染色熒光圖Figure 4 TUNEL staining of cell apoptosis after different treatment

1. SIR組; 2. BAK+SIR組; 3. εV1-2+BAK+SIR組; 4. εV1-2+SIR組與SIR組相比,#P<0.05;與BAK+SIR組相比,*P<0.05;與εV1-2+BAK+SIR組相比,△P<0.05圖5 BAK與εV1-2處理對SIR損傷后內皮細胞凋亡率、凋亡相關蛋白表達及PKCε膜轉位的影響Figure 5 The effects of BAK and εV1-2 combination treatment on the apoptotic index, apoptosis-related protein expression and PKCε translocation following SIR injury in HUVECs
3 討論
缺血再灌注會引起氧化應激損傷及細胞凋亡,是心臟外科手術和缺血性心肌病預后較差的主要原因之一[18]。線粒體在缺血再灌注損傷中扮演重要角色,再灌注之后的鈣超載及氧化應激水平的上升均會損傷線粒體內膜及其電子傳遞鏈,進而導致線粒體結構及功能損傷,最終影響細胞能量代謝。因此,減輕線粒體氧化應激損傷并維持其功能是防治心肌缺血再灌注損傷的重要途徑[19]。
BAK具有多種生理學和藥理學作用,對多種疾病都具有治療和預防作用。有研究表明,BAK可減輕四氯化碳等肝臟毒物引起的肝細胞損傷[8],也可通過Caspase 3凋亡通路減輕肝臟纖維化及肝硬化等[7]。在脂多糖誘導的肺損傷等炎癥反應中,BAK也作為一種有效的抗炎介質發揮重要作用[20]。同時,有研究證實,BAK可抑制活性氧物質的產生并保護線粒體功能[10]。近期一項心肌缺血再灌損傷實驗也報道,BAK可通過SIRT1信號通路,發揮抗氧化應激、抗心肌細胞凋亡等保護作用[18],然而其能否減輕內皮細胞氧化應激損傷尚不明確。在本研究中我們觀察到BAK預處理24 h能明顯提高SIR損傷后內皮細胞存活率,降低內皮細胞LDH的釋放,增強細胞SOD活性,并降低細胞MDA含量及cleaved caspase 3的表達,且這種保護作用表現為劑量依賴性。
蛋白激酶C是一種多功能絲氨酸和蘇氨酸激酶,發揮調控細胞增殖、分化和凋亡等多種生物學功能,依據其結構和激活方式將其分為三種亞型(A型:α、βⅠ、βⅡ和γ;B型:δ、ε、η/L和θ;C型:ζ和λ)。PKCε與多種疾病密切相關,其廣泛分布于多種組織、器官和細胞中,靜止細胞中的PKCε主要存在于胞質,當細胞受到刺激后,PKCε以甘油二酯(DAG)依賴的形式從胞漿移位到細胞膜上,此過程稱之為轉位。一般將PKCε的轉位作為PKCε激活的標志。前期研究表明,PKCε具有促進細胞生存效應,并且在心肌細胞缺血預處理中發揮抑制細胞凋亡作用[21, 22]。PKCε能調控內皮細胞保護性基因A1、A20 和 Bcl-2的組成性表達[17]。有研究報道,PKCε具有很強的抗氧化特性,激活PKCε可以減輕內皮細胞氧化應激損傷[23]。本研究同樣觀察到,在內皮細胞缺血再灌注損傷模型中,經BAK預處理可劑量依賴性促進PKCε膜轉位,進而激活PKCε信號通路。同時BAK預處理可明顯減少ROS生成量,上調Bcl-2/Bax比例,降低cleaved caspase 3、gp91phox的表達量及細胞凋亡率,發揮抑制細胞凋亡與減輕線粒體氧化應激損傷的作用。并且阻斷PKCε信號通路可抵消BAK的上述保護效應,進一步肯定了PKCε信號通路介導BAK對HUVECs的保護作用。
綜上所述,本研究證實BAK可以減輕內皮細胞缺血再灌注損傷,其機制為激活PKCε保護性信號通路,減輕氧化應激損傷,抑制內皮細胞的凋亡。
[1] Hausenloy DJ, Yellon DM. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. J Clin Invest, 2013,123(1):92-100.
[2] 趙國龍, 張秋芳, 翟蒙恩, 等. 褪黑素受體對大鼠心肌缺血再灌注損傷的調控及其機制研究[J]. 中國體外循環雜志, 2015, 13(2):113-118.
[3] Yellon DM, Hausenloy DJ. Myocardial reperfusion injury[J]. N Engl J Med, 2007,357(11):1121-1135.
[4] Buja LM. Myocardial ischemia and reperfusion injury[J]. Cardiovasc Pathol, 2005,14(4):170-175.
[5] 董建文, 時安云. 內皮細胞在缺血再灌注損傷中的作用[J]. 國外醫學(生理、病理科學與臨床分冊),1996,16(4):275-278.
[6] Chopra B, Dhingra AK, Dhar KL. Psoraleacorylifolia L. (Buguchi)-folklore to modern evidence: review[J]. Fitoterapia, 2013,90:44-56.
[7] Park EJ, Zhao YZ, Kim YC,etal. Bakuchiol-induced caspase-3-dependent apoptosis occurs through c-Jun NH2-terminal kinase-mediated mitochondrial translocation of Bax in rat liver myofibroblasts[J]. Eur J Pharmacol, 2007,559(2-3):115-123.
[8] Park EJ, Zhao YZ, Kim YC,etal. Protective effect of (S)-bakuchiol from Psoraleacorylifolia on rat liver injuryinvitroandinvivo[J]. Planta Med, 2005,71(6):508-513.
[9] Chaudhuri RK, Bojanowski K. Bakuchiol: a retinol-like functional compound revealed by gene expression profiling and clinically proven to have anti-aging effects[J]. Int J Cosmet Sci, 2014,36(3):221-230.
[10] Seo E, Oh YS, Kim D,etal. Protective role of psoraleacorylifolia L. seed extract against hepatic mitochondrial dysfunction induced by oxidative stress or aging[J]. Evid Based Complement Alternat Med, 2013,2013:678028.
[11] Kim KA, Shim SH, Ahn HR,etal. Protective effects of the compounds isolated from the seed of Psoraleacorylifolia on oxidative stress-induced retinal damage[J]. Toxicol Appl Pharmacol, 2013,269(2):109-120.
[12] Choi SY, Lee S, Choi WH,etal. Isolation and anti-inflammatory activity of Bakuchiol from Ulmusdavidiana var. japonica[J]. J Med Food, 2010,13(4):1019-1023.
[13] Krenisky JM, Luo J, Reed MJ,etal. Isolation and antihyperglycemic activity of bakuchiol from Otholobiumpubescens (Fabaceae), a Peruvian medicinal plant used for the treatment of diabetes[J]. Biol Pharm Bull, 1999,22(10):1137-1140.
[14] Pant R, Marok R, Klein LW. Pathophysiology of coronary vascular remodeling: relationship with traditional risk factors for coronary artery disease[J]. Cardiol Rev, 2014,22(1):13-16.
[15] Osipov RM, Bianchi C, Feng J,etal. Effect of hypercholesterolemia on myocardial necrosis and apoptosis in the setting of ischemia-reperfusion[J]. Circulation, 2009,120(11 Suppl):S22-S30.
[16] Holzmann MJ, Rathsman B, Eliasson B,etal. Long-term prognosis in patients with type 1 and 2 diabetes mellitus after coronary artery bypass grafting[J]. J Am Coll Cardiol, 2015,65(16):1644-1652.
[17] Dumont O, Mylroie H, Bauer A,etal. Protein kinase Cepsilon activity induces anti-inflammatory and anti-apoptotic genes via an ERK1/2-and NF-kappaB-dependent pathway to enhance vascular protection[J]. Biochem J, 2012,447(2):193-204.
[18] Feng J, Yang Y, Zhou Y,etal. Bakuchiol attenuates myocardial ischemia reperfusion injury by maintaining mitochondrial function: the role of silent information regulator 1[J]. Apoptosis, 2016,21(5):532-545.
[19] Murphy E, Steenbergen C. Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury[J]. Physiol Rev, 2008,88(2):581-609.
[20] Zhang X, Chang N, Zhang Y,etal. Bakuchiol protects against acute lung injury in septic mice[J]. Inflammation, 2017,40(2):351-359.
[21] Ping P, Zhang J, Qiu Y,etal. Ischemic preconditioning induces selective translocation of protein kinase C isoforms epsilon and eta in the heart of conscious rabbits without subcellular redistribution of total protein kinase C activity[J]. Circ Res, 1997,81(3):404-414.
[22] Saurin AT, Pennington DJ, Raat NJ,etal. Targeted disruption of the protein kinase C epsilon gene abolishes the infarct size reduction that follows ischaemic preconditioning of isolated buffer-perfused mouse hearts[J]. Cardiovasc Res, 2002,55(3):672-680.
[23] Monti M, Donnini S, Giachetti A,etal. deltaPKC inhibition or varepsilonPKC activation repairs endothelial vascular dysfunction by regulating eNOS post-translational modification[J]. J Mol Cell Cardiol, 2010,48(4):746-756.
BakuchiolprotectsvascularendothelialcellsagainstischemiareperfusioninjuryviaPKCεsignalingpathway
WANG Lei1, DU Chaosheng2, XIAO Jun3#, YANG Jian4*
(1DepartmentofMedicine,Out-patientDepartmentofBeijisi,AgencyforOfficesAdministrationofCentralMilitaryCommission,Beijing100191,China;2DepartmentofMedicine, 518thHospitalofChinesePeople’sLiberationArmy;3DepartmentofCardiovascularDiseases, 309thHospitalofChinesePeople’sLiberationArmy;4DepartmentofCardiovascularDiseases, 313thHospitalofChinesePeople’sLiberationArmy;*Correspondingauthor,E-mail:yangjian31313@126.com;#Co-correspondingauthor,E-mail:xxxjjj6288@sina.com)
ObjectiveTo explore the protective effects of bakuchiol(BAK) against simulated ischemia reperfusion(SIR)-induced injury in human umbilical vein endothelial cells(HUVECs) and its underlying mechanisms.MethodsThe cultured HUVECs were pretreated with BAK(2, 5, 10 μmol/L) for 24 h and then subjected to SIR (45 min ischemia, 4 h reperfusion). Cell viability and apoptotic index were detected by CCK-8 and TUNEL methods, and the lactate dehydrogenase(LDH) releasing, intracellular malondialdehyde(MDA) content, superoxide dismutase(SOD) were all assessed by specialized kits. The translocation of protein kinase C epsilon(PKCε) and the expression levels of Bcl-2, Bax, cleaved caspase 3 and oxidative stress marker gp91phoxwere detected by Western blot. Dihydroethidium(DHE), a fluorescence probe, was used to detect the presence of reactive oxygen species(ROS). The εV1-2, a specific inhibitor of PKCε signaling, was used to further study the role of PKCε in this process.ResultsBAK pretreatment protected HUVECs against SIR injury in a dose-dependent manner, especially at the concentration of 10 μmol/L.BAK pretreatment significantly improved the cell viability, reduced LDH releasing, up-regulated the SOD activity and down-regulated the MDA content of SIR-treated HUVECs (P<0.05). In addition, BAK supplementation significantly reduced the apoptotic index, increased PKCε translocation and Bcl-2 expression, and decreased the expression levels of cleaved caspase 3, Bax and gp91phox(P<0.05). However, the protective effects of BAK mentioned above were significantly attenuated by εV1-2(P<0.05).ConclusionBAK pretreatment can protect against SIR-induced oxidative stress and apoptosis on HUVECs via PKCε signaling pathway.
bakuchiol; human umbilical vein endothelial cells; ischemia reperfusion injury; protein kinase C epsilon; oxidative stress; apoptosis
R363
A
1007-6611(2017)10-0975-07
10.13753/j.issn.1007-6611.2017.10.001
北京市自然科學基金資助項目(7122178);總參軍事醫學和老年病科研基金資助項目(ZCWS14C12)
王壘,男,1981-05生,碩士,主治醫師,E-mail:360096485@qq.com
2017-06-12

