胃癌組織中LRG1與E-cadherin的表達及臨床意義
田 薇,章建國,劉益飛,卞兆連,黃 華,靳 欽
胃癌組織中LRG1與E-cadherin的表達及臨床意義
田 薇1,章建國1,劉益飛1,卞兆連2,黃 華1,靳 欽1
目的探討胃癌中富含亮氨酸的α-2-糖蛋白1(leucine-rich α2 glycoprotein 1, LRG1)的表達及臨床意義。方法采用免疫組化法檢測74例胃癌組織及相應癌旁組織中LRG1、E-cadherin的表達;探討胃癌組織及癌旁組織中LRG1、E-cadherin的表達,并分析LRG1表達與E-cadherin表達的相關性及與臨床病理特征、患者生存時間的關系。結果LRG1蛋白在胃癌組織中的表達明顯高于癌旁組織(P<0.01),E-cadherin蛋白在胃癌組織中的表達明顯低于癌旁組織(P<0.01),LRG1表達與E-cadherin表達呈負相關。進一步分析顯示,胃癌中LRG1的表達與腫瘤分化程度及淋巴結轉移相關(P<0.01),與患者年齡、性別、腫瘤大小、TNM分期等無關(P>0.05)。Kaplan-Meier單因素統計分析結果顯示LRG1高表達組患者術后生存時間明顯低于LRG1低表達組(P<0.05)。結論LRG1在胃癌組織中高表達,其表達水平與胃癌分化程度及淋巴結轉移相關,其高表達抑制E-cadherin的表達,促進腫瘤細胞遷移,且有助于判斷腫瘤的惡性生物學行為及預后評估。
胃腫瘤;LRG1;E-cadherin;預后
胃癌是源自胃黏膜上皮的惡性腫瘤,嚴重威脅人類健康,是我國常見高發腫瘤之一,其病程進展快,患者預后差,病死率位居惡性腫瘤的第2位[1]。目前人類對于胃癌的發生、發展機制缺乏深入了解,晚期胃癌患者生存期短,生存質量差,因此如能早期發現并診斷胃癌,將有助于患者獲得相對較長的生存期,這需要篩選出新的生物標志物及治療靶點,從而有效的診斷和治療。富含亮氨酸的α-2-糖蛋白(leucine-rich α2 glycoprotein 1, LRG1)于1977年從人類血清中第一次分離出來,研究發現,在許多腫瘤組織中LRG1高表達,如非小細胞肺癌、結直腸癌、卵巢上皮性癌等[2-3]。現已證明,LRG1在某些腫瘤的信號轉導、細胞發育、細胞存活及遷移中發揮作用[4]。E-cadherin與細胞黏附有關,近年來,上皮-間質轉化(epitheial-mesenchymaltransition, EMT)在炎癥性疾病[5]及在惡性腫瘤的浸潤、轉移中的作用備受關注,EMT常表現為E-cadherin的表達丟失。目前尚未有研究對胃癌中LRG1基因的表達進行描述,本實驗通過觀察LRG1、E-cadherin在胃癌組織中的表達,分析兩者表達的相關性,及LRG1與臨床病理特征的關系,探討LRG1、E-cadherin在胃癌發生、發展、侵襲中的意義及預后評估。
1 材料與方法
1.1材料收集南通大學附屬醫院2012年6月~2013年12月手術切除的74例胃癌標本,均有完整的臨床及隨訪資料。其中男性63例,女性11例,年齡38~88歲,平均62.0歲。所有病例系原發,術前均未接受放、化療。另選距腫瘤5 cm的相應癌旁組織作為對照。
1.2試劑鼠抗人LRG1單克隆抗體購自Abcam公司(抗體稀釋濃度1 ∶100),鼠抗人E-cadherin單克隆抗體及免疫組化試劑盒均購自福州邁新公司。
1.3免疫組化標本均用10%中性福爾馬林固定24 h,常規石蠟包埋, 4 μm厚切片,貼附于預先用1%多聚賴氨酸處理的載玻片65 ℃烤片1.5 h,采用EnVision法檢測,具體操作按試劑盒說明書進行,以已知陽性肺癌組織切片作為陽性對照。
1.4結果判斷LRG1定位于細胞質,陽性結果呈棕黃色或棕褐色顆粒;E-cadherin定位于細胞膜,陽性結果呈棕黃色或棕褐色顆粒,根據反應強度和范圍分為:未見陽性細胞為陰性(-);陽性細胞未超過半數且染色較淺為陽性(+)/低表達;陽性細胞超過半數且染色較深為強陽性()/高表達。
1.5隨訪采用電話方式進行隨訪。隨訪時間1~48個月,生存49例,死亡25例。總生存期(overall survival, OS)為自手術日期至死亡或隨訪結束日期。
1.6統計學處理運用GraphPad Prism 5.0及SPSS 13.0軟件進行統計學分析,對臨床病理資料及表達的差異性采用χ2檢驗,對生存數據采用Kaplan-Meier分析并繪制生存曲線,應用Log-rank法檢驗差異性。P≤0.05為差異有統計學意義。
2 結果
2.1LRG1在胃癌及癌旁組織中的表達LRG1的免疫組化染色主要定位于細胞質,細胞核也有著色(圖1),其在胃癌組織及癌旁組織中的陽性率分別為82.43%(61/74)、56.76%(42/74),差異有統計學意義(P<0.01,圖2)。
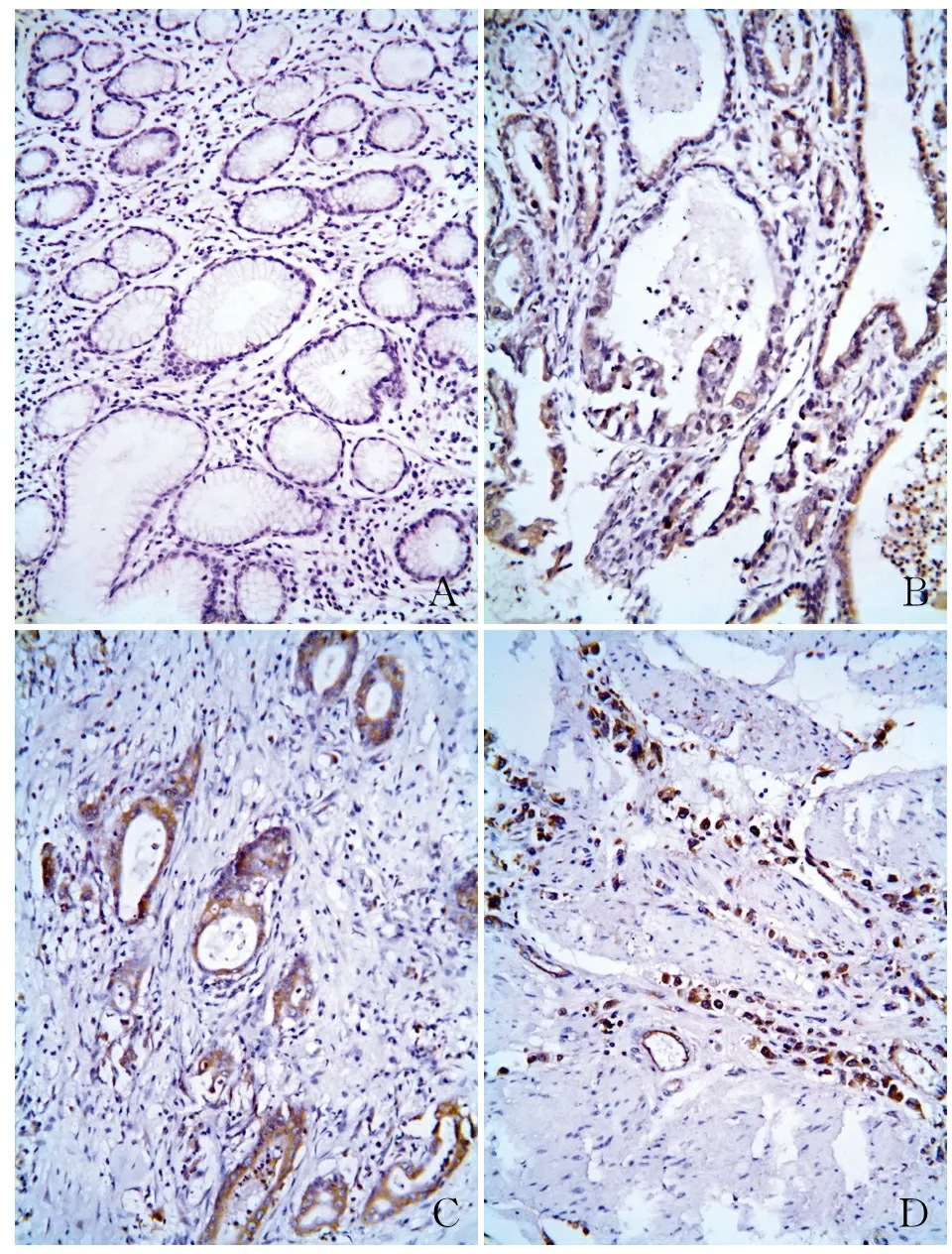
ABCD
圖1LRG1在癌旁及胃癌組織中的表達:A.LRG1在癌旁胃黏膜中的表達;B.LRG1在高分化胃癌中的表達;C.LRG1在中分化胃癌中的表達;D.LRG1在低分化胃癌中的表達,EnVision法
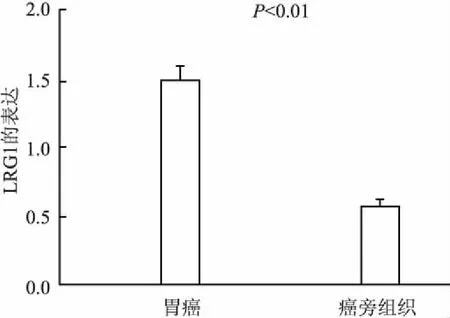
圖2 胃癌及癌旁組織中LRG1的表達
2.1E-cadherin在胃癌及癌旁組織中的表達E-cadherin的免疫組化染色主要定位于細胞膜(圖3),其在胃癌及癌旁組織中的陽性率分別為77.03%(57/74)、94.59%(70/74),差異有統計學意義(P<0.01,圖4)。
2.2LRG1表達與胃癌臨床病理特征的關系統計學分析顯示,LRG1表達與腫瘤分化程度及淋巴結轉移有關(P<0.05),與患者年齡、性別、腫瘤大小、TNM分期以及神經侵犯無關(P>0.05,表1)。
2.3胃癌組織中LRG1高表達和低表達與生存時間的關系LRG1高表達組的患者術后生存時間明顯低于LRG1低表達組(P<0.05,圖5)。

ABCD
圖3E-cadherin在癌旁組織及胃癌組織中的表達:A.E-cadherin在癌旁胃黏膜中的表達;B.E-cadherin在高分化胃癌中的表達;C.E-cadherin在中分化胃癌中的表達;D.E-cadherin在低分化胃癌中的表達,EnVision法
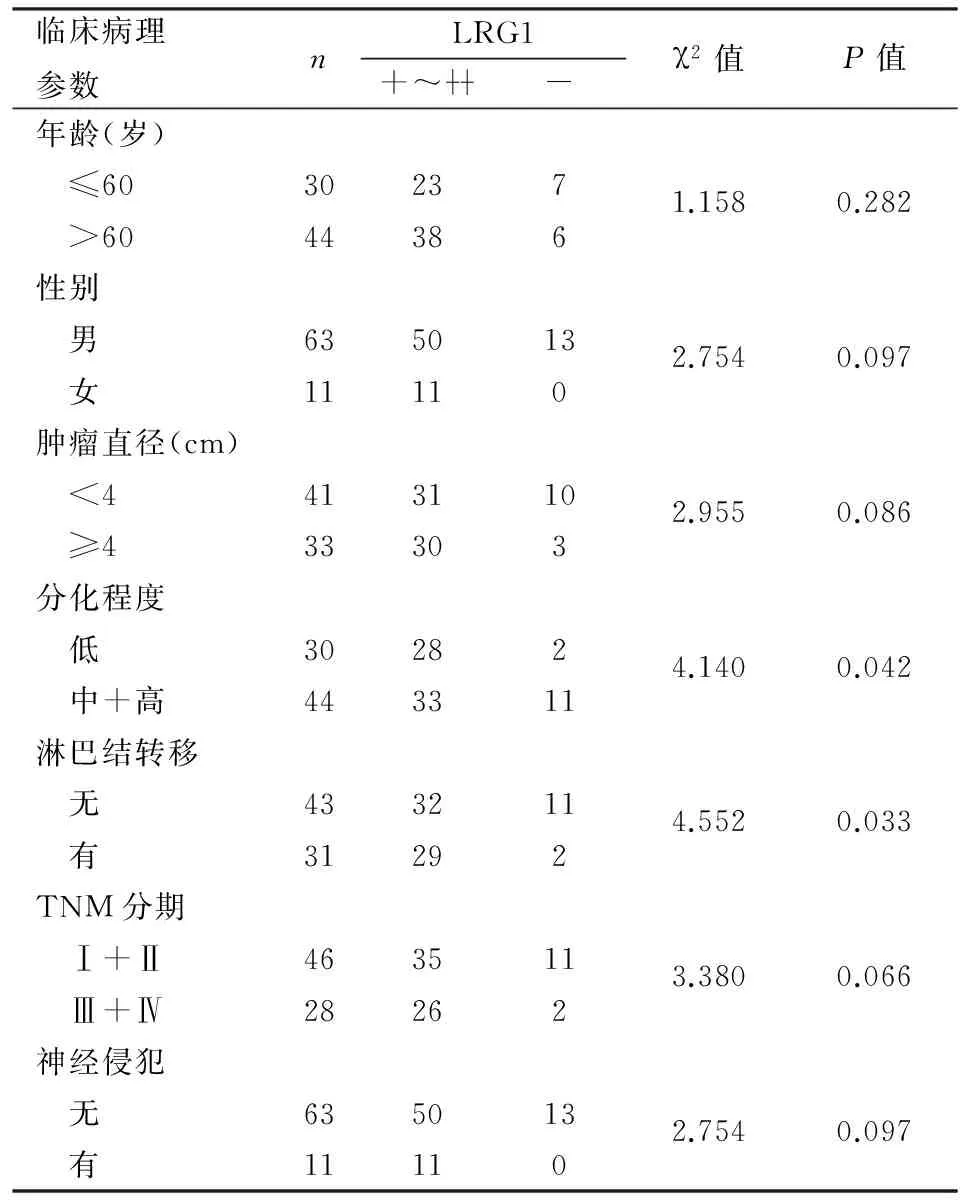
表1 LRG1表達與胃癌病理特征的關系
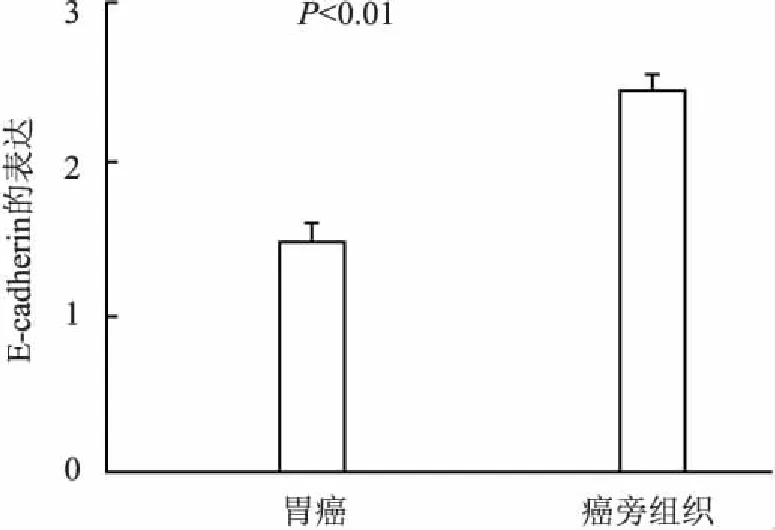
圖4 胃癌及癌旁組織中E-cadherin的表達
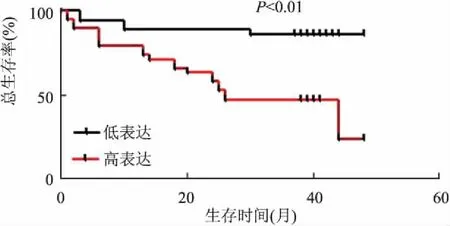
圖5 LRG1高表達組和低表達組胃癌患者的生存率
2.4胃癌組織中LRG1與E-cadherin表達的相關性胃癌組織中LRG1與E-cadherin蛋白表達呈負相關,LRG1蛋白高表達時,E-cadherin蛋白呈低表達(r=-0.334,P<0.05)。
3 討論
胃癌是最常見的消化道惡性腫瘤,由于人們飲食習慣的改變,我國胃癌患者的發病率呈逐年遞增趨勢。胃癌的發病機制較為復雜,是多因素、多步驟的過程。早期胃癌多無癥狀,發現時常為中晚期,患者預后差。因此探討胃癌的發生、發展機制有助于胃癌的治療,以期延長患者的生存期。
LRG由Haupt和Baudner于1977年第一次從人類血清中提取分離出來,包含312個氨基酸殘基,其中66個為亮氨酸。LRG包括8個共有序列,每個序列含有24個氨基酸殘基,稱為富含亮氨酸重復序列[6]。LRG1是富含亮氨酸重復序列家族成員之一,研究顯示其是一種抗凋亡因子,在多種腫瘤組織及血清中表達上調,如肺非小細胞癌、卵巢癌、星形膠質細胞瘤等[2-3]。最新研究顯示,在結腸癌中LRG1表達明顯高于癌旁組織[7],還有研究組證實相較于結腸發生的腺瘤性息肉,其表達也增高[8],這些研究提示LRG1參與某些腫瘤的發生、發展。本實驗結果顯示,LRG1在胃癌組織中的表達明顯高于癌旁正常胃組織(P<0.05),LRG1表達與腫瘤分化程度及淋巴結轉移有關(P<0.05),提示LRG1的高表達促進了胃癌腫瘤細胞的增殖及侵襲性生物學行為,LRG1表達異常與胃癌發生、發展及侵襲有關。
研究顯示,在與敲除LRG1基因的結腸癌細胞株相比,未經敲除LRG1基因的細胞其遷移和浸潤能力明顯增強[7];同時LRG1參與TGF-β信號途徑促進上皮細胞增殖和血管發生[9]。TGF-β信號已被證實在體外誘導EMT。EMT是腫瘤發生遠處轉移的重要步驟,腫瘤細胞由于分子學改變導致功能異常,細胞與細胞間的粘連逐漸喪失,導致細胞失去極性,在EMT的過程中,上皮細胞逐漸獲得間質細胞的形態、結構和功能,最終促進腫瘤細胞突破基膜向周圍正常組織浸潤。E-cadherin是阻滯EMT發生的主要分子之一,LRG1是TGF-β的上游調節因子,本組實驗結果顯示,在胃癌組織中LRG1與E-cadherin的表達呈負相關(P<0.05),低分化胃癌組織中LRG1高表達,而E-cadherin表達缺失,作者推測LRG1通過TGF-β信號通路下調E-cadherin,誘導EMT的發生,促進胃癌細胞浸潤性生長。關于其機制,研究認為TGF-β1通過Smad介導Snail和Slug的表達,而這兩者是抑制E-cadherin基因的重要轉錄因子[10]。也有研究認為TGF-β通過Notch1和其配體Jaggedl的介導促進Slug的表達,從而減少E-cadherin的表達,加速EMT的發生進程[11]。
綜上所述,胃癌中LRG1的表達上調與E-cadherin表達降低預示著胃癌發生、發展中存在EMT現象,LRG1通過TGF-β信號通路對E-cadherin起著調控作用,本組實驗結果提示,LRG1高表達組患者生存率低于低表達組,因此LRG1與E-cadherin在評估胃癌患者的預后中有重要意義,也是胃癌潛在的靶向治療分子。LRG1和E-cadherin在胃癌演進過程中的作用機制及相關信號分子通路有待進一步深入探討。
[1] Chen W, Zheng R, Baade P D,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Nakajima M, Miyajima M, Ogino I,etal. Leucine-rich α-2-glycoprotein is a marker for idiopathic normal pressure hydrocephalus[J]. Acta Neurochirurgica, 2011,153(6):1339-1346.
[3] Zhong D, He G, Zhao S,etal. LRG1 modulates invasion and migration of glioma cell lines through TGF-β signaling pathway[J]. Acta Histochemica, 2015,117(6):551-558.
[4] Kakisaka T, Kondo T, Okano T,etal. Plasma proteomics of pan-creatic cancer patients by multi-dimensional liquid chromatography and two-dimensional difference gel electrophoresis ( 2D-DIGE) :up-regulation of leucine-rich alpha-2-glycoprotein in pancreatic cancer[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007,852(1-2):257-267.
[5] 徐 倩, 段 華, 汪 沙, 等. 宮腔粘連子宮內膜組織中ArhGAP29、E-Cadherin的表達及意義[J]. 臨床與實驗病理學雜志, 2017,33(1):4-7.
[6] Bai X Y, Jin P. Expressions of serum LRG1 and CA125 in patients with epithelial ovarian cancer and their clinical significance[J]. Prog Obstet Gynecol, 2013,22(2):111-114.
[7] Zhang J, Zhu L, Fang J,etal. LRG1 modulates epithelial-mesenchymal transition and angiogenesis in colorectal cancer via HIF-1α activation[J]. J Exp Clin Cancer Res, 2016,35(1):29.
[8] Choi J W, Liu H, Shin D H,etal. Proteomic and cytokine plasma biomarkers for predicting progression from colorectal adenoma to carcinoma in human patients[J]. Proteomics, 2013,13(15):2361-2374.
[9] 劉兆國, 范方田, 趙林鋼, 等. 腫瘤血管生成新靶點LRG1研究進展[J]. 中國藥理學通報, 2014,30(1):6-9.
[10] Siegel P M, Massagué J. Cytostatic and apoptotic actions of TGF-beta in homeostasis and cancer[J]. Nat Rev Cancer, 2003,3(11):807-821.
[11] Leong K G, Niessen K, Kulic I,etal. Jagged1-mediated Notch activation induces epithelial-to-mesenchymal transition through Slug-induced repression of E-cadherin[J]. J Exp Med, 2007,204(12):2935-2948.
R 735.2
A
1001-7399(2017)10-1129-04
時間:2017-10-23 13:30 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.016.html
10.13315/j.cnki.cjcep.2017.10.016
接受日期:2017-04-29
江蘇省衛生廳面上項目(H201626)
1南通大學附屬醫院病理科,南通 226000
2南通大學附屬南通第三醫院南通市肝病研究所,南通 226000
田 薇,女,碩士,主治醫師。E-mail: tianweiw@163.com
劉益飛,男,博士研究生,通訊作者。E-mail: bluefiime@qq.com

