初中化學(xué)守恒思想的教學(xué)研究
王一凡
(上海市宜川中學(xué)附屬學(xué)校,上海 200065)
初中化學(xué)守恒思想的教學(xué)研究
王一凡
(上海市宜川中學(xué)附屬學(xué)校,上海 200065)
守恒思想是初中化學(xué)中非常重要的思想方法,無論是化學(xué)方程式的記憶和書寫還是化學(xué)反應(yīng)原理的推理和計(jì)算等初中化學(xué)的核心內(nèi)容都是建立在守恒思想的基礎(chǔ)之上的.本文將結(jié)合初中化學(xué)教學(xué)中經(jīng)常涉及到的幾種守恒思想方法的分類作出解析,并對(duì)化學(xué)教學(xué)中如何培養(yǎng)學(xué)生守恒思想方法進(jìn)行了一定的教學(xué)研究和思考,目的是為以后的教學(xué)中更好的幫助學(xué)生獲取知識(shí)、培養(yǎng)學(xué)生分析問題和解決問題的能力.
初中化學(xué);守恒思想;教學(xué)研究
化學(xué)學(xué)科思想的化學(xué)教學(xué)會(huì)造成學(xué)生學(xué)習(xí)化學(xué)浮于表面,增加了學(xué)生在學(xué)習(xí)化學(xué)的難度和困惑,嚴(yán)重限制了學(xué)生科學(xué)素養(yǎng),探究學(xué)習(xí)的能力和創(chuàng)新性思維的發(fā)展.而守恒思想又是諸多化學(xué)思想中應(yīng)用最多涉及最廣的學(xué)科思想,因此培養(yǎng)學(xué)生守恒思想的教學(xué)研究尤為重要.
一、初中化學(xué)守恒思想主要分為以下幾個(gè)方面
1.質(zhì)量守恒
當(dāng)物質(zhì)之間發(fā)生化學(xué)反應(yīng)時(shí),其實(shí)質(zhì)就是分子獲得一定的能量,拆分成原子,原子不能穩(wěn)定的存在,又重新組合成新的分子.從宏觀角度來看化學(xué)反應(yīng)前后元素的種類不變;從微觀的角度來看某種元素的原子無論是在哪種物質(zhì)中,反應(yīng)前后原子的種類、質(zhì)量及個(gè)數(shù)都不會(huì)改變,即總質(zhì)量守恒.
2.電荷守恒
在書寫化合物的化學(xué)式時(shí),一個(gè)重要的原則就是化合物中各元素化合價(jià)代數(shù)和為零.其實(shí)質(zhì)就是在化合物中,陰、陽(yáng)離子所帶總電荷電量相等而電性相反,即電荷守恒.
3.得失電子守恒
在化學(xué)反應(yīng)中,如果有物質(zhì)得到電子同時(shí)一定有物質(zhì)失去電子,電子不會(huì)憑空產(chǎn)生也不會(huì)憑空消失,電子只會(huì)從一種物質(zhì)轉(zhuǎn)移到另一種物質(zhì),也就是說得失電子數(shù)一定是守恒的.
二、守恒思想在初中化學(xué)中的應(yīng)用
1.質(zhì)量守恒思想的應(yīng)用
(1)便于學(xué)生記憶和書寫化學(xué)方程式
化學(xué)方程式的學(xué)習(xí)是初中學(xué)生用化學(xué)的語言來認(rèn)識(shí)和了解物質(zhì)世界的重要途徑,是打開化學(xué)世界大門的鑰匙和進(jìn)入微觀世界的必經(jīng)之路,當(dāng)然也是中考化學(xué)的重點(diǎn)和難點(diǎn),所以化學(xué)方程式的書寫顯得尤為重要,而化學(xué)方程式的書寫的重要原則就是質(zhì)量守恒定律,所以質(zhì)量守恒思想就貫穿于化學(xué)學(xué)習(xí)的始終.化學(xué)方程式的書寫對(duì)學(xué)生來說,難點(diǎn)就是沒有很好的用守恒思想來理解而是用背誦單詞的方法來記憶.
師:同學(xué)們生活中大家把可樂、雪碧、鹽汽水等飲料稱之為什么飲料?
生:碳酸飲料.
師:為什么稱為碳酸飲料啊?
生:飲料中含有碳酸.
師:碳酸哪里來的呢?
生:不清楚啊.
師:同學(xué)們,其實(shí)在碳酸飲料的制取過程中,就是把二氧化碳?jí)喝腼嬃现兄瞥善?二氧化碳怎么會(huì)變成碳酸了呢?接下來就來研究一下二氧化碳和水的反應(yīng).
師:反應(yīng)物如下:CO2+ H2O →
請(qǐng)大家觀察反應(yīng)物含什么元素?
生:共有碳?xì)溲跞N元素.
師:所以生成物中也一定什么元素?
生:一定含碳?xì)溲跞N元素.
師:你們猜想生成物是什么?
生:碳酸.
師:怎么證明我們的猜想呢?
生:滴加石蕊,溶液變紅
二氧化碳和水的化學(xué)性質(zhì)的學(xué)習(xí)就在這輕松愉快的探究過程中結(jié)束了,如果堅(jiān)持這種用元素守恒的思想方法來學(xué)習(xí)化學(xué)性質(zhì)的話,相信學(xué)生對(duì)于化學(xué)方程式的書寫便水到渠成了.(2)便以學(xué)生理解和推導(dǎo)計(jì)算關(guān)系式
守恒法也是初中中學(xué)化學(xué)計(jì)算中一種很重要的技能與方法,也是各類模擬試題或者中考試題中應(yīng)用最多的方法之一,其特點(diǎn)是抓住有關(guān)變化的始態(tài)和終態(tài),忽略中間過程,利用某種不變量建立關(guān)系式,從而簡(jiǎn)化思路,化難為易,快速解題.這里以一道關(guān)于質(zhì)量守恒定律的壓軸選擇題為例:
例1 (12年中考?jí)狠S選擇題46題)取一定量的氧化鐵與氧化銅的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反應(yīng)生成鹽和水.原混合物中氧元素的質(zhì)量是( ).
A.6.4g B.3.2g C.1.6g D.0.8g
做這道題的時(shí)候有些同學(xué)寫了一大堆的方程式,然后設(shè)未知數(shù),解方程,繞了一大圈也沒有理清計(jì)算的思路.顯然根據(jù)酸溶液和堿性氧化物反應(yīng)生成鹽和水的性質(zhì),稀硫酸的氫元素全部變成水中的氫元素,由元素守恒可知稀硫酸0.1mol,則生成水也是0.1mol,而水中的氧元素又全部來自于氧化鐵和氧化銅中的氧元素,因此水中的氧元素是0.1mol,所以原混合物中的氧元素也是0.1mol,根據(jù)反應(yīng)前后氧元素守恒的關(guān)系便很容易解決了.
(3)便于學(xué)生猜想和推斷物質(zhì)的化學(xué)式
根據(jù)質(zhì)量守恒定律可知,化學(xué)反應(yīng)前后元素種類不變的思想,給我們研究一些物質(zhì)的組成指明了方向.比如教材中提到的無論水的電解,還是氫氣在氧氣中燃燒,都證明了水是由氫元素和氧元素組成的化合物.人們經(jīng)過了大量的實(shí)驗(yàn)測(cè)定,確認(rèn)了水的化學(xué)式是H2O.
2.電荷守恒思想的應(yīng)用
(1)便于學(xué)生根據(jù)化合價(jià)書寫化學(xué)式
化學(xué)式的書寫是初三化學(xué)中第一次用化學(xué)語言認(rèn)識(shí)和學(xué)習(xí)化學(xué)物質(zhì),也是為書寫化學(xué)反應(yīng)方程式做準(zhǔn)備的,如果化學(xué)式書寫不來,那就制約了化學(xué)學(xué)習(xí)的發(fā)展,因此理解化學(xué)式書寫中電荷守恒的思想就避免了學(xué)生死記硬背的弊端,特別是書寫帶原子團(tuán)的物質(zhì)化學(xué)式時(shí),不妨讓學(xué)生先書寫部分酸堿鹽的化學(xué)式如下:
HCl HNO3H2SO4H2CO3
NaOH KOH Ca(OH)2Al(OH)3
NaCl NaNO3Na2CO3Na2SO4
學(xué)生書寫好這些化學(xué)式之后,筆者還會(huì)引導(dǎo)學(xué)生來觀察和思考從上面這些酸、堿、鹽的化學(xué)式的書寫中我們發(fā)現(xiàn)了哪些規(guī)律:討論后我收集了他們的答案:
“老師我們發(fā)現(xiàn)了酸根結(jié)合的氫原子數(shù)是由酸根的化合價(jià)決定的,如果酸根顯-1價(jià),則酸根結(jié)合一個(gè)氫原子;如果酸根顯-2價(jià)則酸根結(jié)合兩個(gè)氫原子,依次類推……”
“老師我們發(fā)現(xiàn)了金屬元素結(jié)合的氫氧根數(shù)是由金屬元素的化合價(jià)決定的,如果金屬元素顯+1價(jià),則金屬元素結(jié)合一個(gè)氫氧根;如果金屬元素顯+2價(jià),則金屬元素結(jié)合兩個(gè)氫氧根,依次類推……”
“老師我們發(fā)現(xiàn)了……”
聽到同學(xué)們精彩的發(fā)言,筆者深信他們用電荷守恒思想來書寫化學(xué)式已經(jīng)融入了自己的思想觀念.
(2)便于學(xué)生根據(jù)化學(xué)式計(jì)算元素的化合價(jià)
例2 求KMnO4中錳元素的化合價(jià)
求解如下:設(shè)錳元素化合價(jià)為x
1+x+ 4×(-2)=0
1+x-8=0
x=+7
3.得失電子守恒思想的應(yīng)用
(1)便于學(xué)生配平氧化還原反應(yīng)
在氧化還原反應(yīng)中,氧化劑得電子總數(shù)和還原劑失電子總數(shù)相等,即得失電子數(shù)守恒;因此氧化還原反應(yīng)的配平就是建立在得失電子守恒的基礎(chǔ)之上的,筆者舉例如下:
例3 配平下面的化學(xué)方程式


2.便于學(xué)生建立計(jì)算關(guān)系式
對(duì)于比較復(fù)雜的計(jì)算或者涉及方程式數(shù)目比較多的時(shí)候,可以根據(jù)得失電子守恒這一思想快速地建立一種關(guān)系式.
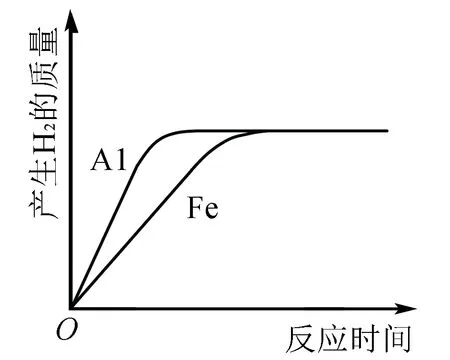
例4 (2009年中考?jí)狠S選擇題46.)將物質(zhì)的量相等的鋁粉和鐵粉分別與同體積、同濃度的稀硫酸反應(yīng),反應(yīng)情況如下圖所示.有關(guān)敘述中正確的是( ).
A.鋁粉、鐵粉和硫酸均有剩余
B.鋁粉、鐵粉均反應(yīng)完,硫酸有剩余
C.硫酸、鋁粉均反應(yīng)完,鐵粉有剩余
D.硫酸、鐵粉均反應(yīng)完,鋁粉有剩余
分析如下:由圖像可知,最終生成等質(zhì)量的氫氣
根據(jù)得失電子守恒建立關(guān)系式如下:
Fe→2H→H23Fe→6H→3H2
Al→3H→1.5H22Al→6H→3H2
由上述關(guān)系式可知消耗的鐵和鋁的物質(zhì)的量之比一定是3∶2,而最初鋁粉和鐵粉物質(zhì)的量相等,所以可推知金屬鋁一定有剩余(和鋁反應(yīng)的硫酸就不會(huì)剩余)答案選D
三、對(duì)守恒思想在初中化學(xué)中的應(yīng)用的思考
“守恒思想”是人們?cè)谡J(rèn)識(shí)化學(xué)這一學(xué)科實(shí)踐活動(dòng)中應(yīng)用得最重要的思想方法之一,是對(duì)化學(xué)的本質(zhì)、特征、價(jià)值的基本認(rèn)識(shí).從以上例題可以看出,利用守恒思想可以使初中化學(xué)的學(xué)習(xí)化難為易、化復(fù)雜為簡(jiǎn)單、化抽象為具體,同時(shí)還能體會(huì)到守恒之妙處、培養(yǎng)學(xué)生多角度思考問題等.培養(yǎng)化學(xué)學(xué)科的思想不僅是學(xué)習(xí)化學(xué)的需要,也是將來孩子們走向社會(huì)的需要.
[1]上海市教育委員會(huì).上海市中學(xué)化學(xué)課程標(biāo)準(zhǔn)(試行稿)上海教育出版社,2004(10).
[2]上海市教育委員會(huì)教學(xué)研究室.上海市初中化學(xué)學(xué)科教學(xué)基本要求(試驗(yàn)本)上海:上海科學(xué)技術(shù)出版社,2017(1).
[3]上海市中小學(xué)課程改革委員會(huì).九年級(jí)義務(wù)教育課本(化學(xué)),2007(8).
[責(zé)任編輯:李璟]
G632
A
1008-0333(2017)26-0088-02
2017-07-01
王一凡(1981.05-),女,河南商丘,中學(xué)一級(jí),本科,從事初中化學(xué)教學(xué).

