快速康復外科對胃癌患者腹腔鏡術后免疫功能及營養狀態的影響
肖 端,朱代華,唐云昊,鄒開鵬(重慶醫科大學附屬第二醫院胃腸外科,重慶400010)
根治性手術切除是胃癌患者得到治愈可能的唯一途徑[1]。在傳統開腹手術基礎上,GOH等于1997年首次運用腹腔鏡胃癌D2根治術治療進展期胃癌,近20年來其療效已得以證實并在各級醫院普遍開展。有文獻證實,腹腔鏡手術能達到與開腹手術同等的淋巴結清掃效果,且從術中出血量、胃腸道功能恢復、下床活動時間及術后住院時間方面明顯優于開腹組[2?3]。快速康復外科(FTS)是指采用具有循證醫學證據的圍手術期系列優化措施減輕患者術后應激反應,促進胃腸道功能恢復,縮短術后機體恢復時間。腹腔鏡手術操作與FTS理念相結合既充分發揮了微創外科的系列特點,又體現了FTS的巨大優勢。本研究旨在探討快速康復外科在腹腔鏡胃癌根治術后對機體免疫功能及營養狀態的影響,現報道如下。
1 資料與方法
1.1 一般資料 回顧性分析本院胃腸外科2015年7月至2017年5月收治的胃癌患者76例,均行全身麻醉下腹腔鏡胃癌D2根治術,主刀者均為醫療組同一醫生。納入標準為:(1)術前經胃鏡及相關病理檢查明確診斷為胃癌;(2)術前胸腹部增強CT等檢查無遠處轉移;(3)無嚴重器官功能障礙者;(4)術前無明顯營養不良者。排除標準:(1)因各種原因中轉開腹者;(2)術前行新輔助放、化療者;(3)手術期間行胃或空腸造瘺者;(4)術前或術中輸血者。根據治療方式分為觀察組(34例)和對照組(42例)。兩組患者在性別、年齡、腫瘤大小及分期等方面比較,差異均無統計學意義(P>0.05)。見表1。本研究經本院醫學倫理委員會批準,所有患者均對本研究知情同意并簽署同意書。

表1 兩組患者一般資料比較
1.2 方法
1.2.1 圍手術期處理方案 兩組患者均接受同一組手術醫生行5孔法腹腔鏡D2胃癌根治術,對照組采用常規圍手術期處理方案,觀察組采用FTS圍手術期處理方案。見表2。

表2 兩組圍手術期處理方案
1.2.1.1 常規圍手術期處理方案 (1)術前告知病情;(2)術前1 d口服緩瀉劑,避免胃腸道過量氣體、糞便影響腹腔鏡操作;(3)術前嚴格禁食 12 h,禁飲 4 h;(4)術前留置導尿管,于術后48 h去除;(5)術前留置胃管,術后第5天,經口少量飲水,未發現腹腔引流液渾濁、無腹脹、嘔吐后,于術后6~7 d拔除;(6)術中、術后常規非控制性輸液;不重視術中保溫;(7)留置腹腔引流管2~3根,經口飲水后未發現明顯吻合口瘺,腹腔引流液色淡、量少時拔除,約留置7 d;(8)術前30 min、手術開始3 h后及術后預防性應用頭孢米諾3~5 d;(9)胃管拔除后允許進食,由流質飲食逐步過渡到進食普通食物;(10)患者根據自我耐受情況選擇合適的活動方式;(11)患者疼痛呼叫時給予鎮痛劑。
1.2.1.2 FTS圍手術期處理方案 (1)術前營養評估,健康宣教及告知FTS處理方案。(2)不常規行術前腸道準備。(3)術前6 h禁食,術前2 h在護士指導下口服5%葡萄糖200 mL。(4)麻醉成功后留置導尿管,術后24 h拔除。(5)術前備導絲鼻胃管入手術室,根據胃腔的擴張與否決定是否行鼻胃管放置,擴張解除者復蘇前拔除鼻胃管。(6)術中、術后控制性輸液,維持血壓、循環穩定情況下,盡量減少液體輸注;重視術中保溫。(7)減少腹腔引流管的放置,留置1~2根,3~4 d內拔除。(8)術前30 min、手術開始3 h后及術后預防性應用頭孢米諾不超過24 h。(9)術后第1天,經口間斷飲清流質200 mL,術后第2天根據患者情況增加清流質的攝入量;術后第3天,經口間斷飲腸內營養制劑,并逐步過渡到半流質飲食。(10)患者清醒后便鼓勵床上活動并囑其早期下床活動,規定下床活動時間。(11)嚴格記錄患者疼痛評分,按照評分給予鎮痛。
表3 兩組患者手術前后體液免疫學指標比較(±s,g/L)

表3 兩組患者手術前后體液免疫學指標比較(±s,g/L)
注:與同組術前比較,aP<0.05
表4 2組患者手術前后的T細胞亞群指標變化(±s)
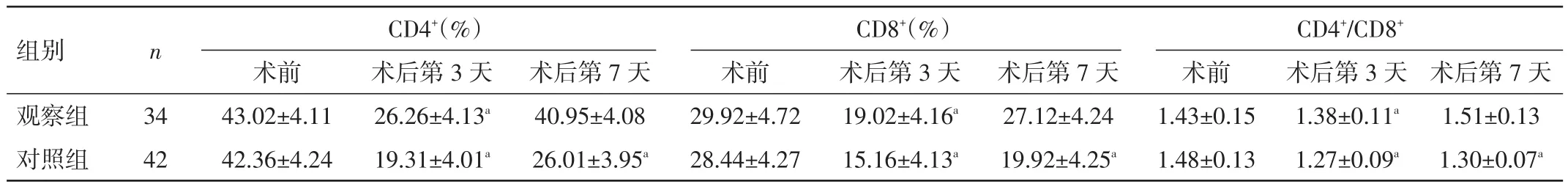
表4 2組患者手術前后的T細胞亞群指標變化(±s)
注:與同組術前比較,aP<0.05
表5 兩組患者手術前后營養指標變化(±s,g/L)

表5 兩組患者手術前后營養指標變化(±s,g/L)
注:與同組術前比較,aP<0.05;與對照組同時間比較,bP<0.05
1.2.2 觀察指標 于術前、術后3、7 d晨起空腹抽取外周靜脈血,檢測免疫球蛋白(IgG、IgA、IgM)、T細胞亞群(CD4+、CD8+)及血清清蛋白(ALB)、前清蛋白(PAB)、轉鐵清蛋白(TRF)水平。
1.3 統計學處理 采用SPSS24.0統計學軟件進行分析,計量資料以表示,采用t檢驗;計數資料以率或構成比表示,采用χ2檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 兩組患者手術前后體液免疫學指標比較 兩組患者術前IgG、IgA、IgM水平比較,差異無統計學意義(P>0.05);術后第 3天,兩組患者 IgG、IgA、IgM 3項指標均有不同程度的下降,但對照組下降更為明顯,術后第7天觀察組基本恢復至術前水平,但對照組仍明顯低于術前,差異均有統計學意義(P<0.05)。見表3。
2.2 手術前后T細胞亞群指標比較 兩組患者術前CD4+、CD8+、CD4+/CD8+水平比較,差異均無統計學意義(P>0.05);兩組術后第 3 天 CD4+、CD8+、CD4+/CD8+水平較術前均降低,對照組降低更明顯,差異均有統計學意義(P<0.05);術后第 7 天,觀察組 CD4+、CD8+、CD4+/CD8+基本恢復至術前水平,而對照組仍低于術前,差異均有統計學意義(P<0.05)。見表 4。
2.3 兩組患者手術前后營養指標變化 兩組患者術前ALB、PAB、TRF水平比較,差異均無統計學意義(P>0.05);術后第3天均明顯下降,術后第7天有所上升,且觀察組術后第3、7天血清各指標水平均高于對照組,差異均有統計學意義(P<0.05)。見表5。
3 討 論
腫瘤的發生、發展與機體的免疫功能密切相關,根據腫瘤免疫編輯理論,機體免疫功能低下是腫瘤發生發展的重要促進因素[4]。胃癌是我國的最常見的惡性腫瘤之一,死亡率居惡性腫瘤的第二位[5],相較結直腸癌患者的預后較差。有研究表明,胃癌患者的淋巴細胞、免疫球蛋白、補體及細胞因子均低于結直腸癌,可能與胃癌患者大都有明顯的食欲減退、惡心、嘔吐等影響營養物質的消化吸收有關[6]。有研究表明,營養不良對免疫系統的各個環節均有顯著影響,營養不良使免疫功能受損,免疫功能受損則導致機體腫瘤抑制作用減弱,造成腫瘤術后出現轉移復發[7],三者間形成惡性循環。所以營養不良及免疫功能低下勢必影響患者的遠期預后,因此,改善機體術后的營養狀況及免疫功能對胃癌患者十分重要。腹腔鏡胃癌根治術作為微創手術,相較傳統開腹手術在減輕手術應激,保護免疫功能,縮短術后住院時間方面的優越性已有文獻報道[8?9],在腹腔鏡微創手術的基礎上進一步的保護患者的免疫功能及改善術后營養狀況是一個值得探討的課題。2001年,丹麥“快速康復外科之父”KEHLET正式提出FTS理念,其是一系列有效措施的組合,其內容包括術前宣教,消化道準備,麻醉方式,術中操作,引流管放置,術后鎮痛,早期腸內營養支持,早期活動等多個方面的處理流程,并需要結合患者自身實際制定個體化的操作方案。國內多個醫療中心的相關研究證實,將FTS運用于胃癌根治手術并沒有增加術后并發癥,提示FTS運用于胃癌外科是安全可行的[10]。
FTS強調術前宣教,并且貫穿整個圍手術期,其內容包括詳細告知患者病情及治療措施,以及手術相關的風險及術后可能并發癥及處理,特別強調與傳統模式之間的差異,讓患者及家屬充分了解術前、術后各個環節及要求,緩解患者術前焦慮及恐懼感,減輕生理應激反應。術前宣教是FTS程序在治療全程能順利得以實施的重要環節。
研究表明,傳統口服瀉藥及清潔灌腸等嚴格消化道準備并沒有減少患者腹腔感染及吻合口瘺發生,相反,可能導致胃腸道組織水腫,以及患者水電解質和酸堿失衡,增加術后創傷應激的風險[11]。FTS強調短時間禁食,術后早期口服腸內營養液能有效促進消化液及胃腸激素的分泌,保護胃腸黏膜屏障功能,減輕腸道細菌及內毒素易位,從而保護及改善患者術后的營養狀況及免疫功能。
RAMíREZ等[12]研究證實,腹部手術限制補液感染的發生率要低于常規補液,可能與術后限制補液能減少白細胞介素 6(IL?6)、IL?10、腫瘤壞死因子 α(TNF?α)等炎性因子的分泌,從而降低術后感染的風險。術中體溫的保持也是FTS重要的一環,術中低體溫將導致復溫過程中產生應激,損害凝血機制及白細胞功能,注意術中保溫具有減少術中出血及術后感染,并且具有減輕術后的分解代謝、改善機體負氮平衡的意義[13]。
術后早期下床活動有利于促進全身血液循環,增加機體合成代謝,促進胃腸道功能的恢復,有效避免術后腸粘連及腸梗阻,減少下肢深靜脈血栓發生的風險。術中及術后長時間放置胃腸減壓管,腹腔引流管及尿管,有引起機體發熱、肺不張和肺炎,破壞機體黏膜屏障及免疫穩態的可能[14],對于腸道內環境的平衡也有一定的影響,并且限制患者早期的下床活動。
本研究的結果顯示,觀察組術后第3、7天IgG、IgA、IgM、CD4+、CD8+、CD4+/CD8+水平均高于對照組,且第7天基本恢復至術前水平,而對照組仍顯著低于術前,表明在FTS的實施下能有效保護并維持機體的免疫功能。機體抗腫瘤的免疫機制主要是細胞免疫,CD4+/CD8+反映機體細胞免疫水平的高低,比值降低說明免疫功能下降,且殺傷腫瘤的主要效應細胞是CD8+CTL,因而CD4+/CD8+及CD8+細胞水平的穩定能提高機體抗腫瘤的能力,抑制腫瘤的復發轉移[15]。本研究還顯示患者術后第3天血清ALB、PAB、TRF水平均明顯下降,術后第7天有所上升,且觀察組指標術后第3、7天明顯高于對照組,提示FTS能有效改善患者術后的營養狀態,從而維持機體正常的免疫功能。
有人強調FTS是繼腹腔鏡外科手術后的又一次外科革命,腹腔鏡外科手術需要在FTS的理念下進行才能充分發揮微創外科的優勢。本研究證實將符合條件的擇期腹腔鏡胃癌根治術患者納入FTS路徑能明顯改善手術及圍手術相關措施對患者免疫功能及營養狀態的不良影響,改善機體術后的免疫功能,對增強術后患者抗腫瘤轉移和復發的能力,改善遠期預后具有積極的意義。
[1]季加孚,季鑫,步召德.進展期胃癌的綜合治療[J].臨床外科雜志,2014(10):715?717.
[2]余佩武,錢鋒,郝迎學,等.腹腔鏡胃癌根治術726例的療效分析[J].中華消化外科雜志,2011,10(1):44?47.
[3]丁杰,廖國慶,晏仲舒,等.腹腔鏡與開腹D2遠端胃切除術治療胃癌的 meta分析[J].中國普通外科雜志,2013,22(4):401?408.
[4]MEDZHITOV R,JANEWAY CA.How does the immune system distin?guish self from nonself?[J].Semin Immunol,2000,12(3):185?188.
[5]羅盛,馬峻嶺,陳景武.惡性腫瘤死亡率地域分布的趨勢面分析[J].中國衛生統計,2008,25(4):357?359.
[6]雷尚通,薛琪,石漢平.胃癌,大腸癌患者營養及免疫功能比較[J].中國普通外科雜志,2005,14(1):63?64.
[7]SHIMURA T,TOIYAMA Y,TANAKA K,et al.Angiopoietin?like pro?tein 2 as a predictor of early recurrence in patients after curative surgery for gastric cancer[J].Anticancer Res,2015,35(9):4633?4639.
[8]孫小飛,何子銳.腹腔鏡與開腹根治術對進展期胃癌患者免疫及應激水平的影響[J].海南醫學院學報,2016,22(22):2721?2723.
[9]張治國,薛慧婧,宋仕茂,等.腹腔鏡根治術治療胃癌的效果觀察及其免疫功能和應激炎性因子的變化情況分析[J].胃腸病學和肝病學雜志,2015,24(6):724?727.
[10]姜志偉,黎介壽,李寧,等.胃癌患者運用加速康復外科治療的安全性及有效性研究[J].中華外科雜志,2007,45(16):1314?1316.
[11]SUGISAWA N,TOKUNAGA M,MAKUUCHI R,et al.A phaseⅡstudy of an enhanced recovery after surgery protocol in gastric cancer surgery[J].Gastric Cancer,2016,19(3):961?967.
[12]RAMíREZ JM,BLASCO JA,ROIG JV,et al.Enhanced recovery in colorectal surgery:a multicentre study[J].BMC Surg,2011(11):9.
[13]汪劉華,王道榮,魚海峰,等.快速康復外科模式在腹腔鏡胃癌根治術中的應用[J].中國現代普通外科進展,2012,15(6):444?446.
[14]ABRAHAM N,ALBAYATI S.Enhanced recovery after surgery pro?grams hasten recovery after colorectal resections[J].World J Gastroin?test Surg,2011,3(1):1?6.
[15]JOSEFOWICZ SZ,LU LF,RUDENSKY AY.Regulatory T cells:mecha?nisms of differentiation and function[J].Annu Rev Immunol,2012(30):531?564.

