初診2型糖尿病合并周圍神經病變與氧化應激和炎性反應的關系研究
王樂+牛國棟

[摘要] 目的 探討初診2型糖尿病合并周圍神經病變與氧化應激和炎性反應與的關系。方法 選取于2015年4月—2017年4月的68例初診2型糖尿病合并周圍神經病變患者為周圍神經病變組,68例無周圍神經病變的初診2型糖尿病患者為糖尿病組,68名健康體檢者為正常組,用ELISA法分別測定3組的白細胞介素-1β(IL-1β)、白細胞介素-6(IL-6)、炎性細胞因子腫瘤壞死因子α(TNF-α)水平。用多因素相關分析法,對初診2型糖尿病合并周圍神經病變與氧化應激、炎性反應之間關系進行系統化分析。結果 糖尿病組、周圍神經病變組SOD、IL-1β、TNF-α、2 hPG、FPG、MDA、IL-6、HbA1c水平較正常組,均顯著偏高(P<0.05)。經多因素相關分析得知,MDA、IL-6、TNF-α對初診2型糖尿病有無合并周圍神經病變,均有較好的獨立作用,且SOD與MDA之間呈現明顯負相關。結論 在2型糖尿病周圍神經病變的發生、發展中,均有免疫炎性與氧化應激反應參與。
[關鍵詞] 初診2型糖尿病;周圍神經病變;氧化應激;炎性反應;關系
[中圖分類號] R587.2 [文獻標識碼] A [文章編號] 1672-4062(2017)09(b)-0169-02
糖尿病周圍神經病變(DPN)為2型糖尿病的一種慢性、多發與常見型并發癥,發病率達45%~85%,是基礎病致殘的重要誘因。針對2型糖尿病并發癥的傳統預防而言,多以高脂毒性、高糖毒性為中心來展開,但許多患者在血脂、血壓與血糖均得到較好控制狀況下,仍發生了不同程度的DPN[1]。近年來,已有較多關于2 型糖尿病周圍神經病變發生、發展中免疫損傷、氧化應激所產生影響方面的研究,但多為動物試驗,以糖尿病患者為對象的研究卻不多[2]。該次研究于2015年4月—2017年4月收治的136例患者針對初診2型糖尿病合并周圍神經病變患者,探討免疫損傷、氧化應激在其發生、發展中所起到的作用,現報道如下。
1 資料與方法
1.1 一般資料
選取該院于收治的136例初診2型糖尿病患者,均與世界衛生組織(WHO)于1999年所制定的糖尿病診斷及分型標準相符[3],排除有既往診斷或治療經歷的糖尿病、肝腎功能異常、高血壓、高胰島素血癥及其他類型糖尿病者。將68例合并有周圍神經病變患者作為周圍神經病變組,其中,男32例,女36例,平均年齡(53.4±16.2)歲;68例未合并患者為糖尿病組,男34例,女34例,平均年齡(53.2±15.9)歲;選取68名健康體檢者為正常組,男33名,女35名,平均年齡(53.2±16.3)歲,均無心腦血管疾病、肝腎骨關節病及糖尿病家族史等。3組一般資料比較,差異無統計學意義(P>0.05)。
1.2 研究方法
1.2.1 生化指標檢測 用全自動生化儀(Premier Hb9 210型)及標準試劑,測定患者糖化血紅蛋白(HbA1c)水平;AU5 800全自動生化分析儀,測定2 h血糖(2 hPG)、空腹血糖(FPG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、總膽固醇(TC)及三酰甘油(TG);用放免法,測定空腹、餐后2 h的C肽水平;UV-2 100型分光光度計聯合黃嘌呤氧化酶法,測定血清超氧化物歧化酶(SOD)的活性,另用此光度計聯合硫代巴比妥酸法,完成血清丙二醛(MDA)水平的測定;雙抗體夾心ELISA法測定血漿IL-6、IL-1β、TNF-α的水平。
1.2.2 肌電圖檢查 用Keypoint肌電誘發儀,對尺神經、腓淺神經及腓總、正中神經的感覺神經傳導速度進行監測。
1.3 統計方法
采用SPSS 21.0統計學軟件處理數據,t檢驗計量資料,χ2檢驗計數資料,并分別用(x±s)、[n(%)],表示P<0.05為差異有統計學意義。
2 結果
2.1 3組生化指標對比
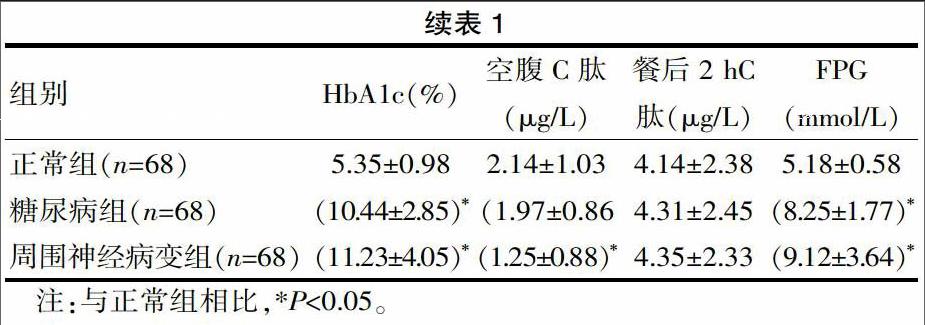
糖尿病組、周圍神經病變組的HbA1c、2 hPG及FPG相比正常組,均顯著高于后者(P<0.05);周圍神經病變組LDL-C、TC較正常組,均低于后者(P<0.05)。見表1。
2.2 3組SOD、IL-6、TNF-α、MDA與IL-1β水平對比
糖尿病組、周圍神經病變組血清MDA、IL-1β、IL-6、TNF水平較正常組,均高于后者(P<0.05);SOD水平相比正常組,低于后者(P<0.05)。周圍神經病變組上述指標水平較糖尿病組,均高于后者(P<0.05)。
2.3 多因素Logistic回歸分析結果
2型糖尿病患者中,因變量:有無糖尿病周圍神經病變;自變量:MDA、SOD、TNF-α、IL-6、TG、HDL、HbA1c、FPG、2 hPG等,開展自變量行Logistic回歸分析,最終結果得知,MDA、IL-6、TNF-α對初診2型糖尿病有無合并周圍神經病變,均有較好的獨立作用,且SOD與MDA之間呈現明顯負相關。見表2。
3 討論
糖尿病周圍神經病變(DPN)能累及運動、感覺、自主等神經功能,產生較強烈麻木感與疼痛感,引發運動障礙,嚴重者會造成下肢壞疽。對于其病理改變而言,即運動、感覺神經出現明顯的斑塊樣脫髓鞘,于顯微鏡下,通過細致觀察離體單根神經纖維,能察知呈節段性的脫髓鞘改變,甚至能見軸索變性,而部分纖維還可能出現髓鞘再生狀況,位于神經束間的各滋養小動脈壁,會出現異常性增厚,而且還會透明變性,嚴重者會形成血栓、管腔狹窄等。機體自主神經同樣能出現廣泛性病變,除了會累及內臟交感神經、自主神經細胞之外,還會造成神經終末端發生變性(脊髓后根、運動終板等)[4]。對于DPN發病機制而言,至今尚未明確,已知其病發病并不是單一因素所造成,主要發病機制為缺氧缺血的微血管病變、自身免疫、代謝毒性所造成的氧自由基形成過多、氧化應激、神經營養因子缺乏等,因此,盡管進行了控血脂、血壓及血糖治療,但效果并不佳,許多患者仍然會發生DPN,由此表明,DPN可能有其他發病機制。endprint
相關研究指出[5],體內脂質過氧化作用所導致的脂肪酸共價鍵上諸多自由基反應,均會造成MDA顯著升高,而MDA能使蛋白質核酸細胞突變、生物膜變性及交聯,另外,還能交聯于蛋白質(含游離氨基酸),形成Schiff堿基,此堿基能使血管基底膜異常性增厚,使結締組織當中的透明質酸大幅降低,最終喪失黏性,除此之外,還會使細胞之間的填充粘合質,遭受嚴重破壞,最終增加微血管通透性。由該次研究可知,有、周圍神經病變組的糖化血紅蛋白、餐后血糖及空腹血糖均比較高,但二組比較差異無統計學意義(P>0.05),表明周圍神經病變的發生無關于血糖;周圍神經病變組的MDA水平相比糖尿病組(無周圍神經病變組),顯著偏高,表明隨著機體內脂質自由基的持續性受損,終產物濃度的非正常性增加,會持續增強氧化應激;此外,周圍神經病變組SOD水平明顯低于糖尿病組,表明伴隨機體內抗氧化物質消耗量的持續增加,機體抗氧化能力呈現持續下降趨勢;經Logistic回歸分析得知,MDA為影響初診2型糖尿病周圍神經病變的重要因素,另由MDA與SOD之間呈現顯著負相關可知,體內氧化與抗氧化呈現失衡狀態,表明在糖尿病周圍神經病變中,氧化應激發揮著重要作用,由此證明,作為反映體內氧化應激狀況的SOD、MDA,其與DPN的發生、發展之間存在密切關聯。
綜上所述,在2型糖尿病周圍神經病變的發生、發展中,均有免疫炎性與氧化應激反應參與。
[參考文獻]
[1] 阮園. 依帕司他聯合甲鈷胺治療糖尿病周圍神經病變療效觀察及其與氧化應激的關系研究[D]. 南京:南京醫科大學, 2012.
[2] 汪曉霞, 朗寧, 劉思穎,等. 谷胱甘肽對2型糖尿病周圍神經病變患者血清氧化應激指標及感覺神經傳導速度的影響[J]. 中國醫師進修雜志, 2011, 34(13):14-16.
[3] 張秋萍. α-硫酸鋅聯合神經妥樂平對2型糖尿病合并周圍神經病變患者血清GGT MDA及GSH-Px水平的影響[J]. 中國實用神經疾病雜志, 2017, 20(14):70-72.
[4] 鄭敏, 杜義斌, 陳必勤,等. 中西醫結合抗氧化應激對糖尿病周圍神經病變的臨床研究[J]. 云南中醫中藥雜志, 2016, 37(2):30-31.
[5] 梁曉玲. 硫辛酸聯合甲鈷胺治療糖尿病周圍神經病變療效觀察[J]. 中國藥物與臨床, 2012, 12(11):1489-1491.endprint

