固氮菌Kosakonia radicincitans GXGL-4A對玉米和水稻的促生作用及其根際定殖動態
程杰杰, 殷超凡, 薩爾山別克·熱阿合曼, 孫帥欣, 陳云鵬
[上海交通大學農業與生物學院/農業部都市農業(南方)重點實驗室,上海 200240]
氮元素作為構成蛋白質和核酸的重要元素,對動植物及微生物都有非常重要的意義。土壤氮素在作物氮素供應上占有重要地位,通過向耕地中增施氮肥來提高作物產量是農業生產上的重要措施[1]。空氣中雖然存在大量的氮氣,但不能直接被植物吸收利用,只有轉化為硝酸鹽、亞硝酸鹽等化合物后才能被植物吸收。生物固氮即固氮微生物將大氣中的氮氣還原成氨的過程,是自然界氮循環的主要環節[2]。當前氮肥的主要來源是化工生產,化學氮肥的使用曾為我國農作物的增產作出了突出貢獻[3-4],但同時產生很多環境問題,造成農業點源污染和面源污染[5-7]。
由于氮素化肥的生產伴隨著能源的消耗和日趨嚴重的環境污染等問題,因此生物固氮研究日益受到各國政府的重視。目前發現的具有生物固氮能力的微生物多為細菌,有100多個屬,占細胞系統發育分支的1/2以上[8]。不同固氮菌的固氮能力差異比較明顯,即使是同種固氮菌在不同的環境條件下或在不同的宿主內也會表現出固氮能力的差異[9]。雖然固氮菌的固氮能力差異較大,但均能在一定程度上促進植物的生長,提高農作物的產量[10]。
本研究測定固氮菌GXGL-4A在LB液體培養基(有氮)、A15液體培養基(無氮)中的生長曲線;以玉米、水稻為試驗對象,在其生長過程中施用不同濃度的GXGL-4A,通過測定玉米、水稻的鮮質量、株高、根長、根鮮質量等指標,并進行數理統計分析發現,GXGL-4A對水稻和玉米的生長具有促生作用,且該促生作用在一定范圍內隨GXGL-4A濃度的增大而增強;對GXGL-4A在玉米根際土壤中的消長動態進行監測,獲得其在玉米根際土壤中的消長動態變化情況,可為固氮菌固氮機制的進一步研究及微生物菌肥的開發提供理論依據。
1 材料與方法
1.1 材料
1.1.1 供試菌株 固氮菌KosakoniaradicincitansGXGL-4A(簡稱GXGL-4A)分離自廣西桂林的玉米根部,為革蘭氏陰性菌,有莢膜,能泌銨和胞外多糖類黏性物質,菌體大小約為1.5 μm×0.5 μm。菌體呈桿狀,具端生鞭毛。
載體質粒pET28a(+)攜帶有卡那霉素抗性基因(kanr)標記,由筆者所在實驗室余傳金惠贈。
1.1.2 種子 玉米種子先玉335(非抗旱品種)和寧玉721(抗旱品種)均購自青上農業科技(吉林)有限公司,水稻種子CBB23由上海交通大學農業與生物學院陳功友教授實驗室饋贈。
1.1.3 主要試劑及儀器 2×TaqPCR Master Mix、6×Loading buffer、SanPrep柱式DNA膠回收試劑盒及SanPrep柱式質粒DNA小量抽提試劑盒,均購自生工生物工程(上海)股份有限公司;DNA marker,購自天根生化科技(北京)有限公司;Goldview核酸染料,購自上海少辛生物科技有限公司;卡那霉素(Kan),購自美國Amresco公司;其他試劑均為國產分析純。
Leica DM2500熒光顯微鏡(萊卡微系統公司);BSW-200B 臺式恒溫搖床(上海啟步生物科技有限公司);ZDP-2120電熱恒溫培養箱(上海智城分析儀器制造有限公司);Minispin?離心機、Eppendorf BioPhotometer生物分光光度計(德國Eppendorf公司);超凈工作臺(上海智城分析儀器制造有限公司)。
1.2 方法
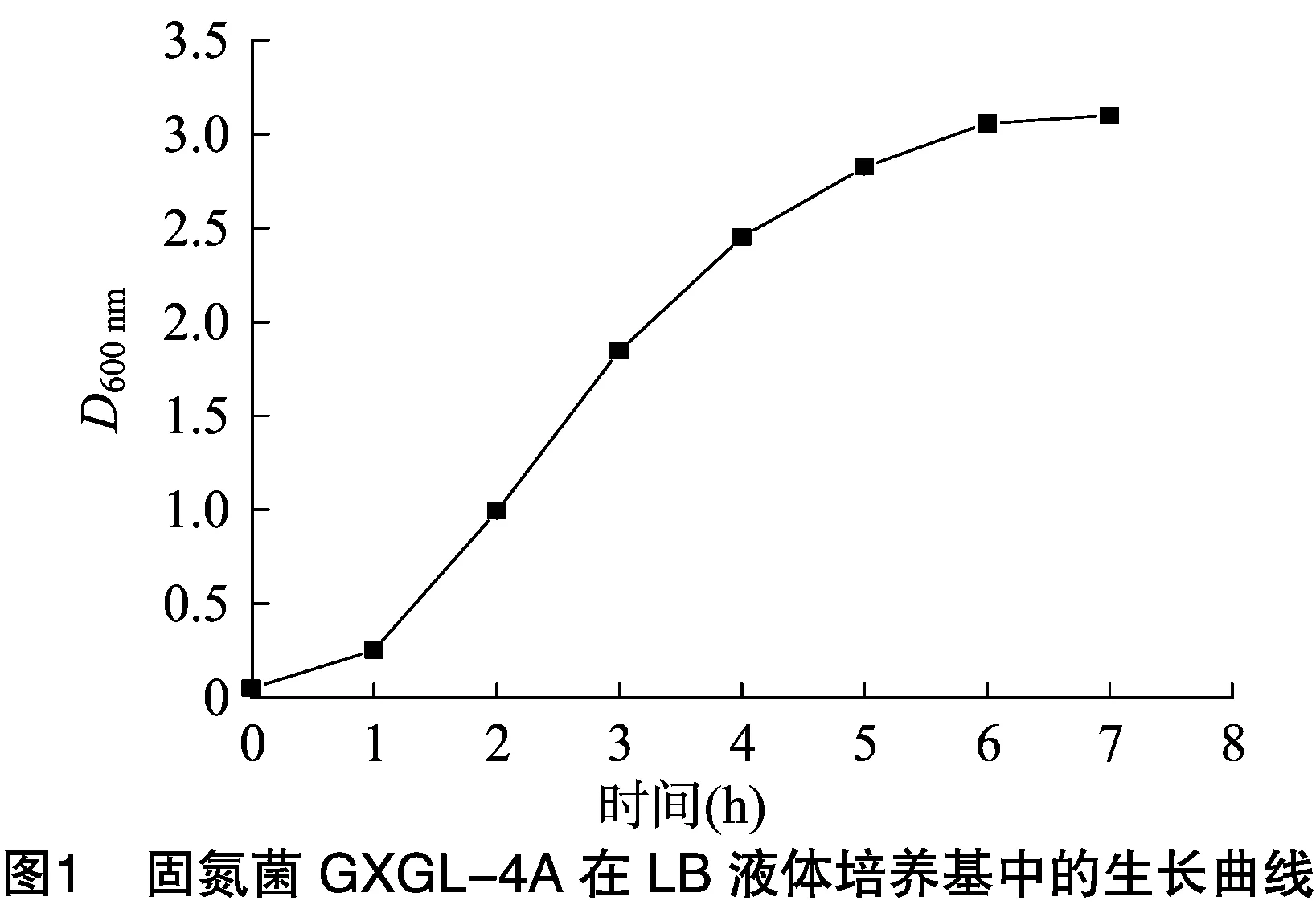
1.2.1 固氮菌GXGL-4A生長曲線測定 以體積分數1%的接種量將固氮菌GXGL-4A接入LB液體培養基(有氮)中,每隔1 h用分光光度計測量1次菌液在600 nm處的吸光度并進行記錄。以相同接種量將固氮菌GXGL-4A接入A15液體培養基(無氮)中,8 h后以相同方法測量菌液在600 nm處的吸光度并進行記錄,以后每隔3 h進行1次測量。
1.2.2 固氮菌GXGL-4A促生作用研究
1.2.2.1 種子消毒與催芽 將種子在水中浸泡4 h后,用蒸餾水徹底沖洗干凈,然后移至75%乙醇中處理2 min,用無菌水清洗2次后,用5% NaClO溶液浸泡5 min,再用無菌水清洗2次。將消毒的玉米和水稻種子用紗布包起來后置于 28 ℃ 恒溫培養箱中培養至出芽,出芽標準為胚根與種子等長。
1.2.2.2 固氮菌GXGL-4A的培養 將固氮菌GXGL-4A以1%接種量接種到LB液體培養基中,于37 ℃、160 r/min的條件下振蕩培養約4 h(D600 nm約為1.0),然后在離心機中以8 000 r/min的轉速離心10 min,用無菌水洗滌菌體沉淀2次后,再用無菌水將其依次稀釋為104、106、108CFU/mL等3個濃度梯度,備用。
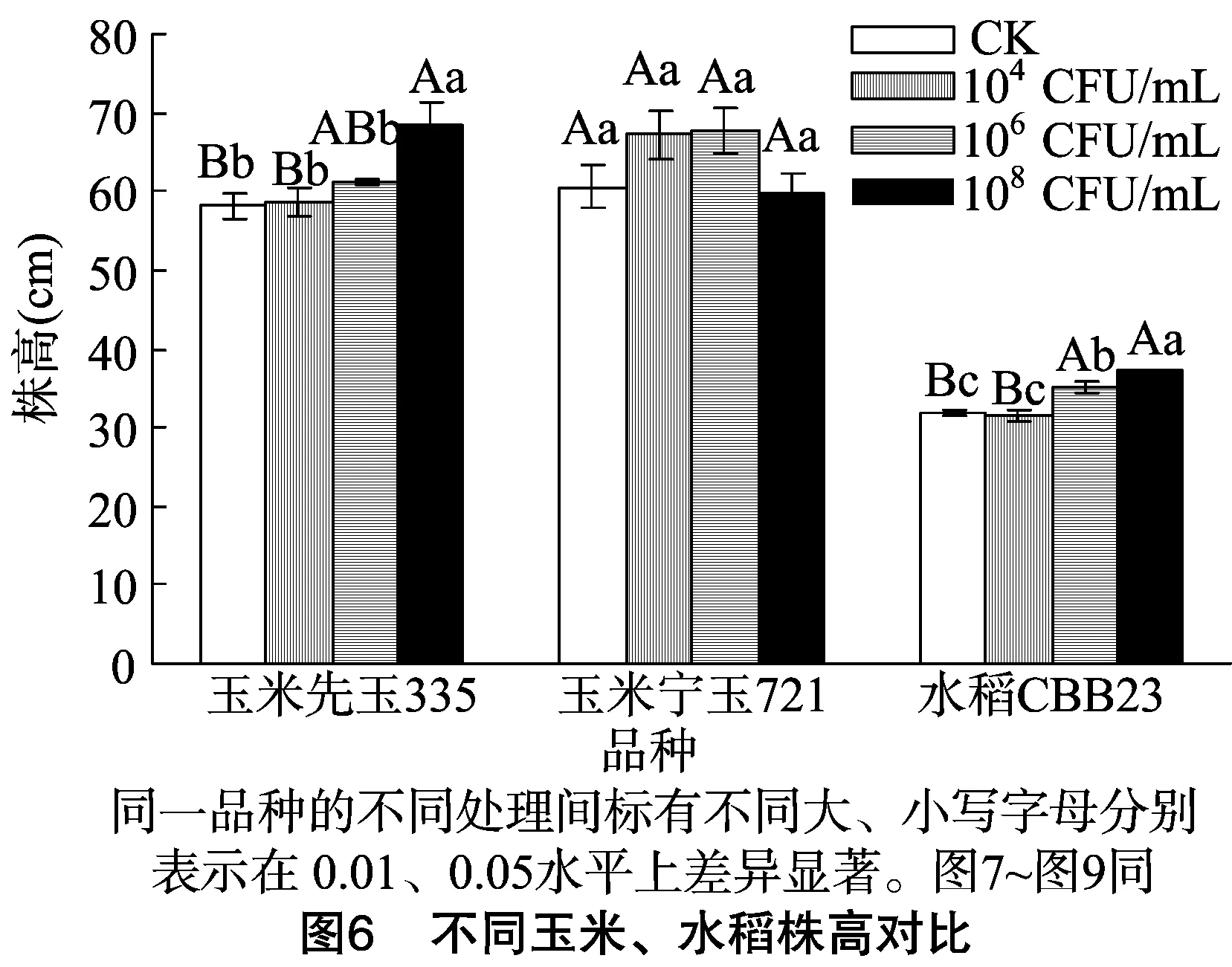
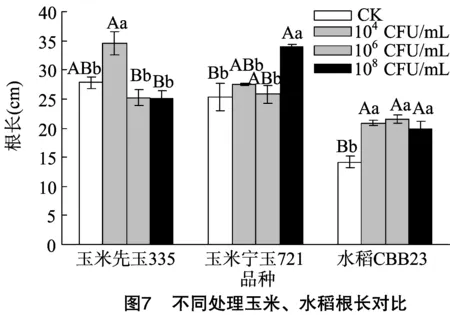
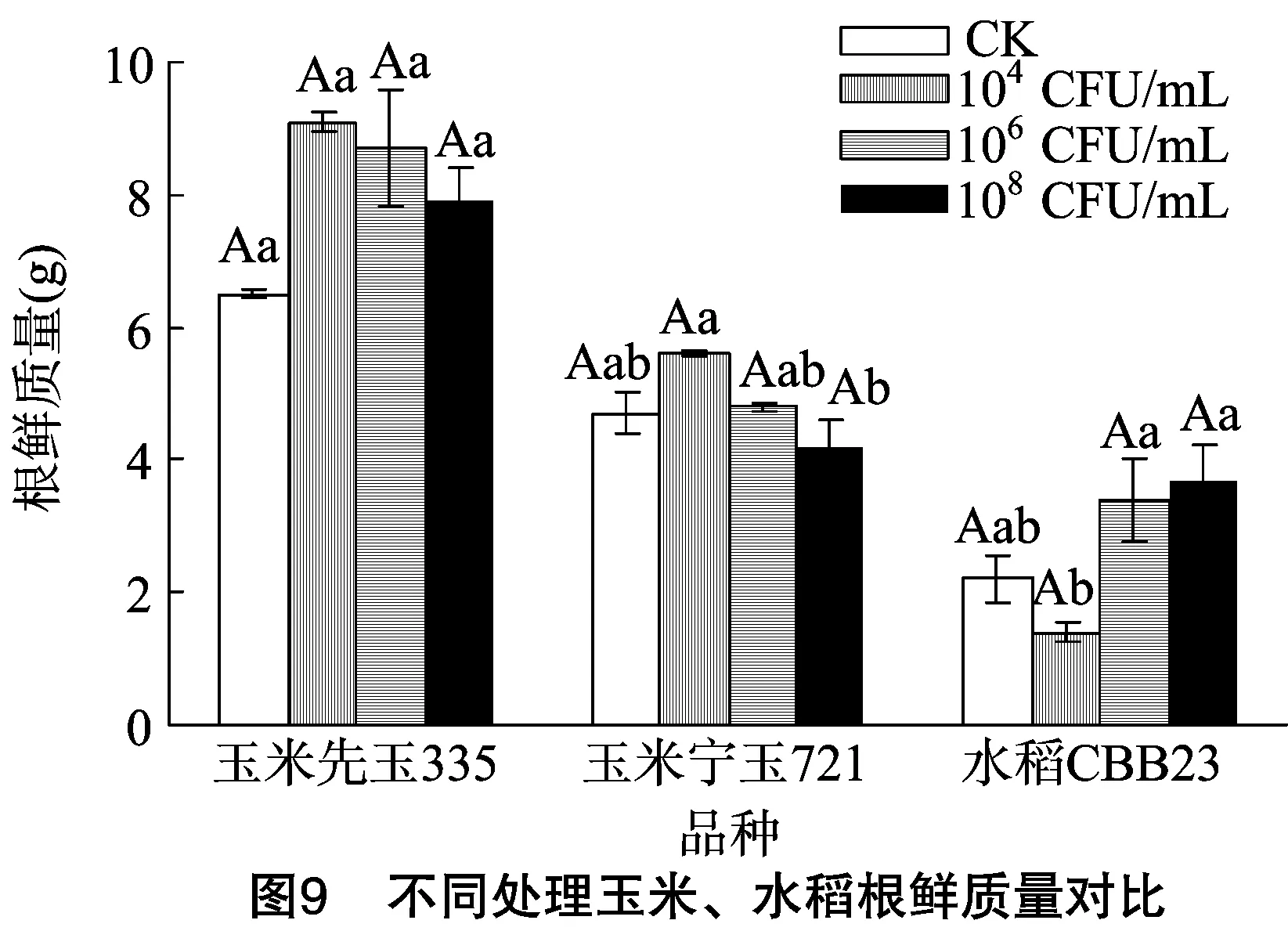
1.2.2.3 玉米、水稻種植與接種處理 將發芽的玉米種子植入塑料花盆(內徑20 cm、高20 cm),出苗期每隔24 h于同一時間(12:00)澆水1次,觀察記錄出苗情況。將大小長勢基本一致的玉米、水稻幼苗分別移栽到相同規格的塑料花盆內,設置對照組(CK)和3個濃度梯度(104、106、108CFU/mL)試驗組,3次重復。移栽2 d(展出1或2張真葉)后,試驗組每隔3 d對幼苗莖基部施加1次固氮菌GXGL-4A(1 mL/株),對照組加等量無菌水,共計接種7次,培養期間每天12:00澆1次水,以保持土壤濕潤。
1.2.2.4 數據采集與分析 接種后30 d,測量每株玉米、水稻的鮮質量、株高、根長、根鮮質量,試驗數據通過Excel和SPSS進行分析處理。
1.2.3 根際定殖動態研究
1.2.3.1 固氮菌GXGL-4A卡那霉素抗性標記 將帶有pET28a(+)質粒的大腸桿菌以體積分數1%的接種量接入LB液體培養基中,于37 ℃、160 r/min條件下振蕩培養約 12 h,然后用試劑盒提取質粒。將提取好的質粒用電擊轉化法轉入固氮菌GXGL-4A中,將轉化菌液涂布于LB固體培養基(含50 μg/mL Kan)平板上,置于37 ℃恒溫培養箱內過夜培養,然后挑取陽性轉化子。
1.2.3.2 土壤處理 采集大田熟土600 g,稱取其中的300 g平鋪于托盤內,置于120 ℃恒溫箱內干熱滅菌5 h,待土壤自然冷卻后裝入無菌袋內備用;剩余土壤不進行滅菌處理,而是直接裝入無菌袋內備用。
1.2.3.3 種子消毒與催芽 種子消毒與催芽方法同 “1.2.2.1” 節。種子出芽后,播種于含50 g滅菌土的塑料采樣罐(高10 cm,內徑6 cm)內,即為封閉系統處理;播種于含50 g非滅菌土的塑料采樣罐內,即為開放系統處理。每罐播3粒種子,設3次重復。
1.2.3.4 標記菌GXGL-4A的培養及在玉米根際土壤的釋放 待種子破土后,采用灌根法接種固氮菌GXGL-4A。標記菌于含有50 μg/mL卡那霉素的LB液體培養基中,在 37 ℃、180 r/min條件下培養24 h后,取5 mL用無菌水稀釋至 50 mL(接種濃度1×107CFU/mL),用移液器緩慢地釋放至玉米幼苗的根際土壤中。
1.2.3.5 消長動態監測 分別于釋放后1、3、6、9、12、15 d取3罐幼苗根際土壤各1 g,加入到9 mL無菌水中渦旋振蕩 15 min,即為10-1稀釋度,根據含菌量用無菌水進行梯度稀釋,取稀釋后菌液200 μL涂布于含有50 μg/mL卡那霉素的LB平板上,并置于37 ℃恒溫培養箱內進行過夜培養。統計每個培養皿的菌落數,計算平均1 g根際土壤的含菌量。試驗時以釋放后1 h回收的細菌數量為初始接種量。
1.2.3.6 數據采集與分析 試驗數據通過Excel和SPSS進行分析與處理。
2 結果與分析
2.1 固氮菌GXGL-4A生長曲線分析
由圖1、圖2可知,固氮菌GXGL-4A在LB液體培養基(富氮)、A15液體培養基(無氮)中均能生長,但生長速度不同。在LB液體培養基(富氮)中生長迅速,接種后約1 h即進入對數生長期,并在測定時間內其D600 nm一直增大;而在A15液體培養基(無氮)中細菌生長緩慢,接種后約10 h才進入對數生長期,約20 h達到生長最大值,之后其D600 nm逐漸減小。據此可知,在營養較豐富的條件下,固氮菌GXGL-4A生長迅猛,而在無氮條件下,固氮菌GXGL-4A雖也能生長,但增殖緩慢,這一結果表明,氮營養水平對固氮菌的生長至關重要。
2.2 固氮菌GXGL-4A促生作用分析
由表1至表3、圖3至圖9可知,試驗組玉米先玉335、寧玉721及水稻CBB23植株的株高、根長、根鮮質量、植株鮮質量等指標與對照組植株整體上差異明顯,固氮菌GXGL-4A對水稻CBB23的促生效果較2個供試玉米品種更好。
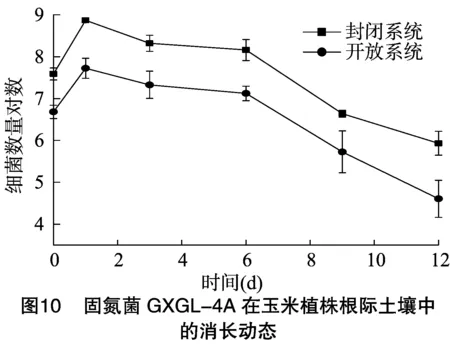
2.3 固氮菌GXGL-4A根際消長動態分析
從圖10可以看出,接種后1~15 d均可以從玉米植株根際土壤中檢測到標記菌,在封閉系統與開放系統內,玉米根際土壤的標記菌數量變化趨勢基本一致,均先增加后減少,并且均在釋放1 d后達到最大值;在相同的接種濃度(1×107CFU/mL)下,封閉系統內標記菌GXGL-4A的數量明顯高于開放系統,其原因可能是滅菌土內的微生物數量較少,接種后,固氮菌GXGL-4A迅速占據玉米根際土壤生態位而成為優勢種群,而在自然土內微生物群落非常復雜,接種后,固氮菌GXGL-4A與土壤中的原始微生物進行生態位競爭,導致接種后標記菌數量低于滅菌土。

表1 不同處理下玉米品種先玉335的生物量
注:同列數據后不同大、小寫字母分別表示在0.01、0.05水平上差異顯著。下表同。

表2 不同處理下玉米品種寧玉721的生物量

表3 不同處理下水稻品種CBB23的生物量
3 討論與結論
微生物的固氮作用在農業增產中具有十分重要的意義。本研究表明,固氮菌GXGL-4A在營養較豐富的條件下生長迅速,在無氮條件下也可通過自身固氮作用利用空氣中的氮氣維持自身生長,它對玉米和水稻生長具有顯著促生作用,整體上來看,施加固氮菌后的供試植株在株高、根長、根鮮質量及植株鮮質量等方面較對照植株生物量明顯提高。在一定濃度范圍內,其促生作用隨菌液濃度的增加而增強,尤其是根系表現最為明顯,固氮菌GXGL-4A能在根際土壤中迅速定殖并成為優勢種群,推斷其促生作用主要是通過根部定殖來實現的。



先前已有一些關于植物根際促生菌(plantgrowth promoting rhizobacteria,簡稱PGPR)的研究,主要集中在PGPR菌株的篩選、入侵機制以及促生機制等方面[11-13],研究結果表明,PGPR可通過固氮、解磷及產生植物生長調節劑等方式來促進植物生長[14-17]。對固氮菌的定殖觀測表明,固氮醋酸桿菌能從根尖和側根發生的周圍侵染植物[18],而固氮螺菌能在根表與皮層之間的周質空間內定殖[19]。雖然固氮菌所固定的氮素供給植物的很少,但細菌死亡后釋放的有機氮能逐步被植物吸收利用,此外,固氮菌可以分泌許多有機酸使植物根際pH值下降,使難溶性礦物質變得易溶,從而促進植物根系對各種營養物質的吸收,進而間接促進植物生長[20-21]。

本研究聚焦于固氮菌GXGL-4A的固氮促生作用,在后續研究中,將借助現代分子生物學技術進一步探究其固氮促生機制并對其進行遺傳改造,使其具有更強的適應能力和固氮能力,甚至開發成可施性生物肥料,應用前景廣闊。
[1]魯如坤. 我國土壤氮、磷、鉀的基本狀況[J]. 土壤學報,1989,26(3):280-286.
[2]楊 持,王祥榮,鄔建國,等. 生態學[M]. 北京:高等教育出版社,2008:250-253.
[3]Fan S,Pardey P G. Research,productivity,and output growth in Chinese agriculture[J]. Journal of Development Economics,1997,53(1):115-137.
[4]Wang J Y,Wang S J,Chen Y. Leaching loss of nitrogen in double-rice-cropped paddy fields in China[J]. Acta Agriculturae Zhejiangensis,1995,7(3):155-166.
[5]Fischer G,Winiwarter W,Ermolieva T,et al. Integrated modeling framework for assessment and mitigation of nitrogen pollution from agriculture:concept and case study for China[J]. Agriculture Ecosystems & Environment,2010,136(1/2):116-124.
[6]Velthof G L,Oudendag D,Witzke H R,et al. Integrated assessment of nitrogen losses from agriculture in EU-27 using MITERRA-EUROPE[J]. Journal of Environmental Quality,2009,38(2):402-417.
[7]Guo J H,Liu X J,Zhang Y,et al. Significant acidification in major Chinese croplands[J]. Science,2010,327(5968):1008-1010.
[8]陳文新. 生物固氮. 氮素循環與農業和環境學術研討會論文集[C]. 廈門:廈門大學出版社,2001:4-5.
[9]孫建光,羅 瓊,高 淼,等. 小麥、水稻、玉米、白菜、芹菜內生固氮菌及其系統發育[J]. 中國農業科學,2012,45(7):1303-1317.
[10]趙志強. 鄂爾多斯幾種沙生植物根際自身固氮菌的篩選及對楊柴接種效應研究[D]. 雅安:四川農業大學,2008.
[11]肖相政,劉可星,廖宗文. 短小芽孢桿菌BX-4抗生素標記及定殖效果研究[J]. 農業環境科學學報,2009,28(6):1172-1176.
[12]翁啟勇,陳慶河,趙 健,等. 利福平標記菌株BS1在番茄、茄子根部及土壤中的定殖動態[J]. 福建農業學報,2003,18(2):87-88.
[13]孫 華. 應用根際促生細菌防治大豆胞囊線蟲病的研究[D]. 沈陽:沈陽農業大學,2009.
[14]Roberto P,Zeno V,Paolo N,et al. The rhizosphere:biochemistry and organic substances at the soil-plant interface[M]. 2nd ed.Boca Raton:CRC Press,2007:73-109.
[15]朱培淼. 高效解磷細菌的篩選及其應用[D]. 南京:南京農業大學,2007.
[16]榮良燕,姚 拓,趙桂琴,等. 產鐵載體PGPR菌篩選及其對病原菌的拮抗作用[J]. 植物保護,2011,37(1):59-64.
[17]Asghar H N,Zahir Z A,Arshad M. Screening rhizobacteria for improving the growth,yield,and oil content of canola(BrassicanapusL.)[J]. Australian Journal of Agricultural Research,2004,55(2):187-194.
[18]Reis V M,Olivares F L,de Oliveira A L M,et al. Technical approaches to inoculate micropropagated sugar cane plants wereAcetobacterdiazotrophicus[J]. Plant and Soil,1999,206:205-211.
[19]Okon Y,Kapulnik Y. Development and function ofAzospirillum-inoculated roots[J]. Plant and Soil,1986,90:3-16.
[20]Bashan Y,Singh M,Levanony H. Contribution ofAzospirillumbrasilenseCd to growth of tomato seedlings is not through nitrogen fixation[J]. Canadian Journal of Botany,1989,67:2429-2434.
[21]Bremer E,Janzen H H,Gilbertson C. Evidence against associative N2fixation as a significant N source in long-term wheat plots[J]. Plant and Soil,1995,175:13-19.

