種子引發對鹽脅迫下向日葵種子萌發的影響
邸 娜, 韓海軍, 鄭喜清, 李旭紅, 韓鳳霞
(1.河套學院農學系,內蒙古巴彥淖爾 015000; 2.內蒙古自治區巴彥淖爾市農牧業技術推廣中心,內蒙古巴彥淖爾 015000; 3.內蒙古自治區巴彥淖爾市種子管理站,內蒙古巴彥淖爾 015000)
目前,土壤鹽漬化已經成為世界性難題,據聯合國教科文組織和世界糧農組織不完全統計,全世界鹽堿地面積約9.54億hm2。我國鹽漬化土壤面積龐大,各類鹽堿地面積總計 9 913.3萬hm2,其中鹽漬化土壤面積約3 693.3萬hm2,殘余鹽漬化土壤面積約4 486.7萬hm2,潛在鹽漬化土壤面積約 1 733.3萬hm2[1]。鹽脅迫對植物產生的傷害主要表現在滲透脅迫、離子毒害和營養虧缺[2],即土壤鹽堿化使土壤溶液的濃度和滲透壓增加,引起植物根系吸水困難,導致植物產生生理性干旱;同時鹽分在植物體內大量積累,影響植物正常的生理代謝,對植物產生毒害作用;鹽漬化土壤中Na+和Cl-對植物吸收其他礦質養分產生拮抗作用,造成植物體營養虧缺,影響同化產物積累[3]。重度鹽漬化土壤嚴重影響植物的正常生長發育,甚至導致植物難以生長,土地不能耕種。
向日葵對土壤具有一定的脫鹽作用,已成為開發鹽堿地、生物治理鹽漬化土壤的首選作物。雖然向日葵對鹽堿有一定的忍耐力,但忍耐能力有限,且品種間差異較大。研究表明,鹽脅迫下種子發芽率可用來評價向日葵的耐鹽性[4-5]。因此本研究以種子引發的方式處理向日葵種子,研究種子引發對向日葵種子萌發的影響,以期為進一步提高鹽漬化土壤中向日葵的出苗率提供一個參考途徑。
1 材料與方法
1.1 試驗材料
本試驗所用材料為向日葵食葵品種LD 3939,購自當地種子市場。
1.2 試驗方法
1.2.1 種子引發處理 設置引發時間和引發濃度2個處理,具體處理如下:(1)設NaCl溶液引發濃度為100 mmol/L,引發時間為0、4、8、12、18、24、36、48 h,于人工氣候箱中25 ℃進行暗處理;(2)設NaCl溶液引發濃度為0、50、100、150、200、250、300 mmol/L,引發時間為12 h,于人工氣候箱中25 ℃進行暗處理。每個處理重復3次,引發結束后用蒸餾水沖洗種子3次,吸水紙吸干后于室溫下72 h晾干[6]。
1.2.2 種子吸水試驗 挑選30粒大小均勻一致、引發處理過的向日葵種子,去殼,稱干質量,然后將其浸入100 mmol/L NaCl溶液中,每隔2 h取出種子,用吸水紙吸干表面水分后稱質量,連續稱量12 h,重復3次[7]。
1.2.3 萌發試驗 在直徑為12.0 cm的培養皿中鋪2層濾紙作為發芽床,挑選30粒均勻飽滿、不同引發處理的向日葵種子,加入3 mL 100 mmol/L NaCl溶液,蓋上培養皿蓋,置于人工氣候箱中進行發芽試驗。萌發條件:晝溫(25±2)℃,夜溫(15±2)℃;光—暗周期為14 h—10 h。為保證處理濃度的恒定性,每天更換濾紙,重新加入3 mL 100 mmol/L NaCl溶液,每個處理重復3次。以種子胚根突破種皮2 mm時作為種子發芽的標準,第7天視為萌發結束,停止調查[7]。每天統計萌發種子的數量,如種子有真菌污染須盡快除去,以免真菌污染而影響種子萌發。
1.3 計算方法
(1)發芽率(GP)=(最終發芽種子數/供試發芽總數)×100%;
(2)發芽勢(GE)=(第4天時發芽的種子總粒數/供試種子粒數)×100%[8];
(3)發芽指數(GI)=∑(Gt/Dt)(式中:Gt為第t天發芽種子數,Dt為相對應的發芽時間);
(4)平均發芽時間(MLIT)=∑(Gt×Dt)/∑Gt(式中:Gt為第t天發芽種子數,Dt為相應的發芽時間)。
1.4 數據統計分析
所有數據均以3次重復的平均值表示,用Excel 2003進行圖表制作,用SPSS 17.0進行差異顯著性分析。
2 結果與分析
2.1 種子引發對鹽脅迫下向日葵種子吸水量的影響
從表1可以看出,無論種子是否經引發處理,隨吸水時間的延長種子的吸水量均逐漸增加。引發處理后的種子吸水量較對照極顯著提高,最終吸水量也極顯著增多,說明種子引發處理對種子吸水和萌發具有顯著的促進作用。隨引發時間的延長和引發濃度的增加,種子的吸水量呈顯著的先增加后減少的趨勢,且引發時間為8 h時吸水量達到最大值,引發36 h時初始吸水速度最快,引發 48 h 時初始吸水量和最終吸水量均有不同程度的減少;當引發濃度為200 mmol/L時初始吸水速度最快,150 mmol/L NaCl溶液引發處理時最終吸水量最大,但與50 mmol/L NaCl溶液引發處理差異不顯著。
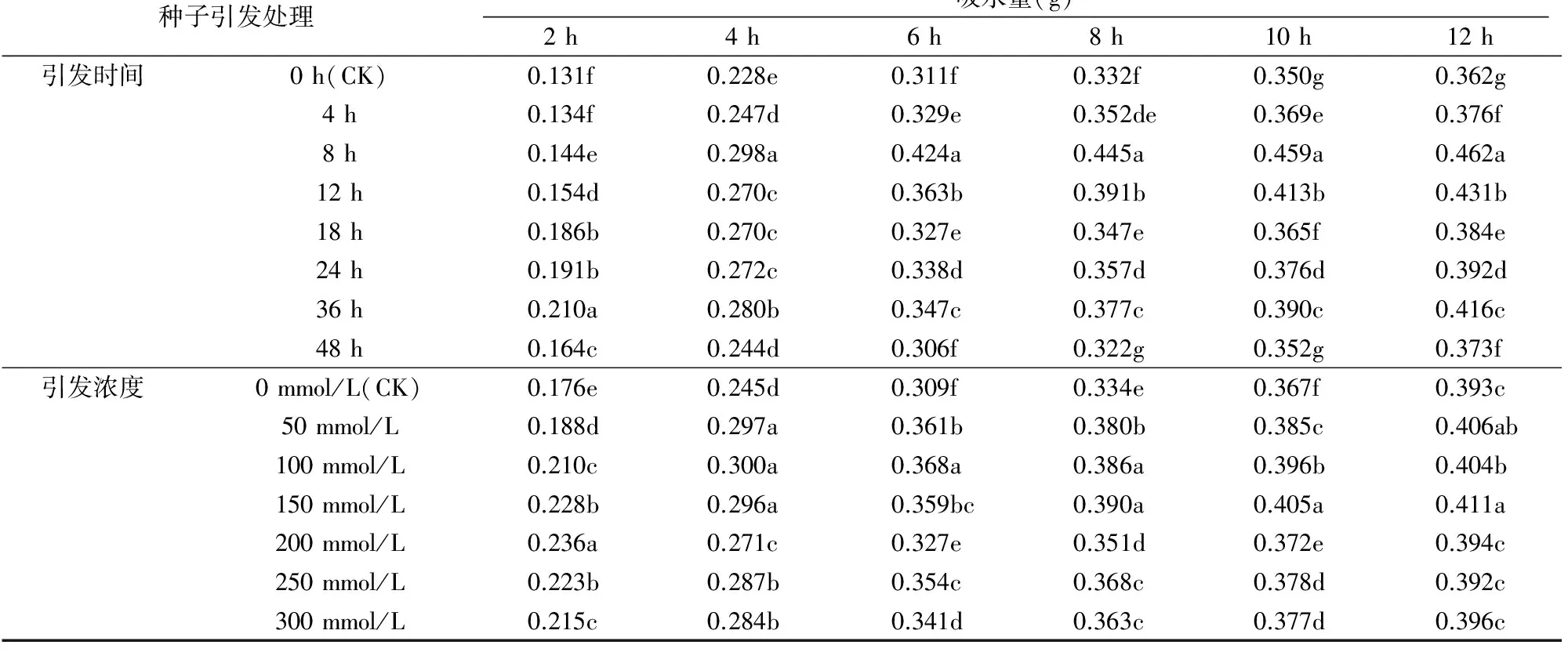
表1 不同引發處理對向日葵種子吸水量的影響
注:同列數據后不同小寫字母表示在0.05水平上差異顯著。
2.2 種子引發對鹽脅迫下向日葵種子發芽率的影響
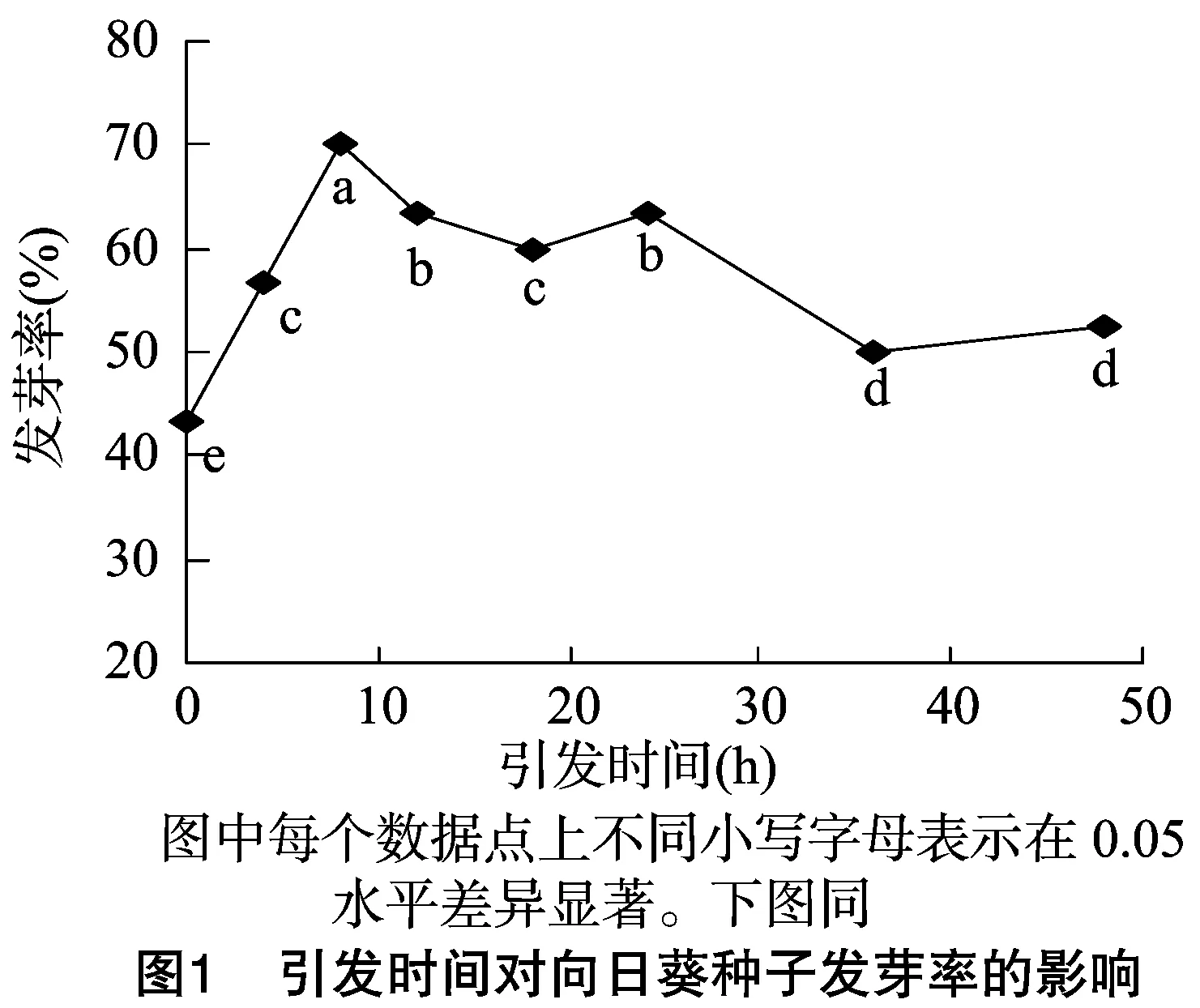
如圖1、圖2所示,隨著引發時間的延長和引發濃度的增加,向日葵種子的發芽率呈波動性變化,但總體呈現為先升高后降低的趨勢。當引發時間為8 h,或引發濃度為50 mmol/L時,向日葵種子發芽率較未引發的種子的發芽率均顯著提高,分別比對照提高26.67%、40.00%。
2.3 種子引發對鹽脅迫下向日葵種子發芽勢的影響
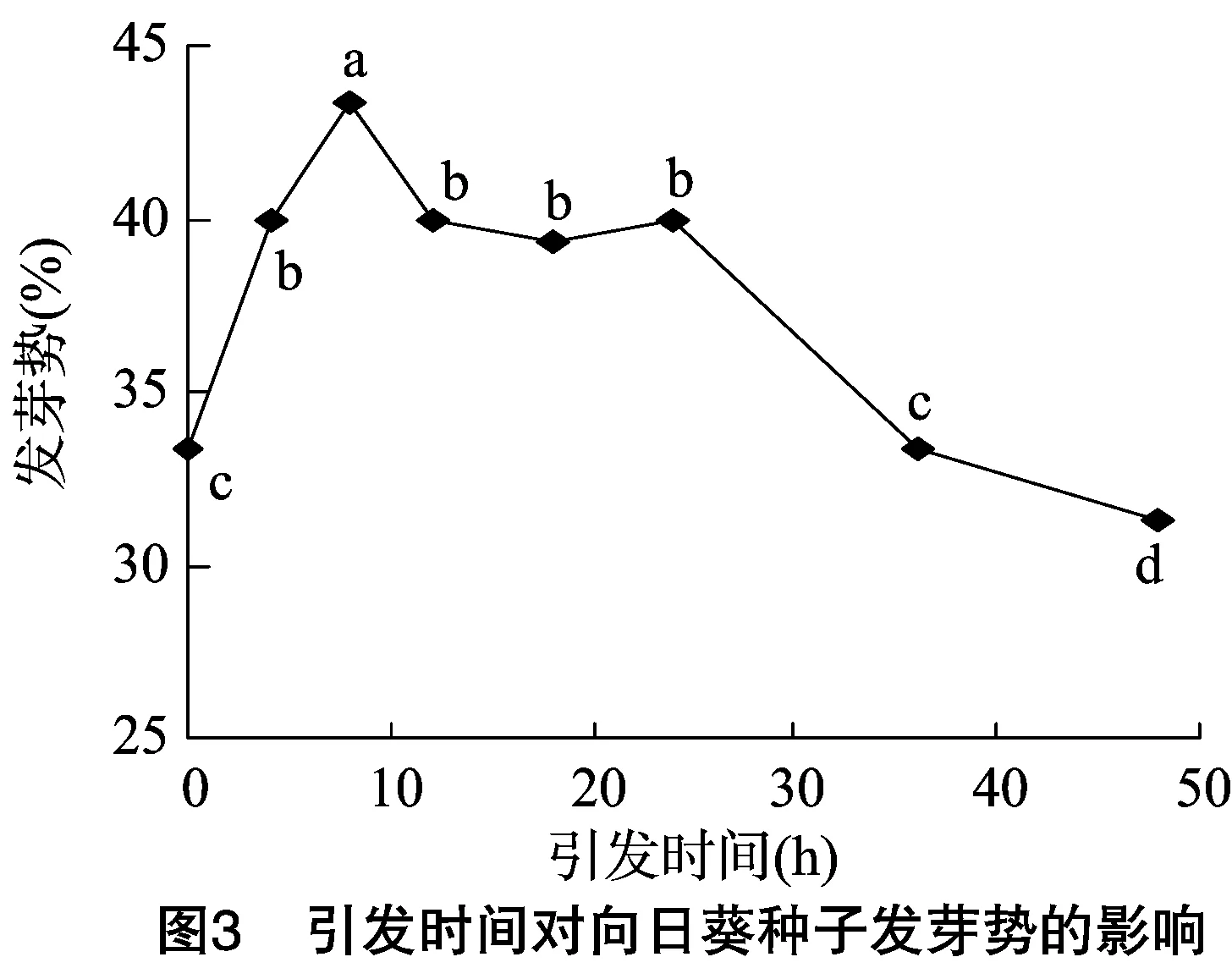
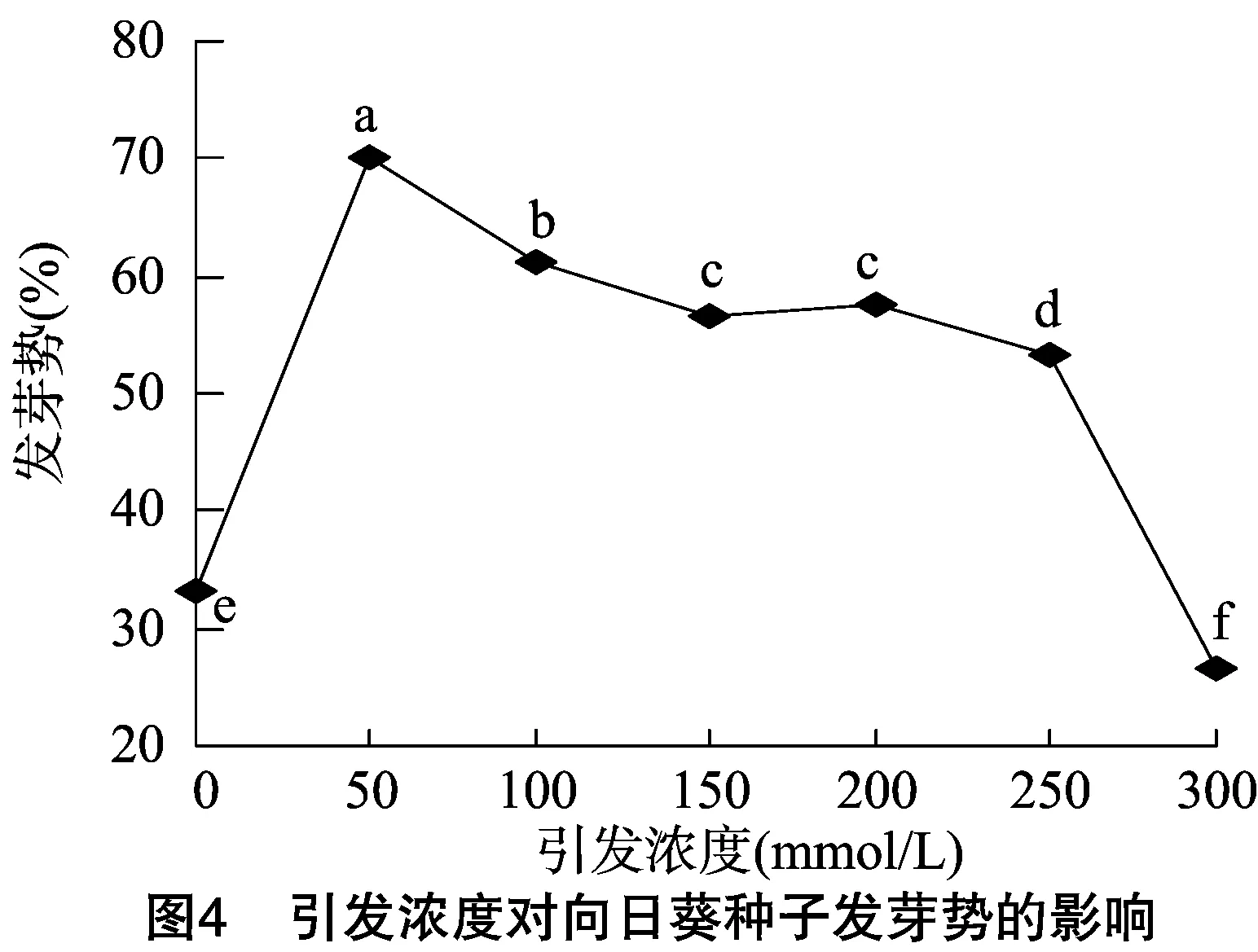
發芽勢反映了種子的發芽速度和整齊度,發芽勢較高時,幼苗出土較快,整齊度高,容易得到壯苗,因此發芽勢是衡量種子質量優劣的主要指標之一。如圖3、圖4所示,引發處理時間在4~8 h內,種子發芽勢顯著高于未引發處理的種子,但隨后發芽勢有所下降,當引發36 h時,種子的發芽勢與未引發處理的種子大致相當,繼續延長引發時間,則種子的發芽勢急劇下降,并顯著低于未引發處理的種子;引發濃度處理對種子發芽勢的影響與引發時間處理極為相似,用 50 mmol/L NaCl溶液對種子進行引發處理時,可使發芽勢顯著高于未引發處理的種子,并達到最大值,隨后隨引發濃度的增加,發芽勢緩慢下降,當NaCl溶液濃度大于250 mmol/L時發芽勢顯著下降,且低于未引發種子,說明對種子進行引發處理時需把握一定的引發時間和引發濃度。

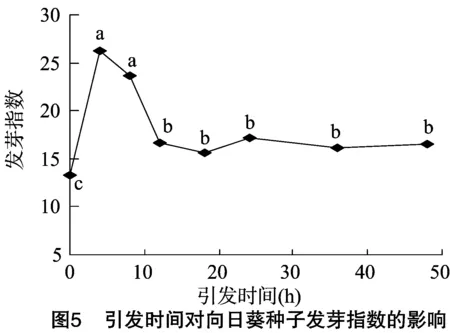
2.4 種子引發對鹽脅迫下向日葵種子發芽指數的影響
發芽指數是衡量種子發芽潛力的重要指標,同時在一定程度上也反映了種子在萌發過程中的抗逆性。由圖5、圖6可見,引發時間和引發濃度對種子發芽指數的影響與對發芽率和發芽勢的影響呈現基本相同的變化趨勢,即先增高后降低。用100 mmol/L NaCl溶液引發4~8 h可使種子發芽指數顯著提高,引發12~48 h種子的發芽指數顯著降低,并基本維持恒定,但顯著高于未引發處理的種子。當用50、100、150、200、250 mmol/L NaCl溶液對向日葵種子進行 12 h 引發處理后,其發芽指數顯著高于未引發處理的種子,且在引發濃度為50 mmol/L時達到最大值,但當引發濃度為 300 mmol/L 時種子的發芽指數與對照基本持平。

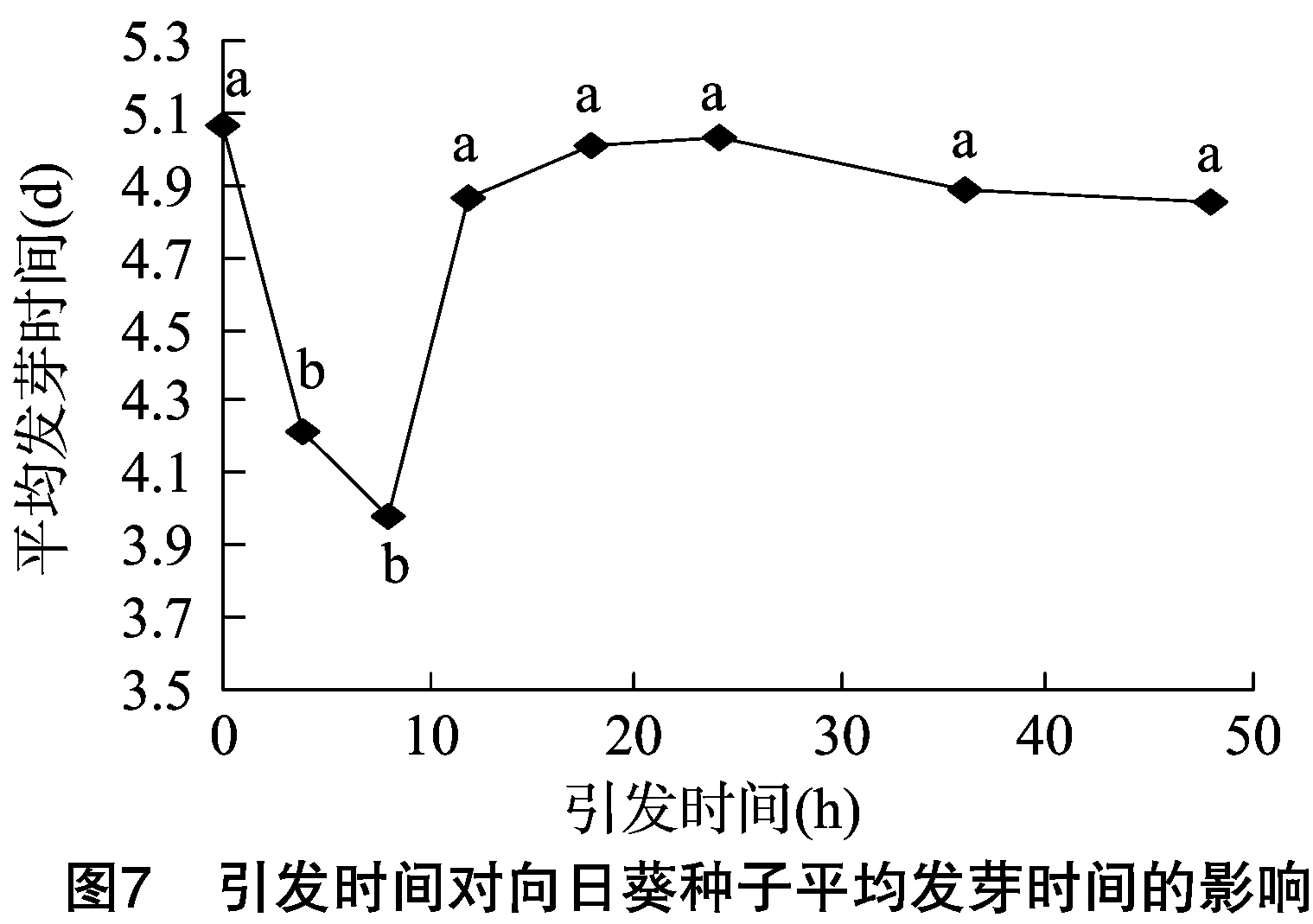
2.5 種子引發對鹽脅迫下向日葵種子平均發芽時間的影響
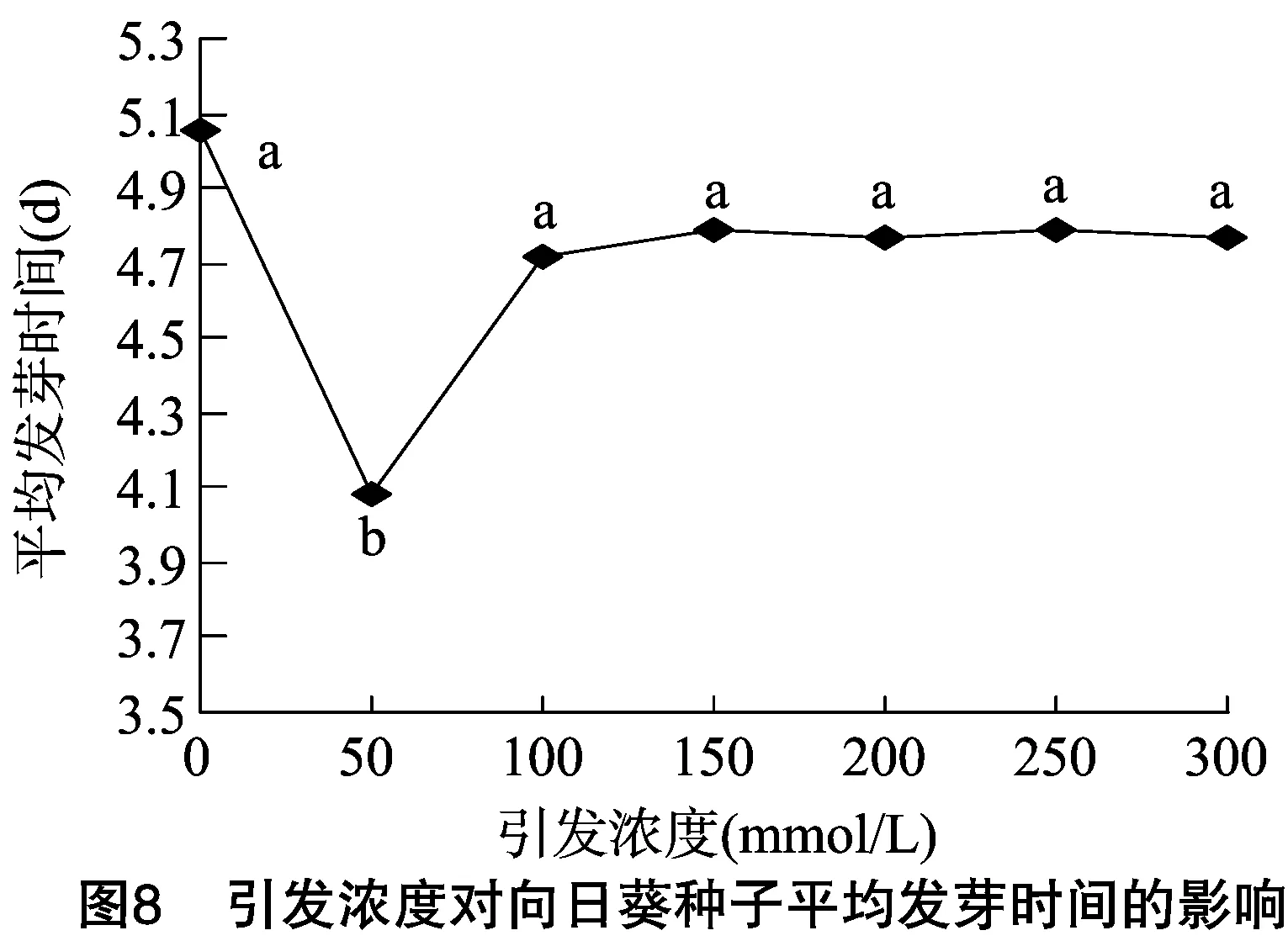
平均發芽時間反映了種子的萌發速率,平均發芽時間越短,種子萌發速率越快,因此高活力種子的平均發芽時間相對較短。由圖7、圖8可以看出,適宜的引發條件可以顯著縮短種子的平均發芽時間,促進種子萌發。當引發時間為8 h、引發濃度為50 mmol/L時,種子的平均發芽時間最短,分別比對照縮短了1.09、0.97 d。當引發時間為12~48 h,引發濃度為100~300 mmol/L時,種子的平均發芽時間基本維持不變,且與未引發的種子相差不大。
3 討論
種子引發處理后,向日葵種子的吸水量、發芽率、發芽勢和發芽指數等指標均較未引發種子顯著提高, 平均發芽時間則在一定條件下顯著縮短。種子萌發的先決條件就是吸水,干燥種子中的含水量極低,絕大部分都以束縛水的狀態存在,原生質呈凝膠狀態,代謝水平極低。種子吸水后,原生質從凝膠狀態轉變為溶膠狀態,代謝水平提高,呼吸速率加快,種子中的酶原被活化,酶的種類和數量增加,貯藏物質的分解代謝加快,為胚根的伸長和胚芽的生長提供物質和能量,從而完成種子的萌發[9]。高濃度鹽脅迫條件下,外界溶液的滲透勢降低,是導致種子吸水緩慢、吸水量不足、萌發延遲的主要原因[10]。通過種子引發處理可提高種子活力,尤其是在逆境如溫度脅迫、水分脅迫及鹽脅迫等條件下的種子活力[11]。本試驗結果表明,使用NaCl對向日葵種子進行引發處理可顯著提高其吸水量和吸水速度,降低高濃度的鹽脅迫(100 mmol/L NaCl)對向日葵種子吸水的限制作用。當用100 mmol/L NaCl溶液對向日葵種子引發8 h,或用50 mmol/L NaCl溶液對向日葵種子引發12 h時,均可顯著提高其發芽率、發芽勢和發芽指數,并可顯著縮短發芽時間,提高種子的發芽速度和發芽質量。但當種子引發時間過長(>36 h)或引發濃度過大(>250 mmol/L)時,反而會使向日葵種子的吸水量下降,發芽率、發芽勢和發芽指數顯著降低,尤其是發芽勢較未引發種子還要低,而平均發芽時間較短時間低濃度引發的種子要長。引發處理與未引發處理相比,高粱[12-13]、玉米[13]、大豆[14]、芹菜[15]等種子出苗時間縮短,發芽率、發芽勢等顯著提高,與本研究結果相符。分析其原因可能有以下幾個方面:(1)引發處理使鹽脅迫下向日葵的吸水量顯著高于未引發處理的種子,使種子內部許多與種子活力、種子發芽和種子抗劣變相關的酶(如酸性磷酸脂酶、酯酶、乙醇脫氫酶、淀粉酶、超氧化物歧化酶等)活性提高[16]。(2)使某些水解酶活化,促進了種子內部貯藏物質,如蛋白質、脂肪、淀粉等物質的水解和轉移利用[11,17-18]。(3)種子引發可能提高了鹽脅迫下向日葵種子內的脯氨酸、可溶性蛋白和可溶性糖含量,阮松林等[19]、Cayuela等[20]、Sivritepe等[21]、楊小環等[14]在分別以水稻、番茄、甜瓜、大豆等植物為試驗材料的研究中均已得到證實。脯氨酸和可溶性糖含量增加,可降低種子內部細胞的水勢,增強種子的抗逆性。(4)種子引發有效促進細胞膜的修復,降低膜的透性,減少萌發過程中物質的外滲[18]。
4 結論
采取種子引發技術,可顯著促進鹽脅迫條件下向日葵種子的萌發,縮短種子的發芽時間,提高種子發芽的整齊度,提高其耐鹽性。但種子引發的時間和引發劑的濃度對種子萌發過程中各項指標的影響程度不同,表現為短時間低濃度引發對鹽脅迫下向日葵種子萌發具有顯著促進作用,相反則促進作用不明顯。從本研究結果看,以100 mmol/L NaCl溶液處理8 h,或以50 mmol/L NaCl溶液處理12 h,對向日葵種子萌發的促進效果最好。
[1]唐旭日. 鹽堿地改良模式現狀及探索[J]. 江蘇農業科學,2011,39(6):595-597.
[2]祁棟靈,韓龍植,張三元. 水稻耐鹽/堿性鑒定評價方法[J]. 植物遺傳資源學報,2005,6(2):226-231.
[3]鄒 璐. 鹽堿地施用脫硫石膏對土壤理化性質和油葵生長的影響[D]. 北京:北京林業大學,2012.
[4]李慶文. 向日葵及其栽培[M]. 北京:中國農業出版社,1991:236-242.
[5]牛慶杰,李 偉,李慧英,等. 向日葵耐鹽堿材料篩選的新途徑[J]. 吉林農業科學,1998(3):27-28.
[6]劉 杰,張美麗,張 義,等. 人工模擬鹽、堿環境對向日葵種子萌發及幼苗生長的影響[J]. 作物學報,2008,34(10):1818-1825.
[7]于志賢,耿 稞,侯建華,等. 鹽脅迫對不同基因型向日葵種子萌發的影響[J]. 種子,2013,32(10):29-33.
[8]董志剛,孟煥文,程智慧. 黃瓜品種資源芽苗期和幼苗期耐鹽性及其評價指標研究[J]. 干旱地區農業研究,2008,26(4):156-162.
[9]李合生. 現代植物生理學[M]. 2版.北京:高等教育出版社,2006:252-253.
[10]謝德意,王惠萍,王付欣,等. 鹽脅迫對棉花種子萌發及幼苗生長的影響[J]. 種子,2000(3):10-11,13.
[11]Pill W G. Seed quality[M]. New York:Food Products Press,1995:319-359.
[12]楊小環,馬金虎,郭數進,等. 種子引發對鹽脅迫下高梁種子萌發及幼苗生長的影響[J]. 中國生態農業學報,2011,19(1):103-109.
[13]王 莉,管 博,周 沫,等. 種子引發對甜高梁和玉米種子耐鹽性的影響[J]. 種子,2015,34(6):72-77.
[14]楊小環,王玉國,楊文秀,等. 種子引發對水分脅迫下大豆幼苗生理特性的影響[J]. 中國生態農業學報,2009,17(6):1191-1195.
[15]陳子敬,于 茜,丁云玉,等. 種子引發對芹菜種子發芽、幼苗生長及產量的影響[J]. 種子,2016,35(4):26-29.
[16]Toorop P E,Aelst A,Hilhorst H. Endosperm cap weakening andendo-β-mannanase activity during priming of tomato (Lycopersiconesculentumcv. Money Maker)seeds are initiation upon crossing a threshoid water potential[J]. Seed Science Research,1998,8(4):483-489.
[17]阮松林,薛慶中. 植物的種子引發[J]. 植物生理學通訊,2002,38(2):198-202.
[18]趙 玥,辛 霞,王宗禮,等. 種子引發機理研究進展及牧草種子引發研究展望[J]. 中國草地學報,2012,34(3):102-108.
[19]阮松林,薛慶中,王清華. 種子引發對雜交水稻幼苗耐鹽性的生理效應[J]. 中國農業科學,2003,36(4):463-468.
[20]Cayuela E,Perez-Alfocea F,Caro M,et al. Priming of seeds with NaCl induces physiological changes in tomato plants grown under salt stress[J]. Physiologia Plantarum,1996,96(2):231-236.
[21]Sivritepe H O,Eris A,sivritepe N. The effect of NaCl priming on salt tolerance in melom seedlings[J]. Acta Horticulturae,1999,492:77-84.

