GA3對(duì)柱型和普通型蘋果組培苗生長(zhǎng)和生理的影響
劉國(guó)娟, 劉殿紅, 王 闖, 劉 敏, 徐 寧, 孫曉慧
(聊城職業(yè)技術(shù)學(xué)院,山東聊城 252000)
蘋果(MluspumilaMill)屬薔薇科、仁果亞科蘋果屬,原產(chǎn)歐洲、亞洲,已成為世界四大水果之一[1]。蘋果的生態(tài)適應(yīng)性強(qiáng),風(fēng)味獨(dú)特,耐貯藏,且供應(yīng)周期長(zhǎng)[2]。我國(guó)是世界第一大蘋果生產(chǎn)國(guó),主要集中在渤海灣、西北黃土高原、黃河故道和西南冷涼高地四大產(chǎn)區(qū)。蘋果產(chǎn)業(yè)的發(fā)展?fàn)顩r對(duì)果區(qū)經(jīng)濟(jì)振興、市場(chǎng)供應(yīng)和出口創(chuàng)匯影響巨大,在我國(guó)水果業(yè)中占最重要的地位[3]。柱型蘋果是一種新的蘋果品種類型,這類蘋果因其株形類似直立的支柱,而稱為柱型蘋果(columnar apple),又稱芭蕾蘋果(ballerina apple)[4-5],這類蘋果品種在田間表現(xiàn)出樹體極緊湊、萌芽率極高和節(jié)間短而粗的特點(diǎn),非常適于設(shè)施內(nèi)高密栽培[6]。
GA3作為植物內(nèi)源激素,可促進(jìn)植物細(xì)胞伸長(zhǎng)、莖伸長(zhǎng)、葉片擴(kuò)大,加速生長(zhǎng)和發(fā)育,使作物提早成熟,并增加產(chǎn)量或改進(jìn)品質(zhì)[7];能打破休眠,促進(jìn)發(fā)芽;減少器官脫落,提高果實(shí)的結(jié)實(shí)率或形成無籽果實(shí)等[8]。GA3最顯著的效應(yīng)是促進(jìn)莖的節(jié)間伸長(zhǎng),而且效果比生長(zhǎng)素更為顯著,但節(jié)間數(shù)不改變,節(jié)間長(zhǎng)度的增加是由于細(xì)胞伸長(zhǎng)和細(xì)胞分裂的結(jié)果。
對(duì)GA3的生理學(xué)研究發(fā)現(xiàn),它主要通過增強(qiáng)淀粉酶mRNA合成、膜透性和膜結(jié)合的多聚核糖體增生,促進(jìn)淀粉酶的合成;以及通過抑制IAA氧化酶或過氧化酶的活性,促進(jìn)生長(zhǎng)素的生物合成來調(diào)節(jié)生長(zhǎng)素的水平,從而對(duì)植物的生長(zhǎng)起促進(jìn)作用[9-10]。細(xì)胞壁的松弛是細(xì)胞伸長(zhǎng)所必需的,一般認(rèn)為細(xì)胞壁的松弛是酶促反應(yīng)過程。在植物細(xì)胞壁的松弛及其他一些需要細(xì)胞伸長(zhǎng)的發(fā)育過程中,ROS(reactive oxygen species)發(fā)揮著決定性的作用,超氧化物歧化酶(SOD)和過氧化物酶(POD)等是能夠分解ROS的重要抗氧化酶,是植物體內(nèi)氧化還原反應(yīng)動(dòng)態(tài)平衡的指示劑[11],許多初級(jí)和次級(jí)代謝發(fā)揮著重要的生理作用,例如清除H2O2參與木質(zhì)化發(fā)育過程等[12]。
本試驗(yàn)采用柱型蘋果富士×特拉蒙、普通型蘋果嘎拉施加不同濃度外源GA3處理的組培苗為試材,柱型蘋果富士×特拉蒙、普通型蘋果嘎啦為對(duì)照,研究了柱型蘋果、普通型蘋果組培苗施加外源GA3后,蘋果幼苗中SOD、POD和α-淀粉酶含量的變化,初步探討了柱型蘋果和普通型蘋果葉片中氧化酶與外源GA3的關(guān)系,旨在揭示葉片內(nèi)各種酶與GA3的關(guān)系,以及GA3濃度與蘋果組培苗生長(zhǎng)勢(shì)的關(guān)系。
1 材料與方法
1.1 材料
特拉蒙×富士柱型蘋果和普通型蘋果嘎拉。
1.2 方法
1.2.1 MS培養(yǎng)基的配制 配制1 L MS培養(yǎng)基:100 mL大量元素(10倍液)+10 mL微量元素(10倍液)+10 mL鐵鹽(100倍液)+10 mL有機(jī)物(100倍液)+10 mL CaCl2(100倍液)+1 mL NAA(1 mg/L)+1 mL 6-BA(0.1 mg/L)置容量瓶中,再加入7 g瓊脂,30 g蔗糖,溶解混勻,先加熱沸騰,再定容至1 L,用0.5 mol/L NaOH調(diào)pH值至5.8~6.2之間,121 ℃下大三角瓶?jī)?nèi)高壓蒸汽滅菌15 min。
1.2.2 培養(yǎng)基分裝 按試驗(yàn)要求每次吸取75、150、300、600、1 200 μL母液于1 L MS液態(tài)固體培養(yǎng)基中,即可配成含0.5、1.0、2.0、4.0、8.0 mg/L GA3的MS培養(yǎng)基。每1 L MS培養(yǎng)基可分裝20瓶。
1.2.3 培養(yǎng)觀察和取樣 接種完畢后將組培瓶置于26~28 ℃ 的恒溫培養(yǎng)箱中,光照條件下培養(yǎng),觀察記錄蘋果幼苗發(fā)芽情況、生長(zhǎng)狀況。
1.3 測(cè)定方法
SOD測(cè)定采用氮藍(lán)四唑法,依據(jù)SOD抑制NBT(氮藍(lán)四唑)在光下的還原程度來確定SOD活性的大小,活性單位以抑制NBT光化還原的50%為1個(gè)酶活性單位(U)[13]。POD測(cè)定采用愈創(chuàng)木酚法[13];參考李合生的α-淀粉酶活性測(cè)定方法[13]測(cè)定α-淀粉酶的活性。
2 結(jié)果與分析
2.1 外源GA3對(duì)柱型蘋果和普通型蘋果表型的影響
2.1.1 外源GA3對(duì)柱型蘋果富士×特拉蒙組培苗表型的影響 柱型蘋果富士×特拉蒙組培苗在不同濃度的GA3上培養(yǎng)16 d后,其組培苗新梢生長(zhǎng)狀態(tài)存在差異(圖1)。GA3在一定濃度內(nèi),均能促進(jìn)蘋果組培苗新梢的生長(zhǎng),當(dāng)GA3的濃度為 0~4 mg/L 時(shí),均能促進(jìn)富士×特拉蒙新梢的生長(zhǎng)。當(dāng)GA3濃度為8 mg/L時(shí),蘋果組培苗新梢的生長(zhǎng)受到明顯的抑制(圖1-F),植株株高明顯變矮,節(jié)間變短,但分枝數(shù)量明顯增多。

2.1.2 外源GA3對(duì)普通型蘋果嘎啦組培苗表型的影響 普通型蘋果嘎啦組培苗添加不同濃度的GA3培養(yǎng)16 d后,在一定濃度范圍內(nèi)顯著促進(jìn)蘋果組培苗生長(zhǎng),當(dāng)超出一定濃度范圍,則抑制其新梢的生長(zhǎng)(圖2)。當(dāng)GA3的濃度為0~2 mg/L 時(shí),處理均能促進(jìn)普通型蘋果新梢的生長(zhǎng)。隨著GA3濃度的增加,促進(jìn)分枝,但抑制節(jié)間伸長(zhǎng)(圖2-E)。當(dāng)GA3濃度為8 mg/L時(shí),蘋果組培苗新梢的生長(zhǎng)受到明顯的抑制(圖2-F)。同時(shí),植株株高明顯變矮,節(jié)間變短,但分枝數(shù)量明顯增多,表現(xiàn)為簇生狀態(tài)。
2.1.3 外源GA3對(duì)柱型和普通型蘋果新梢生長(zhǎng)影響的比較 不同濃度的GA3處理能明顯促進(jìn)柱型蘋果富士×特拉蒙和普通型蘋果嘎啦新梢的生長(zhǎng),其新梢增長(zhǎng)量均高于對(duì)照(圖3)。但處理16 d后,柱型蘋果對(duì)GA3產(chǎn)生的反應(yīng)較慢,其新梢生長(zhǎng)增加量不明顯(圖3-A);而普通型蘋果對(duì)GA3反應(yīng)非常敏感,產(chǎn)生的反應(yīng)非常快,新梢生長(zhǎng)增加量很明顯(圖3-B)。二者不同之處還在于,當(dāng)GA3濃度為4.0 mg/L時(shí),富士×特拉蒙的新梢增長(zhǎng)量最大,說明富士×特拉蒙新梢生長(zhǎng)的GA3最敏感濃度為4.0 mg/L;相對(duì)而言,普通型蘋果嘎啦新梢生長(zhǎng)的GA3最敏感濃度為2.0 mg/L。

2.2 GA3對(duì)蘋果組培苗SOD和POD酶活性的影響
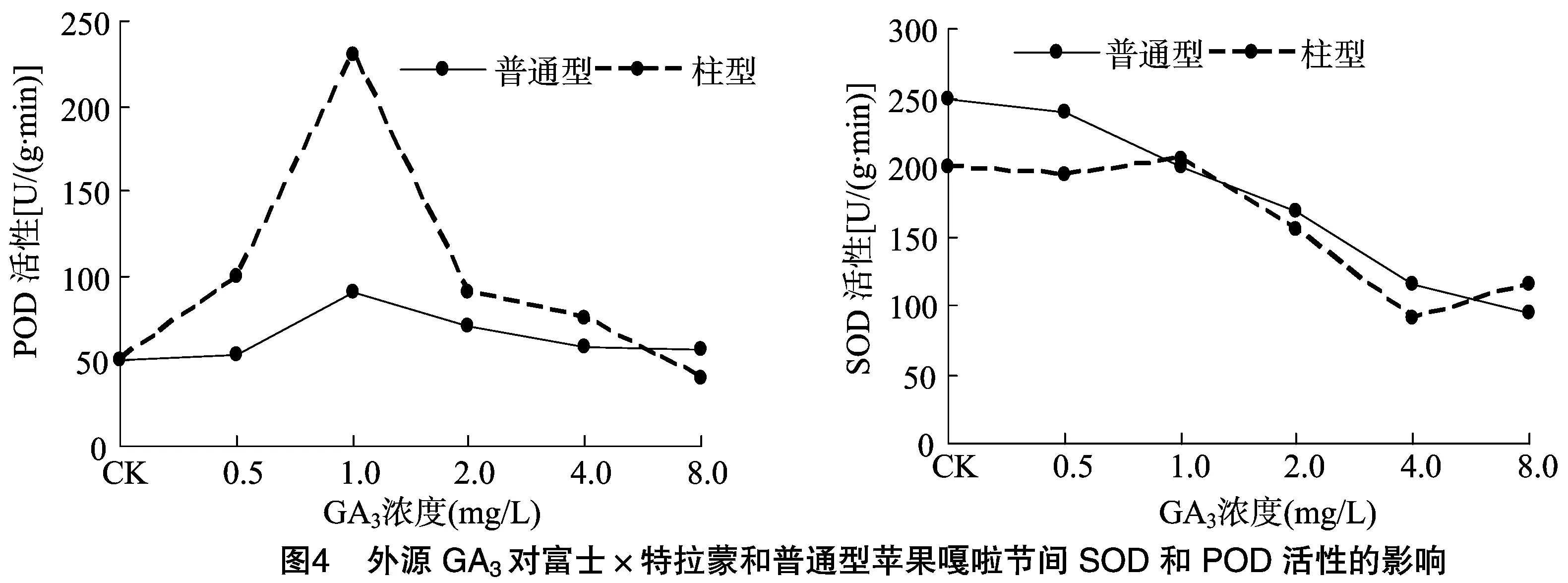
2.2.1 GA3對(duì)柱型蘋果和普通型蘋果組培苗SOD和POD酶活性的影響 GA3處理16 d后,POD活性的變化比較明顯(圖4)。富士×特拉蒙蘋果組培苗節(jié)間的POD含量明顯提高。在0~2.0 mg/L濃度范圍內(nèi),隨著GA3濃度的增加,POD活性隨著GA3濃度的提高而增加,當(dāng)GA3濃度為1.0 mg/L時(shí),POD活性達(dá)到最高,當(dāng)其超過2.0 mg/L時(shí),POD活性開始下降,但是仍舊高于對(duì)照的POD活性。而普通型蘋果嘎啦的POD活性變化并不明顯,GA3濃度在0~1.0 mg/L濃度范圍內(nèi),隨濃度的增加而提高,1.0 mg/L濃度時(shí),POD活性達(dá)到最大值,超過1.0 mg/L逐漸呈下降趨勢(shì),GA3濃度 8.0 mg/L 時(shí)POD活性降至最低。說明外源GA3可以促進(jìn)普通型蘋果組培苗節(jié)間的POD活性,但富士×特拉蒙的POD活性明顯高于普通型蘋果,說明POD活性與樹體矮化程度呈正相關(guān)。
此外,GA3處理16 d后,隨著GA3濃度的增加,富士×特拉蒙組培苗的SOD活性明顯下降。在0~2.0 mg/L濃度范圍內(nèi),隨著GA3濃度的增加,SOD活性變化不明顯,當(dāng)濃度為1.0 mg/L時(shí),SOD活性達(dá)到最大。GA3濃度超過1.0 mg/L時(shí),其SOD活性明顯下降,在4.0 mg/L時(shí),SOD活性降至最低,說明外源GA3抑制柱型蘋果組培苗節(jié)間SOD的活性,普通型蘋果與柱型蘋果節(jié)間SOD活性大體一致,都是呈下降趨勢(shì),但是普通型蘋果的SOD活性略高于柱型蘋果。
2.3 GA3對(duì)柱型蘋果和普通型蘋果組培苗α-淀粉酶活性的影響
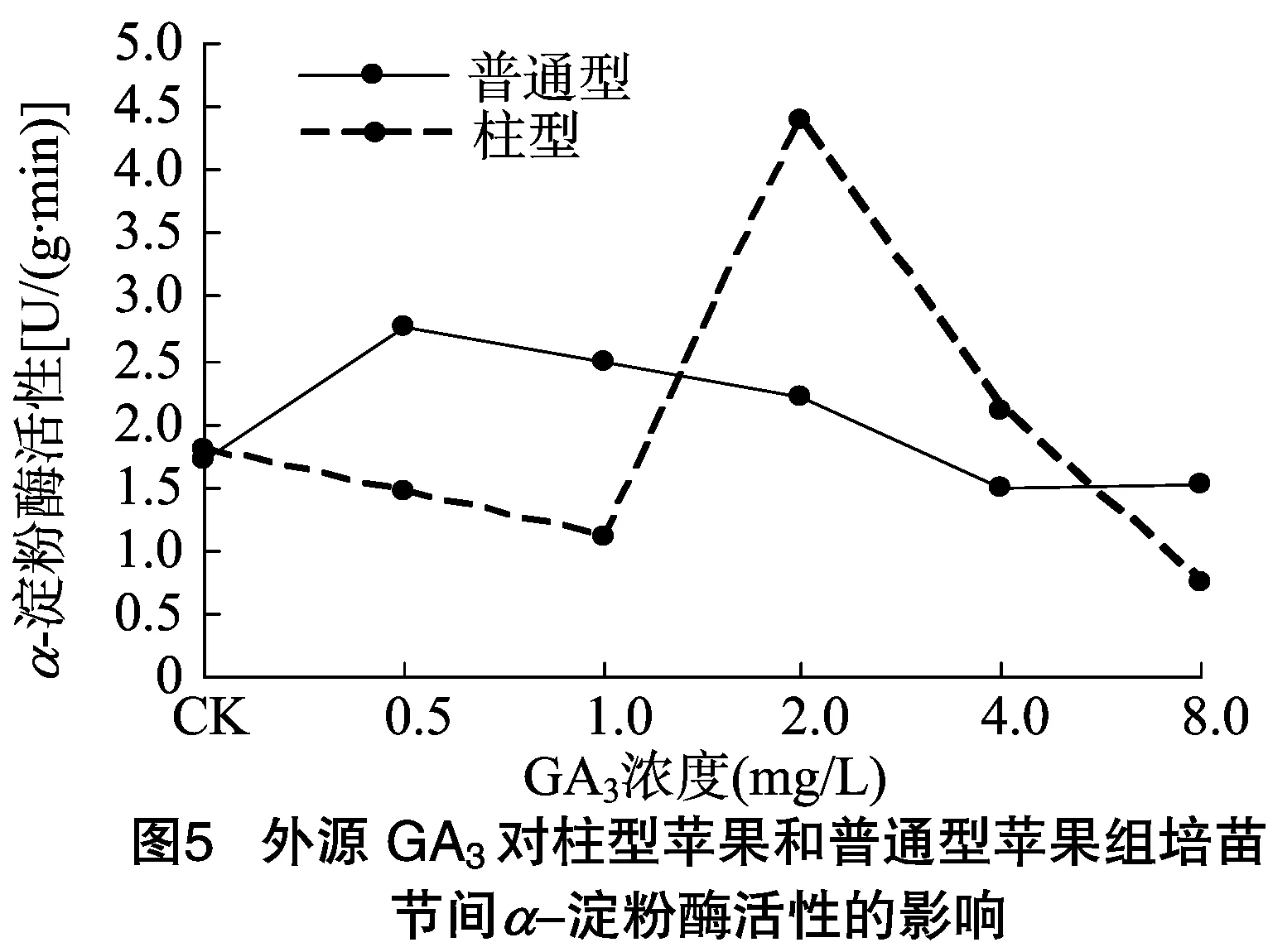
試驗(yàn)結(jié)果(圖5)表明,GA3處理16 d后,柱型蘋果和普通型蘋果α-淀粉酶活性有明顯的變化,不管是富士×特拉蒙還是嘎啦蘋果組培苗節(jié)間的α-淀粉酶都受GA3的誘導(dǎo)。在0~2.0 mg/L濃度范圍內(nèi),隨著GA3濃度的增加,富士×特拉蒙α-淀粉酶活力呈現(xiàn)下降趨勢(shì),隨后加強(qiáng),濃度增至2.0 mg/L時(shí),α-淀粉酶活性達(dá)到最大,隨著濃度的再次增加,α-淀粉酶活性迅速下降,與普通型蘋果相比,柱型蘋果變化很明顯,說明2.0 mg/L是GA3促進(jìn)柱型蘋果α-淀粉酶活性的最佳反應(yīng)濃度,普通型蘋果的變化則不那么明顯,在0.5 mg/L時(shí)α-淀粉酶活性達(dá)到最大,隨著濃度的不斷增加,α-淀粉酶活性不斷下降。但在0~2.0 mg/L濃度范圍內(nèi),普通型蘋果的α-淀粉酶活性要大于柱型蘋果,說明普通型蘋果初期受GA3影響較大。
3 討論
3.1 GA3與SOD和POD的關(guān)系
對(duì)柱型蘋果的研究集中在相關(guān)酶活性和內(nèi)源激素水平的測(cè)定上,本研究發(fā)現(xiàn)具有矮化生長(zhǎng)特性的柱型蘋果富士×特拉蒙POD、SOD酶活性與生長(zhǎng)勢(shì)密切相關(guān),柱型蘋果葉片內(nèi)的POD、SOD酶活性顯著高于普通型蘋果。外源GA3處理后,不管是柱型蘋果富士×特拉蒙還是普通型蘋果嘎啦,其SOD活性呈現(xiàn)下降趨勢(shì),而POD活性則呈上升趨勢(shì), 這也證明了,POD活性與樹體矮化程度呈顯著正相關(guān), 酶活性越高,矮化程度越大[14]。
3.2 GA3與α-淀粉酶的關(guān)系
GA3是誘導(dǎo)多種植物一些組織中α-淀粉酶的必要條件,α-淀粉酶為淀粉水解過程重要的水解酶,現(xiàn)已用α-淀粉酶來檢測(cè)植物組織中GA的響應(yīng)狀態(tài)[15]。本研究發(fā)現(xiàn)外源GA3能促進(jìn)柱型蘋果富士×特拉蒙和普通型蘋果嘎啦α-淀粉酶的活性,但在測(cè)定過程中,柱型蘋果和普通型蘋果組培苗內(nèi)α-淀粉酶不太穩(wěn)定,很可能因?yàn)槊傅男再|(zhì)不穩(wěn)定導(dǎo)致的。
參考文獻(xiàn):
[1]中華人民共和國(guó)國(guó)家統(tǒng)計(jì)局.中國(guó)統(tǒng)計(jì)年鑒[M]. 北京:中國(guó)統(tǒng)計(jì)出版社,2013:451-455.
[2]孟艷玲,汪景彥,康國(guó)棟,等. 我國(guó)蘋果生產(chǎn)現(xiàn)狀分析[J]. 中國(guó)果樹,2007(1):43-44.
[3]王金政,薛曉敏,路 超. 我國(guó)蘋果生產(chǎn)現(xiàn)狀與發(fā)展對(duì)策[J]. 山東農(nóng)業(yè)科學(xué),2010(6):117-119.
[4]劉國(guó)娟,劉殿紅,王 闖,等. 柱型和普通型蘋果枝條木質(zhì)部導(dǎo)管分子觀察[J]. 江蘇農(nóng)業(yè)科學(xué),2016,45(5):214-216.
[5]王彩虹,田義軻,戴洪義. 柱型蘋果的研究和利用現(xiàn)狀[J]. 河北林果研究,2000,15(2):197-200.
[6]高國(guó)訓(xùn),李光晨,袁麗慧. 柱型蘋果莖尖培養(yǎng)中嫩莖增殖與植物激素的關(guān)系[J]. 天津農(nóng)業(yè)科學(xué),1999,5(2):20-24.
[7]劉林德,姚敦義. 植物激素的概念及其新成員[J]. 生物學(xué)通報(bào),2002,37(8):18-20.
[8]鮮開梅,張永華. GA的應(yīng)用研究進(jìn)展[J]. 北方園藝,2007(6):74-75.
[9]張石城,劉祖祺. 植物化學(xué)調(diào)控與原理[M]. 北京:中國(guó)農(nóng)業(yè)出版社,1996.
[10]張興春,高 峰. 赤霉素對(duì)紫心甘薯花青素積累及相關(guān)酶基因表達(dá)的影響[D]. 廣州:華南師范大學(xué),2009.
[11]梁美霞,鄧子牛,戴洪義. 柱型蘋果生長(zhǎng)特性的細(xì)胞學(xué)與分子生物學(xué)研究[D]. 長(zhǎng)沙:湖南農(nóng)業(yè)大學(xué),2010:36-38
[12]張志華,劉新彩,王紅霞,等. 核桃IOD和POD酶活性與生長(zhǎng)勢(shì)的關(guān)系[J]. 園藝學(xué)報(bào),2006,33(2):229-232.
[13]李合生. 植物生理生化實(shí)驗(yàn)原理和技術(shù)[M]. 北京:高等教育出版社,2000.
[14]張維強(qiáng),唐秀芝. 矮生型蘋果苗的預(yù)選指標(biāo)[J]. 植物學(xué)報(bào),1997,29(4):377-400.
[15]王 忠. 植物生理學(xué)[M]. 北京:中國(guó)農(nóng)業(yè)出版社,1999:227-278.
- 江蘇農(nóng)業(yè)科學(xué)的其它文章
- 農(nóng)村土地承包經(jīng)營(yíng)權(quán)抵押貸款的供給與需求分析
——以天津市為例 - 農(nóng)村土地經(jīng)營(yíng)權(quán)抵押貸款供給困境的多方演化博弈分析
- 農(nóng)戶的耕地流轉(zhuǎn)意愿價(jià)格及其影響因素分析
- 金融知識(shí)對(duì)農(nóng)戶金融行為的影響研究
——基于江蘇省522個(gè)農(nóng)戶調(diào)查數(shù)據(jù) - 農(nóng)業(yè)產(chǎn)業(yè)化龍頭企業(yè)社會(huì)責(zé)任履行研究
- 基于灰色關(guān)聯(lián)的安徽省耕地資源利用效率影響因素分析

