Nrf2在肺纖維化治療中作用的研究進展
陳 雁 王玉敏
(赤峰學院附屬醫院呼吸內科,內蒙 赤峰 024005)
肺纖維化(PF)是一種慢性、進展性、不可逆轉的肺部疾病,臨床表現為逐漸加重的呼吸困難,患者最終因肺功能嚴重受損發生呼吸衰竭而死亡。目前還沒有方法可以完全阻斷PF的發生。PF的發病機制仍未完全闡明,最近研究〔1〕顯示氧化應激反應參與PF發病機制,因此,抑制氧化應激導致的肺損傷已成為防治PF的新策略。本文總結了肺部發生纖維化過程中氧化應激損傷的來源及其在PF形成中的作用,并對以轉錄因子(Nrf2)抗氧化通路為靶點治療PF的進展進行了總結。
1 PF過程中氧化應激來源
氧化應激(oxidative stress)是指活性氧產生增多和/或抗氧化防御耗竭產生的一系列分子、細胞和組織的功能損害〔1〕。與機體其他器官相比,肺暴露于高水平的氧,使其更容易受到氧化應激的攻擊從而產生損害,吸入的空氣中氧的壓力達到150 mmHg,而肺泡氣氧的壓力可達到100 mmHg。PF過程中氧化應激來源主要包括線粒體、還原型輔酶Ⅱ(NADPH)氧化酶和抗氧化防御體系酶的耗竭。
1.1線粒體介導產生活性氧(ROS) 線粒體產生ROS是介導PF產生的主要參與因素。線粒體功能障礙主要產生包括過氧化氫(H2O2)和超氧負離子(O2·-)在內的活性氧簇〔2〕。線粒體電子傳遞鏈(ETC) 是細胞內ROS產生的主要途徑。ETC是O2·-的主要產生來源。大約2%的線粒體氧耗轉變成O2·-。ETC是生物體三磷酸腺苷(ATP)能量的來源,在能量傳遞的過程中,一小部分電子發生泄漏,泄漏的電子被O2接收即生成O2·-。其中復合體Ⅰ和復合體Ⅳ產生ROS的能力較強。研究顯示,肺泡巨噬細胞(AM)線粒體介導產生的H2O2在引起石棉沉滯癥中的作用〔3〕,AM暴露于石棉樣纖維(asbestos fibers)后可誘導H2O2的產生,而這一作用可被氧化氫酶(CAT)阻斷,AM線粒體應激水平減弱。另外,Rho結合蛋白家族成員Rac1增加AM線粒體H2O2的產生,而敲低ETC復合體Ⅲ的ROS產生位點鐵硫蛋白能夠減弱石棉誘導的AM H2O2的產生。石棉沉滯癥患者AM線粒體Rac1的表達水平升高,而條件性刪除Rac1基因的小鼠肺內氧化應激水平較低和PF發生程度減輕。總之,石棉能夠通過將電子由復合體Ⅲ轉移給Rac1從而促進AM H2O2的產生,觸發一系列下游事件,導致石棉沉滯癥的發生。因此,推斷Rac1可以作為PF的一個新的分子標志物。H2O2參與PF發生的另一項證據來源于CAT能夠減弱石棉沉滯癥嚙齒類動物模型PF的發生〔4〕。另外,一些外源性毒素,如石棉樣纖維能夠激活參與PF發生的非內皮細胞線粒體ROS的產生〔5〕。
1.2NADPH氧化酶 NADPH氧化酶在肺內ROS的產生中發揮重要作用。NADPH氧化酶是一個與細胞膜結合的、含有多亞基的酶復合體,其主要功能是實現電子從NADPH跨細胞膜傳遞給分子氧,產生O2·-及其下游的ROS。NADPH氧化酶家族由NOX2,NOX1,NOX3,NOX4,NOX5,DUOX1和DUOX2 NADPH氧化酶7個成員組成,每個成員通過與細胞膜結合的催化亞基“Nox”或“Duox” 的不同進行區別。NADPH氧化酶催化亞基gp91phox/NOX2及其6個同源物統稱為NOX家族蛋白。這些NOX家族蛋白在不同組織中具有獨特的表達分布。當細胞受到刺激后4個細胞質成分募集到細胞膜上,與兩個膜結合的成分組成有活性的NADPH氧化酶復合體,促進ROS的產生〔6〕。NADPH 氧化酶的主要功能是產生O2·和H2O2產生,從而參與細胞信號轉導、殺死外來微生物的侵入等〔7〕。
最近研究顯示NADPH氧化酶介導產生的ROS在PF過程中發揮重要作用,尤其是NOX1,NOX2,NOX4-NADPH氧化酶參與PF發病機制〔7〕。轉化生長因子-(TGF)-β誘導激活NOX4-NADPH 氧化酶,從而通過促進肌成纖維細胞分化和上皮再形成。TGF-β和氧化應激共同促進PF形成〔8〕。TGF-β是最強效促纖維化細胞因子,通過調控細胞的增殖、分化、黏附、遷移、凋亡及上皮細胞間質轉型(EMT),進而在細胞外基質(ECM)沉積的過程中發揮重要作用。研究顯示,NOX4-NADPH氧化酶介導產生的H2O2對于TGF-β誘導的成纖維細胞分化和ECM產生是必須的,NOX4基因敲除或藥理學途徑抑制NOX4可以阻止博來霉素誘導的小鼠PF的發生〔9〕。同時博來霉素能夠誘導小鼠肺內NOX4的表達升高,PF患者肺內NOX4的表達也是升高的〔9〕。TGF-β1誘導的成纖維細胞分化與細胞外H2O2的產生相關,后者促進肺泡上皮細胞(AEC)死亡。AEC死亡是PF的重要始動事件和PF持續存在的主要事件〔10〕。NOX4在PF患者增生的肺泡上皮中強效表達,尤其在2型肺泡細胞(AT2)中表達明顯〔10〕。NOX4基因缺失,可阻止博來霉素誘導的小鼠AT2細胞凋亡的發生〔11〕。NOX-4化學性抑制劑處理來源于NOX4基因缺失的內皮細胞或AEC,能夠降低TGF-β1介導的ROS產生和AEC凋亡。綜上所述,NOX4-NADPH氧化酶介導產生的ROS參與AEC凋亡機制,進而促進PF發生。
NOX2-NADPH氧化酶同時也參與PF的發生。最近研究發現,NOX2基因缺失的小鼠,能夠阻止博來霉素誘導的小鼠PF的發生〔7〕。
1.3抗氧化防御體系酶的耗竭 肺本身表達一些抗氧化酶,從而保護肺臟因氧化應激引起損傷。抗氧化防御體系的酶的缺失能夠促進氧化應激的發生,進而促進PF的發生。
1.3.1CAT CAT可促使H2O2分解為分子氧和水(2 H2O2→2 H2O+O2),清除體內的過氧化氫,從而使細胞免于遭受H2O2的毒害,是生物防御體系的關鍵酶之一。CAT 是AEC和炎癥細胞內H2O2的清除劑,能夠抑制H2O2介導的PF患者肺內成纖維細胞的活化〔12〕。持續靜脈滴注聚乙二醇-過氧化氫酶能夠阻止大鼠石棉沉滯癥誘導的PF發生。
1.3.2谷胱甘肽(GSH) GSH是正常肺內的小分子抗氧化劑,PF患者肺內GSH含量減低。谷胱甘肽前體N-乙酰半胱氨酸(NAC)可以增加PF動物模型肺內的GSH水平,減弱博來霉素誘導的PF的發生。霧化吸入NAC,能夠增強PF患者抗氧化/氧化平衡體系。一項3期臨床實驗表明,NAC顯示出對PF的潛在治療價值〔11〕。
2 Nrf2與PF的治療
2.1Nrf2與PF 機體細胞本身具有一套復雜的抗氧化系統,此系統組成Nrf2-抗氧化反應元件(ARE)-抗氧化酶通路。生理狀態下,在胞質內的Nrf2與細胞骨架相關性抑制蛋白(Keap1)結合形成一個復合體,使Nrf2經泛素蛋白酶途徑降解。當細胞或機體暴露于ROS時,引起Keap1的修飾,從而使Keap1募集Nrf2的功能發生改變,Keap1-Nrf2復合體解離,Nrf2從胞質轉位到細胞核,與受其調控的抗氧化酶基因的ARE結合,從而啟動編碼解毒和抗氧化的基因表達,使其表達上調,促進細胞存活等功能。見圖1。
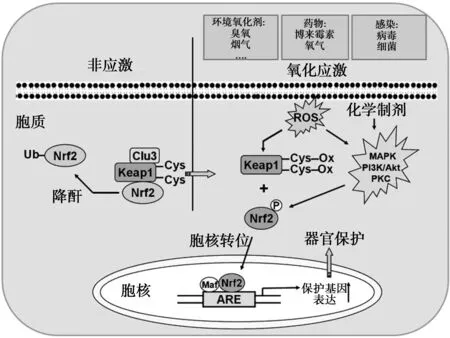
圖1 Nrf2抗氧化系統
Nrf2在調節PF過程中的作用引起研究者的關注。Cho等〔11〕是最早研究Nrf2在PF中的作用,研究顯示,Nrf2基因敲除(Nrf2-/-)的小鼠中,博來霉素誘導小鼠肺損傷和內皮細胞死亡較野生型小鼠(Nrf2+/+)加重。而反應PF化的指數,即羥脯氨酸含量、膠原沉積、纖維化評分,細胞增殖程度,Nrf2基因敲除(Nrf2-/-)的小鼠較野生型小鼠(Nrf2+/+)水平高。博來霉素誘導野生型小鼠(Nrf2+/+)Nrf2的表達和活性升高。博來霉素可以在野生型小鼠(Nrf2+/+)上調一些受Nrf2調控的細胞保護蛋白的表達。同時,與Nrf2基因敲除(Nrf2-/-)的小鼠比較,在野生型小鼠(Nrf2+/+)博來霉素誘導的反應肺損傷和PF的標志物的蛋白水平較低。綜上研究表明,Nrf2在PF的發生發展過程中起到抑制PF發生的保護作用,這一保護作用通過上調特定細胞保護蛋白實現。因此,Nrf2成為治療PF的新的潛在靶點。最近的一些研究,進一步證實了這一推斷,在Nrf2基因敲除(Nrf2-/-)的小鼠中對博來霉素和百草枯(paraquat,PQ)誘導的PF發生更加敏感〔13〕。博來霉素可以通過調控ERK1/2進而抑制Nrf2活性,從而促進氧化應激的產生和PF的發生〔14〕。
2.2激活Nrf2在PF中的保護作用 激活Nrf2抗氧化通路在PF中具有保護作用,使其成為治療PF的新靶點。以Nrf2抗氧化通路為靶點治療PF方面,研究者做了有益的探索,取得了一些進展。
2.2.1抑制博來霉素誘導的PF發生 Sriram等〔15〕較早提供了調控Nrf2在PF中具有保護作用的研究證據,研究顯示,表沒食子兒茶素(EGCG) 可以抑制博來霉素誘導的PF發生,博來霉素可誘導大鼠肺內ROS產生、脂質過氧化作用、羥脯氨酸和髓過氧化物酶的活性增加,EGCG可以減弱這一作用,并恢復博來霉素引起的抗氧化狀態。免疫組化分析發現,博來霉素可導致大鼠肺炎癥反應增加和肺泡損傷,而EGCG可以降低博來霉素引起的膠原沉積。進一步分析發現,EGCG能夠上調博來霉素引起的細胞保護酶基因的表達降低,即上調谷胱甘肽-S-轉移酶(GST)和依賴還原型輔酶Ⅰ/Ⅱ醌氧化還原酶 1(NQO1)的表達。同時研究顯示EGCG是Nrf2的激活劑。綜上所述,EGCG通過激活Nrf2,進而促進GST和NQO1的表達來抑制博來霉素引起的PF發生。植物源性多酚類黃酮類抗氧化劑槲皮素能夠通過激活Nrf2,進而上調血紅素加氧酶(HO)-1的表達來抑制TGF-β誘導的膠原蛋白的產生,進而抑制PF的發生〔16〕。在雄性Wistar大鼠,黃連素能夠抑制博來霉素引起的肥大細胞沉積和組胺的釋放,并通過激活Nrf2來增加肺內抗氧化狀態,抑制核轉錄因子(NF)-κB依賴的TGF-β通路激活,進而抑制PF的發生〔17〕。另外最近的研究顯示,葫蘆巴種子提取物苷〔18〕、丹酚酸〔19〕、南蛇藤醇〔20〕、利拉利汀〔21〕、 中華獼猴桃果仁非飽和脂肪酸〔22〕、苦參堿〔23〕、蘿卜硫素〔24〕、廣譜抗纖維化作用藥物吡非尼酮(PFD)〔25〕均能夠不同程度激活Nrf2通路,上調細胞保護蛋白的表達,抑制氧化應激的發生,進而抑制博來霉素引起的PF發生。
2.2.2抑制百草枯誘導的PF發生 諾奧奶薊草提取物復合膠囊能夠在SD大鼠和A549細胞中通過激活Nrf2,進而促進HO-1和NQO1的表達,減弱炎癥和氧化應激發生,從而抑制PQ引起的PF發生〔26〕。研究顯示葛根素可以抑制PQ誘導的小鼠PF的發生,進一步研究表明,葛根素能夠通過激活Nrf2,進而阻斷Fstl 1通路、TGF-β1通路和氧化應激發生進而抑制PF的發生〔27〕。最近研究表明,丹酚酸B能夠同過激活Nrf2,降低NOX4-NADPH 氧化酶水平,從而減弱PQ引起的小鼠肺內氧化應激的發生,并抑制TGF-β1的表達及其下游蛋白Smad3的磷酸化,最終抑制PQ引起的小鼠PF發生〔28〕。雷怕霉素同樣也能夠通過激活Nrf2通路抑制PQ引起的PF發生〔29〕。治療瘧疾急性發作的氯喹同樣也可經過Nrf2通路的激活,上調HO-1和NQO1的表達,抑制氧化應激的發生,從而能抑制PQ引起的PF發生〔30〕。綜上所述,激活Nrf2通路了,能夠抑制百草枯誘導的PF發生。
2.2.3抑制硅誘導的PF發生 硅肺病是世界范圍內最常見的職業性肺疾病。二氧化硅(SiO2)能夠通過誘導大鼠肺內ROS和丙二醛(MDA)產生增加,激活Nrf2及其下游硫氧還蛋白(Trx)。硅抑制Trx活性并下調硫氧還蛋白還原酶(TrxR)的表達,表明硅抑制Trx系統。所以硅通過抑制Trx系統,誘導氧化應激發生,進而誘導大鼠肺PF的發生〔31〕。
最近研究顯示,蚯蚓提取物能夠通過激活Nrf2依賴的機制抑制二氧化硅誘導的小鼠肺PF的發生〔32〕。蚯蚓提取物可以抑制二氧化硅引起的氧化應激、線粒體依賴的凋亡發生和上皮細胞-間充質細胞轉換(EMT)。因此,蚯蚓提取物是潛在的通過激活Nrf2而在PF治療具有前景的藥物。
2.2.4抑制煙氣誘導的PF發生 最近研究顯示,硫化氫(H2S)能夠通過激活Nrf2,進而上調HO-1和硫氧還蛋白(Trx)-1的表達來抑制慢性煙氣暴露氧化應激的發生和炎癥的產生,進而抑制大鼠肺PF的發生〔33〕。H2S能夠減少慢性煙氣暴露大鼠肺內氧化應激水平,減少超敏C反應蛋白、TNF-α、IL-1β和IL-6。
3 問題與展望
目前研究表明,Nrf2在抑制肺纖維化過程中具有保護作用,但Nrf2依賴的下游效應因子與PF之間的相互作用仍闡釋不清。Nrf2及受其調控蛋白在PF中作用的進一步闡明,對以Nrf2為靶點篩選治療PF的藥物至關重要,對于PF的預防和治療具有深遠意義。
1Faner R,Rojas M,Macnee W,etal.Abnormal lung aging in chronic obstructive pulmonary disease and idiopathic pulmonary fibrosis〔J〕.Am J Respir Crit Care Med,2012;186(4):306-13.
2Galluzzi L,Kepp O,Trojel-Hansen C,etal.Non-apoptotic functions of apoptosis-regulatory proteins〔J〕.EMBO Rep,2012;13(4):322-30.
3Osborn-Heaford HL,Ryan AJ,Murthy S,etal.Mitochondrial Rac1 GTPase import and electron transfer from cytochrome c are required for pulmonary fibrosis〔J〕.J Biol Chem,2012;287(5):3301-12.
4Mossman BT,Marsh JP,Sesko A,etal.Inhibition of lung injury,inflammation,and interstitial pulmonary fibrosis by polyethylene glycol-conjugated catalase in a rapid inhalation model of asbestosis〔J〕.Am Rev Respir Dis,1990;141(5 Pt 1):1266-71.
5Liu G,Cheresh P,Kamp DW.Molecular basis of asbestos-induced lung disease〔J〕.Annu Rev Pathol,2013;8:161-87.
6王玉敏,王月華,杜冠華,等.靶向調控HO-1/NOX2治療帕金森病的新進展〔J〕.中國藥學雜志,2015;50(23):2024-7.
7Hecker L,Cheng J,Thannickal VJ.Targeting NOX enzymes in pulmonary fibrosis〔J〕.Cell Mol Life Sci,2012;69(14):2365-71.
8Liu RM,Gaston-Pravia PKA.Oxidative stress and glutathione in TGF-beta-mediated fibrogenesis〔J〕.Free Radic Biol Med,2010;48(1):1-15.
9Hecker L,Vittal R,Jones T,etal.NADPH oxidase-4 mediates myofibroblast activation and fibrogenic responses to lung injury〔J〕.Nat Med,2009;15(9):1077-81.
10Carnesecchi S,Deffert C,Donati Y,etal.A key role for NOX4 in epithelial cell death during development of lung fibrosis〔J〕.Antioxid Redox Signal,2011;15(3):607-19.
11Cho HY,Reddy SP,Yamamoto M,etal.The transcription factor NRF2 protects against pulmonary fibrosis〔J〕.FASEB J,2004;18(11):1258-60.
12Kliment CR,Oury TD.Oxidative stress,extracellular matrix targets,and idiopathic pulmonary fibrosis〔J〕.Free Radic Biol Med,2010;49(5):707-17.
13Kikuchi N,Ishii Y,Morishima Y,etal.Nrf2 protects against pulmonary fibrosis by regulating the lung oxidant level and Th1/Th2 balance〔J〕.Respir Res,2010;11:31.
14Liu R,Chen H,Bai H,etal.Suppression of nuclear factor erythroid 2-related factor 2 via extracellular signal-regulated kinase contributes to bleomycin-induced oxidative stress and fibrogenesis〔J〕.Toxicol Lett,2013;220(1):15-25.
15Sriram N,Kalayarasan S,Sudhandiran G.Epigallocatechin-3-gallate augments antioxidant activities and inhibits inflammation during bleomycin-induced experimental pulmonary fibrosis through Nrf2-Keap1 signaling〔J〕.Pulm Pharmacol Ther,2009;22(3):221-36.
16Nakamura T,Matsushima M,Hayashi Y,etal.Attenuation of transforming growth factor-β-stimulated collagen production in fibroblasts by quercetin-induced heme oxygenase-1〔J〕.Am J Respir Cell Mol Biol,2011;44(5):614-20.
17Chitra P,Saiprasad G,Manikandan R,etal.Berberine attenuates bleomycin induced pulmonary toxicity and fibrosis via suppressing NF-κB dependant TGF-β activation:a biphasic experimental study〔J〕.Toxicol Lett,2013;219(2):178-93.
18Kandhare AD,Bodhankar SL,Mohan V,etal.Effect of glycosides based standardized fenugreek seed extract in bleomycin-induced pulmonary fibrosis in rats:Decisive role of Bax,Nrf2,NF-κB,Muc5ac,TNF-α and IL-1β〔J〕.Chem Biol Interact,2015;237(2):151-65.
19Tang H,Gao L,Mao J,etal.Salidroside protects against bleomycin-induced pulmonary fibrosis:activation of Nrf2-antioxidant signaling,and inhibition of NF-κB and TGF-β1/Smad-2/-3 pathways〔J〕.Cell Stress Chaperones,2016;21(2):239-49.
20Divya T,Dineshbabu V,Soumyakrishnan S,etal.Celastrol enhances Nrf2 mediated antioxidant enzymes and exhibits anti-fibrotic effect through regulation of collagen production against bleomycin-induced pulmonary fibrosis〔J〕.Chem Biol Interact,2016;246(1):52-62.
21Kabel AM,Abd-Elmaboud MA,Atef A,etal.Ameliorative potential of linagliptin and/or calcipotriol on bleomycin-induced lung fibrosis:In vivo and in vitro study〔J〕.Environ Toxicol Pharmacol,2017;50(2):216-26.
22劉理靜,錢 紅,尹輝明,等.中華獼猴桃果仁非飽和脂肪酸通過激活Keap1/Nrf2信號通路增強肺纖維化大鼠抗氧化能力〔J〕.細胞與分子免疫學雜志,2016;32(4):479-83.
23羅慶凱,何振華,張秀峰,等.苦參堿對博萊霉素誘導的肺纖維化大鼠中Nrf2表達的影響〔J〕.中國現代醫學雜志,2012;22(13):16-20.
24韓 麗,江 濤.蘿卜硫素激活Nrf2/ARE通路對博來霉素致大鼠肺纖維化的作用〔J〕.中國新藥與臨床雜志,2016;35(12):899-905.
25Liu Y,Lu F,Kang L,etal.Pirfenidone attenuates bleomycin-induced pulmonary fibrosis in mice by regulating Nrf2/Bach1 equilibrium〔J〕.BMC Pulm Med,2017;17(1):63.
26Zhao F,Shi D,Li T,etal.Silymarin attenuates paraquat-induced lung injury via Nrf2-mediated pathway in vivo and in vitro〔J〕.Clin Exp Pharmacol Physiol,2015.
27Liu MW,Liu R,Wu HY,etal.Radix puerariae extracts ameliorate paraquat-induced pulmonary fibrosis by attenuating follistatin-like 1 and nuclear factor erythroid 2p45-related factor-2 signalling pathways through downregulation of miRNA-21 expression〔J〕.BMC Comp Alte Med,2016;16:11.
28Liu B,Cao B,Zhang D,etal.Salvianolic acid B protects against paraquat-induced pulmonary injury by mediating Nrf2/Nox4 redox balance and TGF-β1/Smad3 signaling〔J〕.Toxicol Appl Pharmacol,2016;309:111-20.
29Xu Y,Tai W,Qu X,etal.Rapamycin protects against paraquat-induced pulmonary fibrosis:Activation of Nrf2 signaling pathway〔J〕.Biochem Biophys Res Commun,2017;490(2):535-40.
30Shen H,Wu N,Wang Y,etal.Chloroquine attenuates paraquat-induced lung injury in mice by altering inflammation,oxidative stress and fibrosis〔J〕.Int Immunopharmacol,2017;46:16-22.
31Zhu Z,Yang G,Wang Y,etal.Suppression of thioredoxin system contributes to silica-induced oxidative stress and pulmonary fibrogenesis in rats〔J〕.Toxicol Lett,2013;222(3):289-94.
32Yang J,Wang T,Li Y,etal.Earthworm extract attenuates silica-induced pulmonary fibrosis through Nrf2-dependent mechanisms〔J〕.Lab Invest,2016;96(12):1279-300.
33Zhou X,An G,Chen J.Inhibitory effects of hydrogen sulphide on pulmonary fibrosis in smoking rats via attenuation of oxidative stress and inflammation〔J〕.J Cell Mol Med,2014;18(6):1098-103.

