地塞米松對原發性肝癌肝切除術患者肝功能血清炎癥因子及免疫功能的影響*
張明華 劉瑞文 于亞平 夏曉華
(江蘇大學附屬昆山醫院肝膽外科,江蘇 昆山215300)
對有手術指征的肝癌患者而言,行肝切除術清除病灶是改善患者預后的主要治療方法之一[1],但易引發術后肝功能異常甚至肝衰竭,嚴重威脅患者術后順利恢復。炎癥反應失控被認為是肝切除術后引起肝臟損傷加重的主要因素之一,故而近年來探索有效措施控制炎癥反應程度成為臨床研究的重點[2]。糖皮質激素是臨床應用較多的抗炎藥物,因存在諸如免疫抑制、引起代謝紊亂等不良作用,很長時間以來在肝癌肝切除術圍手術期應用不多,但這一情況正逐步發生轉變。本研究觀察短期、適量應用地塞米松對肝癌肝切除患者肝功能、炎癥因子及免疫功能的影響,以探索該類藥物在其中的應用價值,可為臨床應用提供參考,現報告如下 。
1 臨床資料
1.1 一般資料 全部研究病例來源于2007年4月~2015年3月我院收治的原發性肝癌患者。符合《原發性肝癌診療規范》中的診斷標準[3],具體為:①病理學檢查存在肝癌細胞。②肝臟影像學符合肝癌表現,且未發現肝外腫瘤。③血清甲胎蛋白(AFP)≥400μg/L,且排除其他原因所致其升高。④乙型肝炎病毒標志物或丙型肝炎病毒標志物陽性。⑤年齡20~70歲。⑥Child-Pugh分級屬A級和B級者。選擇符合手術指征,擬擇期行肝癌肝切除術的患者納入研究。排除及剔除標準:①排除心腦、肺腎及血液、內分泌、自身免疫系統嚴重疾病。②肝功能Child-Pugh分級屬于C級的患者。③智力障礙、精神病及過敏體質者。④未簽署知情同意書者。共89例納入研究,依據抽簽結果隨機分為觀察組和對照組。觀察組47例,其中男31例,女16例;年齡39~70歲,平均(8.73±6.02)歲;肝功能Child-Pugh分級:A級28例,B級19例;肝門阻斷時間7.5~19.0 min,平均(14.73±4.22)min;手術持續時間5~12 h,平均(7.33±1.32)h;切除范圍:肝葉切除14例,半肝切除16例,肝段切除17例。對照組42例,其中男25例,女17例;年齡40~70歲,平均(8.22±6.37)歲;肝功能Child-Pugh分級:A級26例,B級16例;肝門阻斷時間7~20 min,平均(14.56±4.17)min;手術持續時間5~13 h,平均(7.33±1.32)h;切除范圍:肝葉切除12例,半肝切除15例,肝段切除16例。兩組一般資料比較無統計學差異(P>0.05),具有可比性。
1.2 治療方法 所有病例按常規流程進行肝切除術前準備及術后治療,術后措施包括吸氧、預防感染、保肝、營養支持、維持水電解質及酸堿平衡等。對照組按照常規流程處理,觀察組在常規處理基礎上于手術當天開始給予地塞米松10mg/次,1次/d,溶于100ml 5%葡萄糖液中靜脈輸注,連續應用3d。
1.3 觀察指標
1.3.1 實驗室指標 ①肝功能指標:谷氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、堿性磷酸酶(ALP)以及血清總膽紅素(TBIL),采用貝克曼庫爾特AU5800全自動生化分析儀檢測。②血清炎癥因子:腫瘤壞死因子(TNF-α)、C反應蛋白(CRP)、白介素-6(IL-6)、白介素-8(IL-8),采用酶聯免疫吸附法檢測,試劑盒由北京晶美生物技術有限公司生產。③免疫功能指標: CD3+、CD4+、CD8+及 CD4+/CD8+值,采用FACS CantoII流式細胞儀檢測,試劑產自美國Becton Dickinson公司。術前及術后4、8d各檢測1次。
1.3.2 術后恢復及并發癥發生情況 包括腸道功能恢復時間、住院時間和感染、水腫、胃腸道反應及肝功能不全、肝衰竭、膽瘺等常見并發癥。
1.3.3 遠期生存率評價 隨訪統計1、2年生存率。
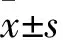
2 結果
2.1 兩組肝功能比較 兩組ALT、AST、TBIL、ALP水平比較差異有統計學意義(F=5.237、5.842、4.376、4.496,均P<0.05);兩組ALT、AST、TBIL隨著時間的延長呈先升高后下降的趨勢,而ALP呈先降低后升高(F=7.633、9.426、5.430、7.035,均P<0.05),且兩組各指標變化趨勢存在顯著差異(F=4.391、4.302、4.730、5.047,均P<0.05),見表1。
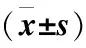
表1 兩組肝功能指標水平比較Table 1 Comparison of liver function indexes between the two groups
2.2 兩組血清炎癥因子水平比較 兩組TNF-α、CRP及IL-8、IL-6水平比較差異有統計學意義(F=7.393、8.452、6.627、5.611,均P<0.05),兩組TNF-α、CRP及IL-8、IL-6隨著時間的延長呈先升高后下降的趨勢(F=12.493、13.455、8.247、7.621,均P<0.05),且兩組各指標變化趨勢存在顯著差異(F=6.305、6.747、4.632、5.508,均P<0.05),見表2。
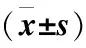
表2 兩組血清炎癥因子水平比較Table 2 Comparison of serum inflammatory factors between the two groups
2.3 兩組免疫功能水平比較 兩組CD3+、CD4+、CD8+以及 CD4+/CD8+值水平無明顯不同(F=1.221、1.098、1.310、0.516,均P>0.05)。兩組CD3+、CD4+、CD4+/CD8+隨著時間的延長表現出逐漸下降的趨勢,而CD8+逐漸升高(F=4.082、3.956、4.225、4.316,均P<0.05),觀察組與對照組變化幅度趨同(F=1.314、1.450、1.107、0.737,均P>0.05),見表3。
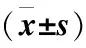
表3 兩組免疫功能水平比較Table 3 Comparison of immune function between the two groups
2.4 兩組術后恢復及并發癥發生情況 觀察組腸道功能恢復時間、住院時間均低于對照組,差異均有統計學意義(t=14.274、9.063,P<0.05);兩組術后感染、水腫、胃腸道反應及肝功能不全、肝衰竭、膽瘺發生率比較,差異無統計學意義(2=0.000、0.000、0.000、0.000、0.000、0.000,均P>0.05),見表4。
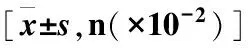
表4 兩組術后恢復及并發癥發生情況比較Table 4 Comparison of postoperative recovery and complications between the two groups
2.5 兩組遠期生存率比較 觀察組術后1年生存率93.62%(44/47例),2年生存率78.72%(37/47例),而對照組分別為88.10%(37/42例)和76.19%(32/42例),兩組1、2年生存率比較差異無統計學意義(P>0.05)。
3 討論
肝切除術引起肝臟損傷與多種因素有關,目前認識較充分的有:①手術造成切口創面、牽拉、壓迫等造成的損傷[4]。②諸如半肝、肝段切除時阻斷肝血流,可造成的肝臟組織缺血、缺氧損傷和術后肝臟恢復灌注造成的缺血再灌注損傷[5]。③應激反應、炎癥反應引起的損傷[6]。④麻醉藥物等的應用所造成一定程度的肝損傷。⑤手術前后腹腹腔壓力變化,尤其是腹腔鏡CO2氣腹前后造成的腹腔內環境紊亂所引起的血流動力學異常、腸道吸收毒素增加等造成的術后肝臟組織損傷[7]。這些因素中有不少是可控的,對它們有效干預被認為是保證患者術后順利恢復以及改善預后的關鍵。本研究重點研究“炎癥反應”即屬于可控因素之一[8]。肝切除術后炎癥反應程度與肝組織損傷有密切的相關性[9-10],對炎癥反應有效控制有利于術后肝功能恢復并降低肝衰竭的發生風險。本研究觀察的炎癥指標TNF-α、CRP及IL-8、IL-6均屬于促炎性細胞因子[11],它們在包括肝切除術在內的所有外科手術后都有高水平表達,在造成機體組織損傷的同時可造成炎癥反應擴大,甚至引起“炎癥瀑布”,嚴重威脅患者生命健康,控制它們的表達可減輕機體組織損傷,也可用于評估患者預后[12]。在肝切除術后必須重視抑制炎癥反應的背景下,對糖皮質激素的重新認識使該類藥物逐漸走入臨床應用的視野。
糖皮質激素通過多種途徑發揮強力抗炎活性。既往對該類藥物的認知限制了它們在肝癌肝切除術中的應用,主要基于以下幾點疑慮:①免疫抑制作用。擔憂它們的免疫抑制作用會增加術后感染的風險[13],也可能會導致乙肝病毒、丙肝病毒等肝炎病毒由此被激活而損傷肝組織[14]。②水-鈉儲溜作用。這一作用可造成心臟負荷增加的同時也會加重肝臟負擔[15],不利于術后恢復。③可能誘發高血壓,也可能誘發消化性潰瘍以及各種代謝紊亂,致使病情復雜化。但隨著臨床研究的深入,這些疑慮逐漸減少,并逐漸認識到肝癌肝切除術圍手術期也存在糖皮質激素的應用價值,筆者歸納已有認識并結合自己的觀點總結如下:①抗炎作用。強勁的抗炎作用可減輕各類炎癥細胞、炎癥因子對肝組織及機體的損傷[16-17]。②辨證的認識免疫抑制作用。一者不可否認糖皮質激素存在免疫抑制作用,二者也應認識到劇烈的炎癥反應也會引起免疫抑制[18-19],但肝切除圍手術期應用該類藥物并不會造成這兩種免疫抑制作用疊加,畢竟糖皮質激素的強力抗炎作用一定程度上可緩解炎癥反應產生的免疫抑制。因此,短期、適量應用該類藥物的免疫抑制作用不應過分高估。③短期、適量應用引起水-鈉儲溜、誘發高血壓及消化性潰瘍等不良反應的風險也不應過分高估[20-21]。由此可見,糖皮質激素在肝癌肝切除術領域的應用具有研究價值。
本研究觀察地塞米松在肝癌肝切除圍手術期的應用價值,選擇應用時間為持續3d,應用劑量為每日10mg,屬于短期、適量應用方案,類似文獻報道目前尚不多見。本研究結果顯示,術后觀察組肝功能指標ALT、AST、TBIL、ALP優于對照組;炎癥因子TNF-α、CRP及IL-8、IL-6水平低于對照組;免疫功能指標CD3+、CD4+、CD8+以及 CD4+/CD8+值與對照組變化趨勢類似;術后觀察組腸道功能恢復時間、住院時間均短于對照組,提示短期應用地塞米松有利于術后恢復,而兩組并發癥發生情況無顯著差異,提示地塞米松不增加術后并發癥的發生;兩組術后1、2年生存率比較無統計學差異,提示地塞米松尚不影響遠期預后。
4 結論
肝癌肝切除術圍手術期短期、適量應用地塞米松即能發揮有力的保肝、抗炎作用,同時不顯著增加免疫抑制和術后并發癥發生的風險。但這只是糖皮質激素在肝癌肝切除術圍手術期應用的初步探索,臨床應繼續深入研究更合適的藥物種類及給藥方案,期待更多的醫者參與。
[1]Alvarez FA, Ardiles V, Claria RS,etal. Associating liver partition and portal vein ligation for staged hepatectomy (ALPPS): tips and tricks[J]. Journal of Gastrointestinal Surgery, 2013, 17(4): 814-821.
[2]Ibrahim-Zada I, Murad MH, Reid-Lombardo K. Comparison of two-stage hepatectomy and single-stage hepatectomy after downstaging by chemotherapy for the treatment of initially unresectable colorectal liver metastases[J]. Chirurgia (Turin), 2015, 28(2): 55-62.
[3]中華人民共和國衛生部.原發性肝癌診療規范(2011 年版)[J].臨床肝膽病雜志,2011,15(11):1141-1159.
[4]Mise Y, Aloia TA, Conrad C,etal. Volume regeneration of segments 2 and 3 after right portal vein embolization in patients undergoing two-stage hepatectomy[J]. Journal of Gastrointestinal Surgery, 2015, 19(1): 133-141.
[5]Voron T, Tselikas L, Pietrasz D,etal. Sarcopenia impacts on short-and long-term results of hepatectomy for hepatocellular carcinoma[J]. Annals of surgery, 2015, 261(6): 1173-1183.
[6]Soubrane O, de Rougemont O, Kim KH,etal. Laparoscopic living donor left lateral sectionectomy: a new standard practice for donor hepatectomy[J]. Annals of Surgery, 2015, 262(5): 757-763.
[7]Lin NC, Nitta H, Wakabayashi G. Laparoscopic major hepatectomy: a systematic literature review and comparison of 3 techniques[J]. Annals of surgery, 2013, 257(2): 205-213.
[8]Wakabayashi G, Cherqui D, Geller DA,etal. Laparoscopic hepatectomy is theoretically better than open hepatectomy: preparing for the 2nd International Consensus Conference on Laparoscopic Liver Resection[J]. Journal of hepato-biliary-pancreatic sciences, 2014, 21(10): 723-731.
[9]Huang J, Xu L, Luo Y,etal. The inflammation-based scores to predict prognosis of patients with hepatocellular carcinoma after hepatectomy[J]. Medical Oncology, 2014, 31(4): 1-8.
[10] Ella E, Heim D, Stoyanov E,etal. Specific genomic and transcriptomic aberrations in tumors induced by partial hepatectomy of a chronically inflamed murine liver[J]. Oncotarget, 2014, 5(21): 10318-10331.
[11] Li J, Li FX, Che JX,etal. Ameliorative effects of neurolytic celiac plexus block on stress and inflammation in rats with partial hepatectomy[J]. Tropical Journal of Pharmaceutical Research, 2015, 14(6): 1021-1028.
[12] Okamura Y, Ashida R, Ito T,etal. Preoperative neutrophil to lymphocyte ratio and prognostic nutritional index predict overall survival after hepatectomy for hepatocellular carcinoma[J]. World journal of surgery, 2015, 39(6): 1501-1509.
[13] Andersen K J, Knudsen A R, Wiborg O,etal. Chronic stress does not impair liver regeneration in rats[J]. Regenerative medicine research, 2015, 3(1): 2.
[14] Li N, Gu WL, Weng JF,etal. Short‐term administration of steroids does not affect postoperative complications following liver resection: Evidence from a meta‐analysis of randomized controlled trials[J]. Hepatology Research, 2015, 45(2): 201-209.
[15] Lu ZQ, Lu JX, Deng YJ. Glucocorticoids offer protection against myocardial injury in a murine model of sepsis[J]. International journal of clinical and experimental medicine, 2015, 8(8): 12211.
[16] Bing Y, Zhu S, Yu G,etal. Glucocorticoid-induced S-adenosylmethionine enhances the interferon signaling pathway by restoring STAT1 protein methylation in hepatitis B virus-infected cells[J]. Journal of Biological Chemistry, 2014, 289(47): 32639-32655.
[17] Kohjima M, Tsai T H, Tackett B C,etal. Delayed liver regeneration after partial hepatectomy in adipose differentiation related protein-null mice[J]. Journal of hepatology, 2013, 59(6): 1246-1254.
[18] Richardson AJ, Laurence JM, Lam V W T. Use of pre-operative steroids in liver resection: a systematic review and meta‐analysis[J]. HPB, 2014, 16(1): 12-19.
[19] Movahedi A, Basir R, Rahmat A,etal. Orthosiphon stamineus: an Asian tea with substantial anticancer properties[J]. Journal of Nutritional Sciences and Dietetics, 2015, 1(1): 44-52.
[20] Sun Q, Xie Y, Wang G,etal. Identification of genes in HepG2 cells that respond to DNA methylation and histone deacetylation inhibitor treatment[J]. Experimental and therapeutic medicine, 2014, 8(3): 813-817.
[21] Zhai J, Cai X, Qu S,etal. Prospective Randomized Study Of Glucocorticoids In The Impact Of The Liver Function And The Prognosis After Hepatectomy Of Hepatocellular Carcinoma[J]. The Official Journal of The International Hepato Pancreato Biliary Association, 2013, 15(7): 231.

