缺血性心肌病的連續心率減速力與心率變異性研究*
朱王亮,宋 劍,劉 晶,劉美蓮
(包頭醫學院第一附屬醫院老年醫學科,內蒙古包頭 014010)
缺血性心肌病(ICM)是指由于冠狀動脈粥樣硬化而引起冠狀動脈管腔發生狹窄甚至是閉塞,因而冠脈血流量減少,從而心肌缺血缺氧,長期發展就會引起整個心臟的舒縮功能不全,或伴有局部運動障礙的一種疾病[1]。連續心率減速力(heart rate deceleration runs,DRs),是在心率減速力的基礎上進一步研究推出的一項新技術,它可以更好地預警猝死以及對疾病進行危險分層,從而評價心血管疾病患者的預后[2]。同時,郭繼鴻等[3]也對DRs進行了深入研究。這可以評價心臟自主神經功能強弱,進而預警由于自主神經失調發生的心臟不良事件。本文將對DRs與ICM的發病關聯做研究,為ICM的發病與治療提供一定的理論基礎。本研究通過對以上介紹的幾種可以判斷心血管疾病預后的指標及其與ICM的關系,探討其對ICM的高危患者的警示作用以及危險分層,為不良預后ICM患者提供良好的臨床依據,致力于可以早期發現、早期治療,為更好的診斷、治療提供參考,從而達到理想的治療效果。
1 資料與方法
1.1一般資料 選擇2013年1月至2015年1月于本院住院治療并診斷明確的60例ICM患者,作為ICM組,平均(61.52±10.05)歲,其中男45例,女15例。選同期行健康體檢者60名,作為對照組。平均(64.35±13.17)歲,其中男42例,女18例。兩組的一般情況對比差異無統計學意義(P>0.05),具有可比性,見表1。
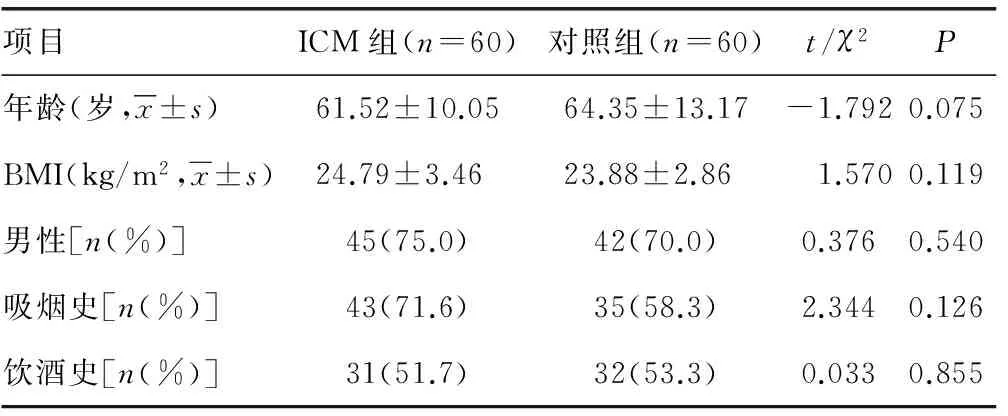
表1 兩組對象一般情況比較
1.2方法
1.2.1ICM診斷標準[1](1)有冠心病史,至少有1次或以上心肌梗死(有Q波或無Q波心肌梗死),或經冠脈造影證實有單支以上血管病變;(2)勞力性呼吸困難;(3)左心室擴大(左室舒張末徑,男性大于55 mm,女性大于50 mm);(4)左室射血分數小于45%;(5)腦鈉肽水平高于正常水平。符合以上條件者入ICM組。
1.2.2ICM的排除標準 (1)合并室間隔穿孔、室壁瘤和乳頭肌功能不全;(2)合并其他心肌病;(3)其他心臟病或其他原因引起的心臟擴大和心力衰竭;(4)非竇性心律者;(5)二度房室阻滯,或三度房室阻滯,或病態竇房結綜合征者。所有受試者均簽署受試同意書。
1.2.3個人史及既往史 (1)每日吸煙至少1支,連續吸煙1年以上者,視為吸煙史陽性;(2)平均每日飲酒大于100 mL,視為飲酒史陽性;(3)根據體質量指數(BMI,kg/m2)=體質量(kg)/身高2(m2)得出結果,男性大于27 kg/m2、女性大于25 kg/m2視為肥胖陽性;(4)高血壓病史:距本次確診為ICM發病前1個月已被診斷為高血壓或者如果患者從未測過自身血壓,此次發病被診斷為高血壓,視為高血壓陽性;(5)糖尿病病史:距本次確診為ICM發病前1個月已被診斷為糖尿病或者如果患者從未測過自身血糖,此次發病被診斷為糖尿病,視為糖尿病陽性;(6)高膽固醇血癥:距本次確診為ICM發病前1個月已被診斷為高膽固醇血癥或者如果患者從未測過自身血脂,此次發病被診斷為高膽固醇血癥,視為高膽固醇血癥陽性。
1.2.4DRs的測定 所有受檢者于就診次日清晨8:00-8:30于本院行24 h動態心電圖檢查。本院24 h動態心電圖系統,去除偽差及干擾后,可自動計算DRs值。
1.2.5DRs的計算方法[3](1)測量逐跳的RR 值:在記錄的24 h動態心電圖心電圖中,找出逐漸延長的RR間期,測量其具體數值,并標出;(2)計算并確定心率減速力持續的周期值:以每個心動間期(ms)為縱坐標,以心動周期(RR間期)的先后順序的序號為橫坐標,制成心率減速力周期值不同的順序圖,進而能計算出連續周期不同的DRs的各自數值;(3)計算連續周期不同的心率減速力的絕對數值及相對值:先計算持續周期不同DRs值的心率減速力各絕對值,再除以整個記錄時間段內竇性心律RR 間期的總數值,則可得到持續不同的周期的相對值。
1.2.6心率變異性的計算方法 所有受檢者于就診次日清晨8:00-8:30于本院行24 h動態心電圖檢查。本院動態心電圖系統,有自動檢測心率變異性的功能。計算方法包括時閾分析法和頻域分析法。
1.2.6.1時閾分析法 逐個識別一定時間記錄的QRS波,去除非竇性心律和偽差,將一系列RR間期進行統計學離散趨勢分析便得到時域分析指標。正常范圍表示自主神經功能健全,下降表示自主神經功能受損。時域分析指標有以下幾種:RR間期總體標準差(SDNN)、RR間期平均值的標準差(SDANN)、相鄰RR間期差值的均方根(RMSSD)。
1.2.6.2頻域分析法 頻域分析法即功譜分析法,將一定心搏間期內的心電圖的變化轉變為頻譜,以這個期間的RR間期為橫坐標,以功率譜能量為縱坐標,根據功率譜能量隨RR間期頻率變化的關系,計算功率譜密度。總功率譜反映總的自主神經張力;在功率譜的0.04、0.10、0.15 Hz中出現3個譜峰。第1頻段為低頻峰段,第2頻段為中頻峰段,第3頻段為高頻峰段。第1頻段主要受RASS系統影響,主要反映交感神經系統的調節作用。第2頻段主要受血壓、壓力感受器影響。第3頻段主要受呼吸的影響。本研究主要應用低頻與高頻兩項指標。低頻段主要反映交感神經張力,高頻段主要反映副交感神經張力,低頻與高頻之比反映交感/副交感神經之間張力的平衡。此研究主要探討反映心率變異性頻域的指標包括低頻成分(LF)及高頻成分(HF)。
1.2.7實驗試劑、儀器 24 h動態心電圖記錄儀由北京谷山豐生物醫學技術有限公司提供。
2 結 果
2.1兩組對象DRs值的比較 ICM組的DR4、DR8低于對照組,差異有統計學意義(P<0.05),見表2。
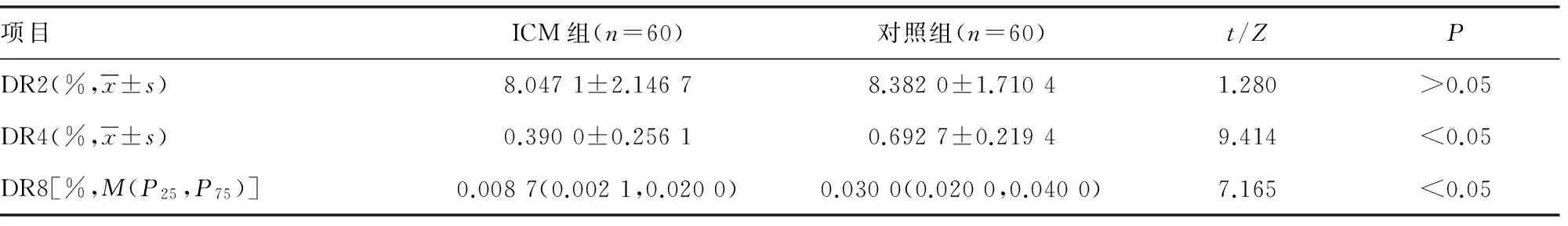
表2 兩組對象DRs值的比較
2.2兩組對象心率變異性比較 ICM組患者的SDNN、 SDANN水平低于對照組;ICM組患者的RMSSD水平低于對照組;ICM組患者的LF水平高于對照組;ICM組患者的HF水平低于對照組;兩組之間比較差異均有統計學意義(P<0.05),見表3。
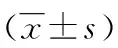
表3 兩組對象HRV比較
2.3DRs值與心率變異性指標SDNN、SDANN的相關性分析 DRs的各值(DR2、DR4、DR8)與心率變異性(SDNN、SDANN、RMSSD、LF、HF)分別進行相關性分析后,DR2、DR4、DR8分別與SDNN、SDANN、RMSSD、LF、HF有正相關性,指標之間相關性均有統計學意義(P<0.05),見表4。
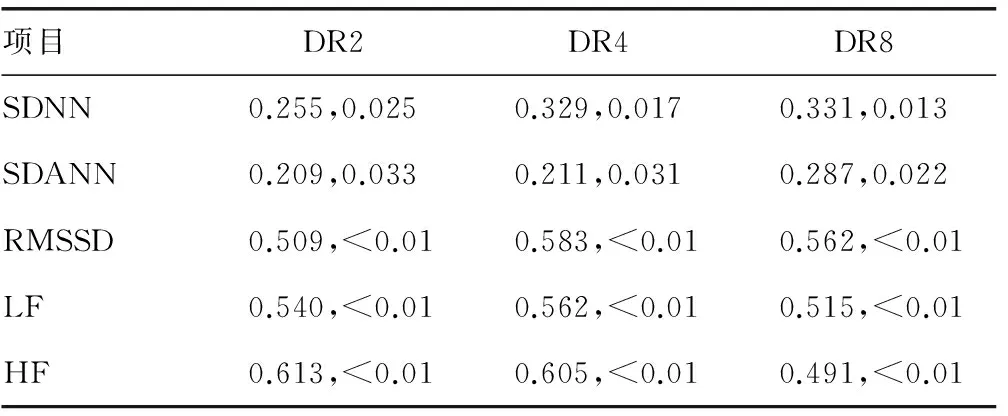
表4 DRs值與心率變異性指標SDNN、SDANN的相關性分析(r,P)
3 討 論
ICM是冠心病的終末表現,由于冠狀動脈粥樣硬化,冠狀動脈的血流量減少,導致心肌長期缺血缺氧,心臟的收縮和舒張功能減低,心臟運動受到限制。ICM的臨床表現復雜,繼而治療上難度較大,預后也常常不能盡如人意。故對疾病的早期發現、早期治療顯得十分重要。
在過去的研究中,ICM的發病機制中提到自主神經功能紊亂尤其是交感神經的調控失衡影響心臟的收縮:心肌缺血使交感神經系統活躍,心率加快,交感神經系統的活躍也可以導致細胞內轉運鈣離子的肌漿網鈣ATP酶活性下降,心肌耗氧量增加,心肌的負擔越來越重,轉運鈣離子的肌漿網鈣ATP酶減少,心肌收縮力下降。而本研究著重探討其發生機制的反面迷走神經對機體的作用減弱或失調導致的結果。迷走神經神經末梢釋放乙酰膽堿,與膽堿能受體結合,對相應的器官產生相應的作用,在心臟主要表現為負性肌力、負性傳導、負性頻率的作用。LAITIO等[4]研究認為,心血管病患者發生心臟事件的本質是交感神經與迷走神經失衡中迷走神經被過度抑制,導致迷走神經對心臟的保護性作用減弱,類似“交感風暴”的惡性事件的原因就在此。DRs是心臟的一種減速能力,屬于迷走神經作用的范疇,它可以定量反映心臟迷走神經作用是否正常。 左萍等[5]研究顯示,國人急性心肌梗死患者DRs值中DR4及DR8較健康人顯著降低。后續的研究也較多集中于心肌梗死猝死風險的預測面,并沿用這一界值[6-8]。 DRs與急性心肌梗死患者的研究表明了其對急性心肌梗死的預測有價值[9]。常超等[10]選取58例不穩定心絞痛患者以及同期住院的58例非不穩定心絞痛患者進行研究,研究顯示不穩定心絞痛組DRs值較對照組明顯減低,且危險分層最終猝死率吻合。原因均與冠心病患者迷走神經作用減弱有關。本研究中,ICM組DRs各指標較對照組明顯減低,可能與ICM患者迷走神經對心臟保護作用減弱有關。這與國內的研究是一致的。
心率變異性是連續竇性心跳的RR間期之間的微小差異。目前心率變異性常常被應用于臨床來檢測疾病的自主神經功能。它是調節心血管乃至整個機體穩態的重要因素。自主神經的功能主要表現在調節心肌、平滑肌和腺體的活動。除了少數的器官,一般器官都接受交感神經和迷走神經共同調節作用。一般情況這兩個神經系統具有拮抗作用,也就是說當交感神經活躍時,迷走神經處于受抑制狀態,反之,如果迷走神經起主導作用,交感神經也處于被抑制狀態。自1978年 WOLF等報道了急性心肌梗死后嚴重心律失常事件和猝死與心率變異性的降低密切相關,使心率變異性在臨床中受到高度重視,相關研究主要有心率變異性在心力衰竭、高血壓、心肌病以及糖尿病中的作用[11-12]。在高血壓、心力衰竭、心肌病、糖尿病中都會出現不同程度的心率變異性減低。本研究中,ICM組較對照組心率變異性明顯減低,可能與ICM自主神經功能紊亂即迷走神經興奮,而交感神經被抑制有關。本研究結果與國內外研究結果基本一致。
DRs、心率變異性都是基于24 h動態心電圖得出結果。由于24 h動態心電圖簡便、無創、經濟,容易應用于臨床。在做24 h動態心電圖的同時,這些指標可以同時被觀察。本研究結果顯示,兩者呈正相關。兩者可以聯合反映心臟自主神經功能狀況,研究ICM患者兩者之間的關系可以更好地預測和評估ICM患者疾病狀況,從而可以更早、更好的提供治療方案,從而服務于ICM患者。
[1]李國慶,郭自同.缺血性心肌病性冠心病概述[J].臨床心血管雜志,2001,17(4):157-158.
[2]GUZIK P,PISKORSKI J,SCHMIDT G, et al. Heart rate deceleration runs for postinfarction risk prediction[J].J Electrocardiol,2012,45(1):70-76.
[3]郭繼鴻.猝死預警新技術:連續心率減速力測定[J].臨床心電學雜志,2012,21(3):227-233.
[4]LAITIO T,JALONEN J,KUUSELA T,et al.The role of heart rate variability in risk stratification for adverse postoperative cardiac events[J].Anesth Analg,2007,105(6):1548-1560.
[5]左萍,楊曉云,黃芬,等.急性心肌梗死患者連續心率減速力的研究[J].臨床心電學雜志,2013,22(3):186-189.
[6]KISOHARA M,STEIN P K,YOSHIDA Y,et al.Multi-scale heart rate dynamics detected by phase-rectified sifnal averaging predicts motality after acute myocardial infarction [J].Europace 2013,15(3):437-443.
[7]LIU Y,SYED Z,SCIRICA B M,et al.ECG morphological variability in beat space for risk stratification after acute coronary syndrome [J].J Am Heart Assoc,2014,3(3):e000981.
[8]GAO L,CHEN Y D,SHI Y J,et al.Predication value of deceleration capacity of rate and GRACE risk score on major adverse cardiac events in patients with acute myocardial infarction [J].Zhonghua Xin Yue Guang Bing Za Zhi,2016,44(7):583-587.
[9]何文一,鄧國蘭,王伶莉,等.急性心肌梗死患者連續心率減速力的臨床研究[J].江蘇實用心電雜志,2014,23(3):167-169.
[10]常超,劉桂芝.不穩定型心絞痛患者連續心率減速力與心率減速力的關系分析.[J]中國全科醫學,2013,16:3121-3123.
[11]EBRAHIMZADEN E,POOYAN M,BIJARA.A novel approach to predict sudden cardiac death(SCD)using nonlinear and time-frequency analyses from HRV singnals[J].PloS One,2014,9(2):e81896.
[12]SIMULA S,VANNIEN E,LEHTO S,et al.Heart rate variability associates with asymptomatic coronary atherosclerosis[J].Clin Auton Res,2014,24(1):31-37.

