黃葵膠囊對慢性腎小球腎炎模型大鼠腎組織病理和免疫功能的影響
徐賽華 胡靜娜
慢性腎臟病指腎臟系統代謝紊亂導致的腎臟結構性破壞和功能性損害綜合征,發病機制復雜,可能與免疫紊亂有關[1]。慢性腎小球腎炎發病率較高,西醫治療多用糖皮質激素和免疫抑制劑,雖有較好的臨床療效,但長期服用藥物副作用較大[2]。中醫認為慢性腎小球腎炎是由于風邪夾濕引起濕濁、瘀血,中醫藥在防治中具有獨特的優勢[3]。具有“清熱除濕、消腫解毒”功效的黃葵膠囊對慢性腎小球腎炎具有較好的臨床療效。本研究旨在探討黃葵膠囊對慢性腎小球腎炎大鼠腎組織免疫功能和炎癥因子的影響,為其治療提供依據。
1 實驗材料
1.1動 物 健康雄性SPF級SD大鼠50只,雌雄各半,8周齡,體質量190±10g,由北京維通利華實驗動物技術有限公司提供。動物許可證號:SCXK(京)2011-0011。飼養于浙江中醫藥大學動物實驗中心。
1.2藥物與試劑 黃葵膠囊(規格:0.5g/粒,江蘇蘇中藥業集團股份有限公司,批號20160123);小牛血清白蛋白、不完全弗氏佐劑和完全弗氏佐劑購自上海生工生物工程有限公司(批號16010627、16010556、16010581);RIPA裂解試劑盒和BCA蛋白定量試劑盒購自北京中杉金橋生物技術有限公司(批號N16021766、p160102-1);白介素-6(IL-6)、細胞間黏附因子-1(ICAM-1)、轉化生長因子-β1(TGF-β1)試劑盒購自南京建成生物工程研究所公司(批號20160213、20160225、20160209);大鼠 PITC CD3、PE CD4和CD8抗體購自美國eBioscience公司(批號D160312、D160328、D160407)。
1.3儀 器 OLYMPUSAU5400全自動生化分析儀,日本奧林巴斯有限公司;SW-CJ-2F超凈工作臺,蘇州安泰超凈工作臺凈化有限公司;SMZ660熒光顯微鏡,日本尼康公司;23R離心機,力康集團力新儀器(上海)有限公司;DXI800化學發光儀,美國貝克曼庫爾特有限公司產品;FACSCanto流式細胞儀,美國BD公司等。
2 實驗方法
2.1慢性腎小球腎炎大鼠模型建立[4-5]SD大鼠適應性喂養1周,禁食不禁水12h后,取40只大鼠建立慢性腎小球腎炎模型。將適量小牛血清白蛋白溶于 0.01mol/L 的磷酸緩沖液(pH7.2~7.4)中,濃度為2mg/mL,與等體積不完全弗氏佐劑混成乳白色懸液,在大鼠雙側腋下、腹股溝作5點皮下注射,2mL/只。注射1周后,將溶有小牛血清白蛋白的磷酸緩沖液與等體積的完全弗氏佐劑混勻成濃度為1mg/mL的乳白色懸液,相同方式皮下注射。第3周取濃度為2mg/mL的小牛血清白蛋白的磷酸緩沖液1mL/只,進行大鼠尾靜脈注射,建立慢性腎小球腎炎大鼠模型。
2.2實驗分組和給藥 將50只SD大鼠按照性別分為兩個區組并編號,采用隨機數字表法分為模型組、黃葵膠囊低、中、高劑量組及空白對照組,每組10只。除空白對照組外其余大鼠均造模。建模2周后空白對照組和模型組給予2mL/(kg·d)生理鹽水灌胃,黃葵膠囊低、中、高劑量組分別給予0.5g/kg、1.0g/kg和2.0g/kg的黃葵膠囊灌胃,體積為2mL/(kg·d)。連續灌胃8周后處死各組大鼠,收集腎臟組織、尿液和血清樣本進行檢查。
2.3指標測定
2.3.1病理學觀察 取各組大鼠左側部分腎組織,10%甲醛固定,常規石蠟切片包埋,蘇木素-伊紅(HE)染色,光學顯微鏡下觀察腎臟組織病理學變化。
2.3.2腎功能指標檢測 取各組大鼠主動脈血3mL,置不含抗凝劑的試管內,室溫下自然凝集30min,2000r/min離心10min,分離血清,全自動生化分析儀分析腎功能指標血清肌酐(Scr)、尿素氮(BUN)、尿酸(UA)含量。
2.3.3外周血T淋巴細胞亞群比例檢測 取各組大鼠眼眶靜脈血至流式管中,分別加10μL入CD3、CD4和CD8單抗和50μL EDTA抗凝血,混合均勻,避光孵育20min,每管加入2mL溶血素,避光孵育20min,2000r/min離心10min,棄去上清,每管2mL PBS混勻,離心棄去上清,重復洗滌2次,棄上清,加2mL PBS重懸混勻后流式分析外周血T淋巴細胞亞群CD3、CD4和CD8比例。
2.3.4腎組織炎癥因子檢測 取各組大鼠右側腎臟組織樣本,經RIPA裂解后,4℃以10 000r/min離心10min,BCA蛋白定量試劑盒在590nm處檢測蛋白濃度,進行SDS電泳,采用蛋白質印跡法檢測腎臟組織IL-6、ICAM-1和TGF-β1水平,嚴格按照試劑盒說明書操作,計算光密度值。
2.4統計學方法 應用SPSS19.0軟件進行統計分析。計量資料用(x±s) 表示,組間比較采用方差分析,組間兩兩比較采用t檢驗,P<0.05為差異有統計學意義。
3 實驗結果
3.1各組大鼠腎臟病理組織學比較 空白對照組大鼠腎小球、系膜基質未見明顯病理變化,模型組大鼠腎小球硬化、系膜基質增生,黃葵膠囊低、中、高劑量組大鼠腎臟病理變化均較模型組明顯減輕,呈劑量依賴性,但黃葵膠囊高劑量組大鼠腎臟病理變化仍較空白對照組嚴重。見圖1(封二)。
3.2各組大鼠腎功能指標比較 模型組大鼠血清Scr、BUN和UA含量均高于空白對照組、黃葵膠囊低、中、高劑量組(P<0.05),上述指標隨黃葵膠囊劑量的增加含量降低。見表1。
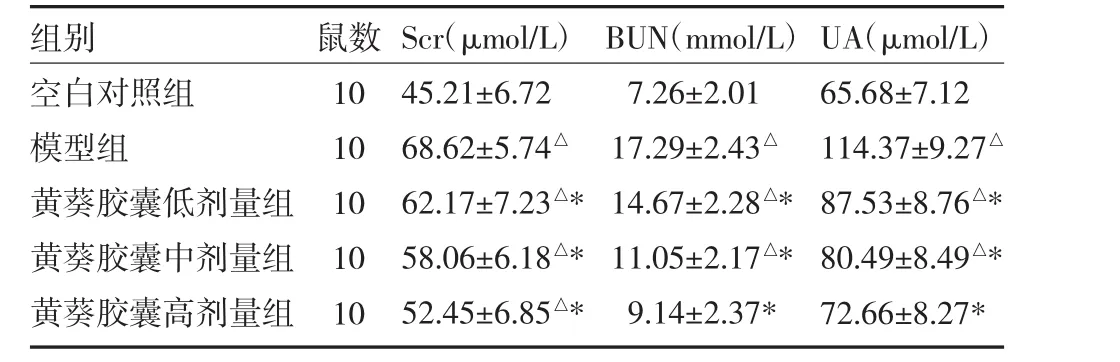
表1 各組大鼠血清肌酐(Scr)、尿素氮(BUN)、尿酸(UA)含量比較(x±s)
3.3各組大鼠外周血T淋巴細胞亞群比例比較 模型組大鼠外周血CD3、CD4和CD4/CD8均明顯低于空白對照組和黃葵膠囊低、中、高劑量組,CD8高于空白對照組和黃葵膠囊低、中、高劑量組,差異均有統計學意義(P<0.05)。見表 2。
3.4各組大鼠腎組織炎癥因子水平比較 模型組大鼠腎組織IL-6、ICAM-1和TGF-β1水平均高于空白對照組,且明顯高于黃葵膠囊低、中、高劑量組,差異均有統計學意義(P<0.05)。見表 3。
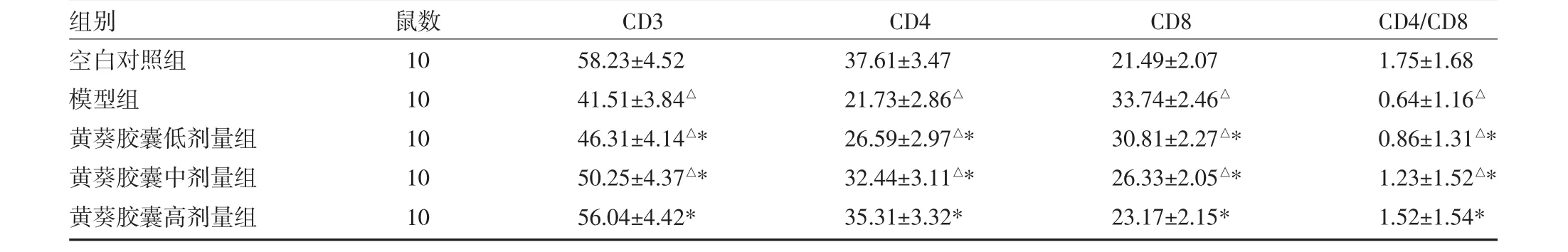
表2 各組大鼠外周血T淋巴細胞亞群CD3、CD4和CD8比例比較(%,x±s)

表3 各組大鼠腎組織IL-6、ICAM-1、TGF-β1水平比較(光密度值,x±s)
4 討論
慢性腎小球腎炎病因復雜,是由多種病理類型組成的腎小球進行性腎功能衰退疾病,是導致腎功能衰竭的主要原因[6]。慢性腎小球腎炎外周血T淋巴細胞亞群紊亂,細胞炎癥因子表達升高,導致免疫功能紊亂,以及內皮細胞和巨噬細胞表達異常,進一步加劇其損傷程度[7]。ICAM-1受到炎性因子刺激后,可增強巨噬細胞與血管內皮細胞間黏附,引起器官結構和功能損傷,激活腎臟局部的腎素-血管緊張素系統,促進TGF-β1表達,加速腎病進展。慢性腎小球腎炎的藥物防治以激素和免疫抑制劑為主,長期應用可導致多種副作用,對患者造成二次傷害[8-9]。黃葵膠囊聯合激素或免疫抑制劑,對慢性腎炎具有較好的臨床療效,但其作用機制尚不明確。
本研究發現,黃葵膠囊可保護慢性腎小球腎炎大鼠腎臟組織,降低大鼠血清Scr、BUN和UA含量,減輕腎組織IL-6、ICAM-1和TGF-β1炎癥水平,穩定外周血T淋巴細胞CD3、CD4和CD8亞群比例。藥理研究[10]表明,黃葵膠囊主要成分為植物黃蜀葵黃酮類化合物,具有抗感染消除、消除尿蛋白、抵抗血小板、增厚腎小球系膜、抗氧化、抑制腎小球免疫炎癥反應、保護腎功能等作用。黃葵膠囊通過增加毛細血管通透性,消除機體過度自由基,減輕機體水腫,減輕腎小管間質病變,改善機體微炎癥狀態和T淋巴細胞亞群紊亂狀態,減輕炎癥反應和保護腎功能,且黃葵膠囊的作用呈劑量依賴性[11-12]。本研究提示黃葵膠囊可保護慢性腎小球腎炎大鼠腎臟組織,改善腎功能指標,減輕炎癥反應,改善免疫功能。
[1]許杰,楊菊紅,單春艷,等.住院2型糖尿病患者合并慢性腎臟病的患病率及其危險因素分析[J].中華內分泌代謝雜志,2014,30(7):597-600.
[2]李大鳳,張明霞.中藥聯合中小劑量潑尼松治療老年慢性腎小球腎炎的療效[J].中國老年學雜志,2014,34(15):4333-4334.
[3]汪六林,宋恩峰.中西醫結合治療慢性腎小球腎炎的Meta分析[J].西部中醫藥,2014,27(5):60-63.
[4]何宇,樊均明,馬欣,等.活血化瘀方對慢性腎小球腎炎大鼠免疫調節作用及機制研究[J].中藥材,2016,39(5):1156-1159.
[5]鄧菲,張萍,馮靜,等.來氟米特對慢性腎小球腎炎大鼠炎癥介質和免疫功能的影響[J].四川大學學報(醫學版),2016,47(2):217-221.
[6]王曉菁,陳海平.慢性腎臟病定義及分期系統修訂的進展——2012-KDIGO慢性腎臟病臨床管理實踐指南解讀[J].中華老年多器官疾病雜志,2014,13(5):396-400.
[7]周珊珊,張昕賢,王琛,等.中藥對慢性腎小球腎炎與細胞因子相關性的研究進展[J].臨床腎臟病雜志,2014,14(10):639-641.
[8]謝席勝,左川,馮勝剛,等.腎炎康復片對梗阻性腎病大鼠腎臟金屬蛋白酶1組織抑制劑和細胞間黏附分子1表達的影響[J].西部醫學,2013,25(2):169-172.
[9]張建江,史佩佩,王淼,等.Th17/Treg失衡及IL-17、TGF-β1水平在兒童過敏性紫癜和紫癜性腎炎中的研究[J].中華腎臟病雜志,2014,30(9):702-703.
[10]王冬雪,張新茹,侯繼秋,等.黃葵膠囊治療難治性腎病綜合征的系統評價[J].中國藥物應用與監測,2016,13(4):201-205.
[11]管瑞文.黃葵膠囊聯合坎地沙坦對紫癜性腎炎患者血清IL-6、TNF-α 及調節性 T 細胞的影響[J].中國中西醫結合腎病雜志,2016,17(6):531-532.
[12]楊騰舜,歐陽俊,李大勇,等.黃葵膠囊對早期糖尿病腎病患者腎小球、腎小管性蛋白/酶的影響[J].中南醫學科學雜志,2015,43(2):165-168.

