松郁安神方對異相睡眠剝奪大鼠海馬CREB表達的影響
曾雪愛 ,周春權 ,王秀峰 ,張一帆 ,黃俊山 (1.福建省中醫藥研究院,福建 福州 350003;2.福建省中醫睡眠醫學重點實驗室,福建 福州 350003)
睡眠是機體復原、整合和鞏固記憶的重要環節,是維持生命所必須的過程,根據睡眠過程中腦電圖、眼球運動情況,睡眠可分為快速眼球運動(rapid eye movement,REM)和非快速眼球運動(non rapideye movement,NREM)兩個時相。其中 REM 睡眠亦稱異相睡眠(paradoxical sleep),它對于保證學習、記憶和情感等大腦高級功能正常具有非常重要的作用[1]。隨著生活節奏的加快和社會競爭的增加,睡眠障礙或睡眠相關疾病的發生率逐年增加,越來越多的人處于慢性睡眠剝奪狀態。長期睡眠不足或異相睡眠剝奪(paradoxical sleep deprivation,PSD)嚴重影響人們的生活質量、身心健康和學習記憶。松郁安神方是黃俊山教授臨床上治療失眠的經驗效方,臨床上用于治療失眠療效顯著。前期實驗已證實該方能改善REM睡眠剝奪所致的大鼠學習記憶能力下降[2],本實驗進一步通過檢測大鼠海馬學習記憶的關鍵蛋白——cAMP反應元件結合蛋白(cAMP response element binding protein,CREB)的表達和變化,探討松郁安神方改善PSD大鼠學習記憶能力的作用機制。
1 材料
1.1 動物 健康雄性Sprague-Dawley大鼠,清潔級,體質量(200±10)g,購自上海斯萊克實驗動物有限責任公司,許可證號:SCXK(滬)2007-0005。動物置于實驗環境中飼養3 d,給予充足食物和水。實驗前將大鼠隨機分為4組:對照組、PSD模型組、中藥高劑量組、中藥低劑量組,每組5只。
1.2 主要藥品與試劑 RNAprep pure動物組織總RNA提取試劑盒、cDNA合成試劑盒(北京天根生化科技有限公司);SYBR Premix Ex Taq(大連TaKaRa公司);細胞裂解液、PMSF(碧云天生物技術有限公司);蛋白 Marker(美國 Thermo 公司);一抗:CREB及 p-CREB(美國 Cell Signaling Technology公司);GAPDH(美國 Cell Signaling Technology公司);二抗:辣根過氧化物酶標記二抗(美國 SAB公司);顯影液(美國Thermo公司);引物(上海捷瑞生物工程有限公司)。中藥松郁安神方由福建省中醫藥研究院提供。
1.3 主要儀器 睡眠剝奪裝置(中國醫學科學院藥物研究所);微量紫外分光光度計(美國Thermo公司);7 500 fast型熒光定量PCR儀(美國ABI公司);蛋白電泳和電轉儀(美國Bio-Rad公司);Alpha多色熒光、化學發光凝膠成像系統(美國ProteinSimple公司)。
2 方 法
2.1 PSD模型建立 采用改良多平臺睡眠剝奪法建立模型[3]。每次取8只大鼠放入睡眠剝奪裝置內,內有9個小平臺,平臺直徑6.5 cm,平臺周圍注滿水,平臺高出水面約1.0 cm。當大鼠進入異相睡眠時,由于全身肌肉張力降低,出現垂頭觸水而覺醒,使動物不能進入異相睡眠,連續睡眠剝奪96 h。對照組采用與睡眠剝奪組一樣的裝置,只是把大鼠放在直徑為12.0 cm的大平臺上,在大平臺上的動物能夠進入異相睡眠,使其所處環境與其它組完全一致。2.2 給藥方法 睡眠剝奪第1天開始進行灌胃給藥。松郁安神方由甘松10 g,郁金15 g,玫瑰花10 g,丹參 15 g,酸棗仁 15 g,首烏藤 30 g,珍珠母30 g,生龍骨30 g,合歡皮 15 g組成,藥材加 10倍量的水浸泡30 min,珍珠母和生龍骨先煎30 min后,加入其余中藥,先武火煮沸,再文火煮30 min,過濾,殘渣加水煎煮,重復2遍,合并濾液,濃縮至所需濃度。中藥高劑量組、中藥低劑量組分別按34 g/kg、17 g/kg體質量灌胃給藥,對照組和PSD模型組均給予等體積蒸餾水,每天1次,共7 d。于第7天灌胃2 h后取材,在冰面上迅速分離海馬組織,-80℃冰箱保存。
2.3 實時熒光定量PCR檢測 總RNA提取參照試劑盒說明書進行。提取的總RNA純度及完整性檢測后,選用天根Quant cDNA第一鏈合成試劑盒合成cDNA。在進行RT-PCR實驗前,用普通PCR檢驗引物的特異性,PCR擴增產物用1.7%瓊脂糖凝膠電泳檢測。PCR反應體系為:SYBR Premix Ex Taq(2×) 10 μL,50×ROX Reference DyeⅡ 0.4 μL,上下 游 引 物分別 為 1 μL,cDNA 模 板 7.5 μL,加DEPC水補至20 μL。PCR的反應條件為:95℃預變性 30 s,95℃變性 3 s,60℃延伸 30 s,40 個循環。
2.4 蛋白印跡法檢測 取海馬研磨,使組織細碎,加入裂解液,置于冰上裂解,勻漿液離心,采用微量紫外分光光度計測定組織總蛋白含量。總蛋白按1∶1加入2×上樣緩沖液,混勻,變性處理后進行蛋白印跡法檢測,其步驟大致如下:經過灌膠、加樣、電泳、轉膜后,將膜放入5%脫脂奶粉封閉液置室溫搖床上封閉 2 h,加一抗(CREB,兔抗,1∶500;p-CREB,兔抗,1∶500;GAPDH,兔抗,1∶1 000)于 4℃孵育過夜。然后加入辣根過氧化物酶標記(HRP)的二抗(羊抗兔 1∶5 000),二抗室溫搖床上孵育 1 h,最后將膜正面朝上放置在顯影板上,曝光顯影。用AlphaView SA軟件分析光密度,根據光密度對蛋白條帶進行分析,以GAPDH作為內參,計算目的蛋白與內參光密度比值。將對照組的光密度比值設定為1,其余各組與對照組的比值作為最后結果進行統計。
2.5 統計學方法 采用SPSS 18.0軟件進行數據分析。計量資料屬正態分布以(x±s)表示,采用單因素方差分析。
3 結果
3.1 松郁安神方對PSD大鼠海馬CREB mRNA表達的影響 實時熒光定量PCR結果顯示:連續睡眠剝奪96 h后,大鼠海馬CREB mRNA表達明顯降低,相對表達量為(0.63±0.10),與對照組比較有統計學意義(P<0.01);不同劑量松郁安神方干預后CREB mRNA表達明顯升高,并呈明顯的劑量效應,中藥高劑量組相對表達量為(0.86±0.09),與模型組比較有統計意義(P<0.01),中藥低劑量組相對表達量為(0.75±0.08),差異也有統計學意義(P<0.05)。 見圖 1。3.2 松郁安神方對PSD大鼠海馬CREB蛋白表達的影響 蛋白印跡法結果顯示:連續睡眠剝奪96 h后,大鼠海馬磷酸化CREB(p-CREB)蛋白表達降低,相對表達量為(0.63±0.03),與對照組比較,有統計學意義(P<0.01);中藥高、低劑量組干預后p-CREB表達明顯升高,中藥高劑量組相對表達量為(0.91±0.03),中藥低劑量組相對表達量為(0.78±0.09),與模型組比較,均有統計學意義(P<0.01)。見圖2。
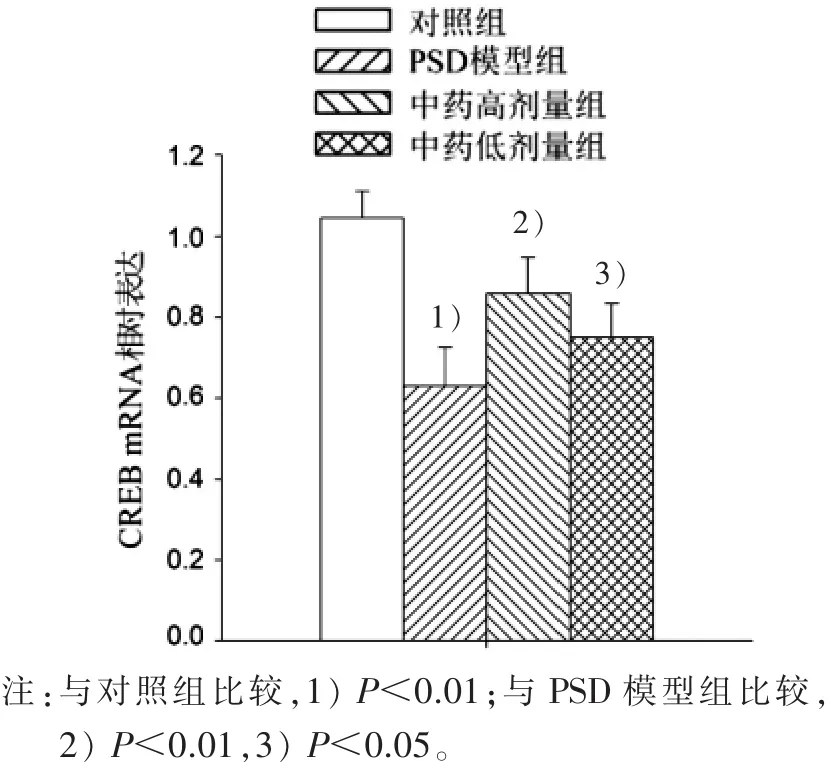
圖1 4組PSD大鼠海馬CREB mRNA表達量比較
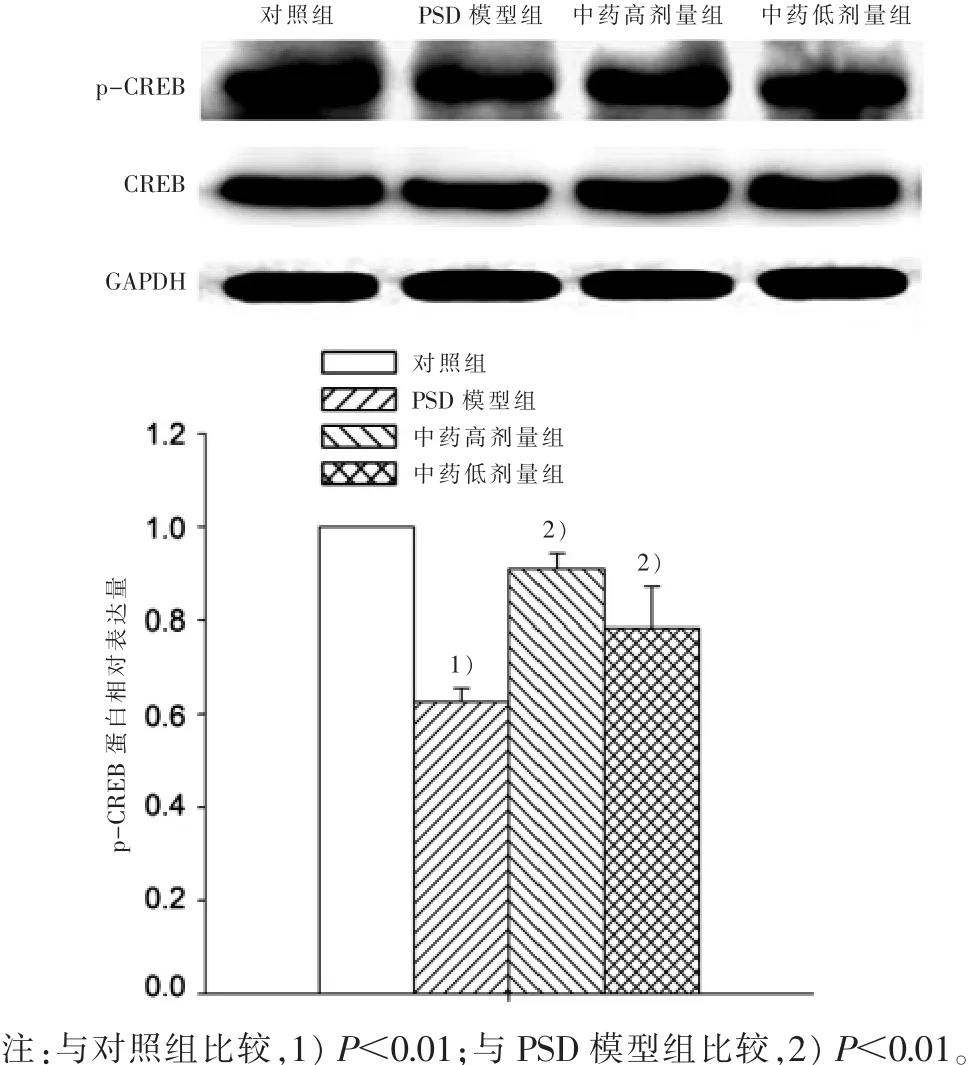
圖2 4組PSD大鼠海馬p-CREB蛋白表達量比較
4 討 論
在異相睡眠期,除眼肌和中耳肌外,其它肌肉尤其是頸后肌和四肢肌肉的張力極度下降,不能維持某種姿勢[3],改良多平臺睡眠剝奪法是根據這一原理設計。此外,為了避免水環境對動物造成一定的應激反應,本實驗采用大平臺進行對照。大平臺的直徑允許大鼠進入異相睡眠,其他環境均與小平臺相同。目前該方法是研究睡眠剝奪較常用且成熟的動物模型建立方案。
學習記憶與睡眠是相互影響的過程,學習記憶能影響睡眠的結構和時間,睡眠也可對覺醒時所獲信息進行加工、整理并鞏固成長時記憶,其中,異相睡眠與學習記憶關系較大。有研究報道:異相睡眠剝奪對大鼠的學習記憶能力存在一定的損害,其學習和記憶的獲得與鞏固過程下降[4];異相期睡眠剝奪可引起大鼠空間參考記憶能力低下[5]。
CREB是一種關鍵的核轉錄因子,在各系統中均發揮著重要的作用,能調節神經可塑性相關基因的表達[6]。很多與睡眠相關的神經遞質和調質可影響腦內cAMP的含量[7]。當神經遞質與細胞膜上的特異受體結合后,激活腺苷酸環化酶,水解生成第二信使cAMP,cAMP進一步激活蛋白激酶A(protein kinase A,PKA),即激活cAMP-PKA信號通路,CREB在神經系統中通常作為許多信號通路的終止與交匯點,其調控的上下游信號分子及其靶基因和CREB一起參與了神經細胞存活、再生、分化等過程,與突觸的可塑性和學習記憶等正常生理活動密切相關[6,8]。 研究表明:睡眠剝奪阻礙海馬 cAMPPKA信號通路,可擾亂認知過程[9]。對嚙齒動物的研究也表明:REM睡眠剝奪能降低海馬磷酸化CREB (P-CREB)水平[10]。可見海馬中磷酸化 CREB水平與學習記憶關系密切。
松郁安神方既能改善大鼠REM睡眠剝奪大鼠的學習記憶能力[2],又能夠鎮靜安神,增加睡眠時間和深度,從而改善記憶。本實驗結果顯示:REM睡眠剝奪96 h后,大鼠海馬CREB mRNA及磷酸化CREB蛋白表達均降低,這與之前的研究報道一致。松郁安神方干預后,能明顯升高海馬CREB mRNA及磷酸化CREB蛋白表達,提示松郁安神方改善大鼠學習記憶能力可能通過調節CREB而發揮作用。但該方是否進一步調控CREB相關的信號通路,還有待于進一步的研究。
參考文獻:
[1] 尹貞云,趙忠新.鎮靜催眠作用藥物對失眠患者睡眠結構的影響[J].中華神經科雜志,2010,43(1):69-71.
[2] 曾雪愛,黃俊山,王雅麗.松郁安神方對REM睡眠剝奪大鼠認知功能及神經遞質的影響[J].中國中醫基礎醫學雜志,2012,18(4):392-393,397.
[3] 黃建歐,趙忠新.大鼠睡眠剝奪方法的研究進展[J].中華神經醫學雜志,2004,3(3):229-230.
[4] 葉晨靜,趙忠新.快速眼球運動睡眠剝奪對大鼠學習、記憶能力及其海馬組織腦源性神經營養因子表達的影響[J].第二軍醫大學學報,2007,28(1):82-86.
[5] 張微勝,侯一平,王德貴,等.異相睡眠剝奪對大鼠空間學習記憶的影響[J].中國行為醫學科學.2004,13(5):496-498.
[6] HEYWARD P.Presenilin dysfunction leads to memory and plasticit defects [J].Lancet Neurol,2004,3(6):327.
[7] 朱國慶,張惠秀,王敏,等.中樞應用外源性cAMP和ATP對大鼠睡眠的影響[J]. 中國應用生理學雜志,1993,9(2):189-190.
[8] LONZE B E,GINTY D D.Function and regulation of CREB family transcription factors in the nervous system [J].Neuron,2002,35(4):605-623.
[9] LUO J,PHAN T X,YANG Y,et al.Increases in cAMP,MAPK activity,and CREB phosphorylation during REM sleep:implications for REM sleep and memory consolidation [J].J Neurosci,2013,33(15):6460-6468.
[10] ALHAIDER I A,ALEISA A M,TRAN T T,et al.Sleep deprivation prevents stimulation-induced increases of levels of P-CREB and BDNF:protection by caffeine [J].Molecular and Cellular Neuroscience,2011,46(4):742-751.

