維生素D在豚鼠結核感染中的輔助治療作用評價
冉飛勇 付雷 王彬 郭少晨 陸宇 陳效友
結核病是全世界的第九大死因,在傳染性疾病中排名第一。根據WHO 2017年報告,2016年全球范圍內估計有1040萬例結核病新發患者,死亡約170萬例;我國結核病新發患者89.5萬例,死亡6.8萬例,結核病在全球及我國疫情形勢依然嚴峻[1]。
結核病化學治療面臨著療程長,不良反應多,患者依從性差,導致諸多患者,尤其是復治和耐藥結核病患者療效不確切。由于抗結核新藥開發困難,近40年來僅有貝達喹啉和德拉馬尼兩種新藥上市[2-5],耐藥結核病患者的化學治療受到嚴峻挑戰。因而,開發一些輔助結核病治療措施,在提高療效、縮短痰菌陰轉時間及(或)縮短療程方面顯得尤為急切。維生素D是結核病免疫輔助治療的代表藥物之一,在抗生素出現之前,高劑量的維生素D被用來治療肺結核并取得了較好的效果[6]。然而,維生素D輔助治療結核病的療效報道結果不盡一致[7-11]。為此,筆者建立豚鼠結核病動物模型,評價每日給予常規劑量維生素D和單次高劑量維生素D隔周給藥兩種方式輔助治療豚鼠結核病的效果,探討維生素D在結核病治療中的價值。
材料和方法
一、材料
1.菌株:結核分枝桿菌標準株(H37Rv, ATCC27294)為首都醫科大學附屬北京胸科醫院耐藥結核病研究北京市重點實驗室保存。
2.實驗動物:無特定病原體(specific pathogen free,SPF)級4~6周齡豚鼠(Hartley品系)56只,雌雄各半,體質量為300~350 g,由北京維通利華實驗動物技術有限公司提供;實驗動物使用許可證號:SCXK(京)20160011。飼養條件:室溫為(21±2) ℃,濕度為(55±15) %,可自由進食水的負壓感染動物房。本研究經首都醫科大學附屬北京胸科醫院動物倫理委員會批準。
3.實驗藥物:實驗級維生素D3原(批號G131861),購于德國Dr.Ehrenstorfer 有限責任公司;異煙肼標準品(批號MKBZ8025V)、利福平標準品(批號WXBC3355V)均購于美國Sigma公司。
4.試劑:1×PBS(磷酸鹽緩沖液),Tween80(批號2016-06-01)購于無錫市亞泰聯合化工有限公司;實驗級花生油(批號1F6E770),購于瑞典化學(上海)技術有限公司; OADC(oleic acid-albumin-dextrose-catalase; 油酸-白蛋白-右旋糖-過氧化氫酶)增菌液(批號7082603),購于美國BD公司。
5.儀器:氣溶膠感染裝置(型號:099CA4224),購于美國Glas-Col公司;霧化器、勻漿機(型號:PRO200)均購于美國PRO Scientific公司;二氧化碳培養箱(型號MU5810E),購于美國MUAIRE公司;酶標儀(型號:BioTek Synergy2),購于美國BioTek儀器有限公司。
二、方法
1.感染用菌液的制備:用1×PBS+0.04%Tween 80稀釋H37Rv標準株凍存液(濃度為4×108CFU/ml)至感染濃度5×105CFU/ml,終體積為40 ml。取0.1 ml稀釋的菌懸液接種于7H11培養基上,在37 ℃的CO2培養箱中孵育3周,觀察結核分枝桿菌菌落生長情況,計算活菌數及其對數值(lgCFU)。
2.建立豚鼠慢性結核病模型:按照氣溶膠感染裝置操作程序,雌雄各28只豚鼠分批進行。將待感染豚鼠放入感染裝置,關閉腔室,吸取10 ml菌懸液(5×105CFU/ml)加入霧化器,按照預熱15 min、霧化30 min、煙霧衰減30 min、凈化15 min等步驟進行霧化感染和殺菌消毒。感染后豚鼠分籠飼養于負壓感染動物房內,感染10 d后隨機抓取4只(雌雄各半)用于驗證感染是否成功,感染28 d隨機抓取4只(雌雄各半)作為實驗基線。
3.實驗分組及給藥方式:將氣溶膠方式感染后的48只豚鼠隨機分為6組,分別是空白對照組,每日常規劑量維生素D組(VD組),單次高劑量維生素D隔周給藥組(VDH組),異煙肼-利福平化療組(H-R組),異煙肼-利福平化療聯合每日常規劑量維生素D給藥組(H-R+VD組),異煙肼-利福平化療聯合單次高劑量維生素D隔周給藥組(H-R+VDH組),每組8只,雌雄各半;均灌胃給藥,采用1.6 mm×80 mm彎頭灌胃針進行灌胃給藥,每天記錄有無不良反應發生。
4.給藥劑量和頻次:依據文獻[7,12],本研究設定了2種補充維生素D的方式:每日常規劑量(10 000 IU, 1次/d)和單次高劑量(100 000 IU,隔周1次)。根據人體和豚鼠等效劑量公式換算為豚鼠給藥劑量,按照每日常規劑量(775 IU/kg,1次/d)和單次高劑量(7750 IU/kg,隔周1次)2種方式給藥。由于豚鼠生長快,需每周稱取豚鼠體質量,計算給藥量,配制藥物。異煙肼和利福平分別用0.5%羧甲基纖維素鈉溶液制成混懸液,給藥終體積為0.1 ml;維生素D3原溶于實驗級花生油,給藥終體積為0.1 ml。采用溶劑對照方法設置分組和給藥,見表1。
5.觀察豚鼠生長情況:給藥同時觀察豚鼠生長情況,每周稱取豚鼠體質量。
6.豚鼠解剖和臟器稱質量:給藥4周和8周后每組取4只豚鼠(雌雄各半),稱取豚鼠體質量,采用空氣栓塞法處死豚鼠并解剖,留取肺臟和脾臟標本,觀察臟器病變并稱質量。
7.活菌計數:每只豚鼠1/2(左半)肺臟加入含10 ml生理鹽水的勻漿管中,用勻漿機(10 000 r/min)勻漿,取1/2(左半)脾臟加入含5 ml生理鹽水的勻漿管中,用勻漿機勻漿(10 000 r/min)。根據病變程度接種不同的稀釋度,10倍系列4個梯度稀釋,每個稀釋度取0.1 ml接種于7H11培養基,37 ℃恒溫箱培養,3 周后進行菌落計數,并計算每只豚鼠肺臟和脾臟的活菌數,以對數形式表示。
8.組織病理學檢查:取實驗中各組豚鼠1/2(右半)肺臟、脾臟固定于10%福爾馬林水溶液中,石蠟包埋切片,蘇木精/伊紅染色后,高倍鏡下觀察各組織的病理改變。根據結核特異性改變從病變范圍、原發損傷、繼發損傷、壞死等4個角度對每個脾臟和肺臟病理切片進行評分,評分標準如下:(1)病變范圍評分:未見病變計0分,病變范圍≤25%計1分,25%<病變范圍≤50%計2分, 50%<病變范圍≤75%計3分,病變范圍>75%計4分。(2)原發損傷:未見原發病灶計0分,單個原發病灶計1分,2個或以上計2分,多個并有融合計3分,多個廣泛融合計4分。(3)繼發性損傷:未見繼發性損傷計0分,繼發性損傷范圍≤25%計1分,25%<繼發性損傷范圍≤50%計2分,50%<繼發性損傷范圍≤75%計3分,繼發性損傷范圍>75%計4分。(4)壞死:未見壞死計0分, 極輕微壞死計1分,輕微壞死計2分,中度壞死計3分,顯著壞死計4分,重度壞死計5分。
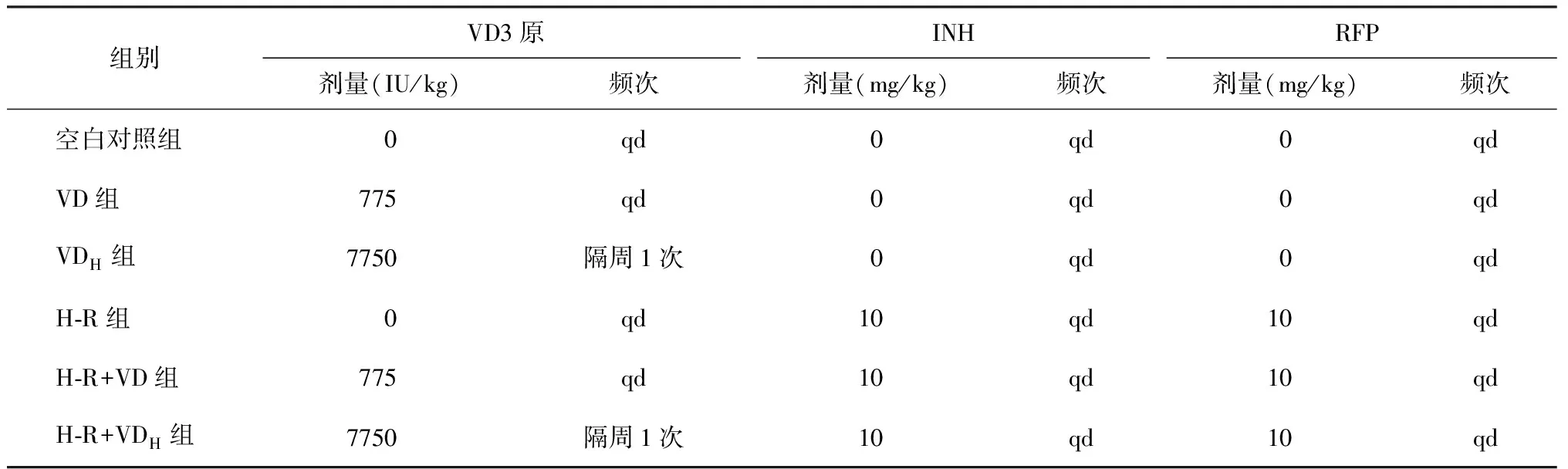
表1 不同組別結核感染豚鼠的給藥劑量與頻次
注VD組:給常規劑量維生素D3原;VDH組:給高劑量維生素D3原組;INH:異煙肼;RFP:利福平;H-R:INH+RFP;0表示不加對應的藥物,僅給予配制該藥物的溶劑;qd:1次/d
結 果
一、豚鼠一般情況
實驗期間(包括感染和給藥期間)豚鼠未出現死亡。感染前豚鼠平均體質量(310.01±13.74)g,開始灌胃前(計為0周)平均體質量達到(491.16±35.94)g,開始給藥后豚鼠體質量穩步增長,每周體質量增加(30.87±7.90)g,給藥4周和8周時豚鼠體質量情況見表2。比較8周各組體質量增長量,VDH組增長最快,平均增長體質量275.63 g;而H-R 組增長最慢,平均增長體質量155.66 g,可見單次高劑量維生素D隔周給藥有利于豚鼠體質量增長。
二、活菌計數情況
1. 氣溶膠感染及活菌計數:豚鼠分2次(雌性和雄性)完成氣溶膠感染,分別對2次感染菌液進行活菌計數,取對數值為5.65 CFU/ml和5.55 CFU/ml,提示雌性和雄雌動物2次感染菌量一致。
2.感染10 d后活菌計數:感染10 d后隨機取4只豚鼠(雌雄各半)解剖,對肺臟和脾臟進行活菌計數,肺臟活菌計數均值為(4.56±0.07) lgCFU,感染模型建立成功。脾臟活菌計數未見生長。
3.感染28 d后活菌計數:感染28 d后隨機取4只豚鼠(雌雄各半)解剖,對肺臟和脾臟進行活菌計數作為治療前基線,肺臟活菌計數均值為(5.40±0.21) lgCFU,脾臟活菌計數均值為(4.90±0.07) lgCFU。
4.給藥4周和8周豚鼠肺臟和脾臟活菌計數:單獨維生素D治療,VD組與VDH組給藥4周和8周后均未見MTB菌落數下降。治療4周H-R組肺臟和脾臟活菌計數分別為(4.98±0.26) lgCFU和(4.02±0.03) lgCFU, H-R+VDH組肺臟和脾臟活菌計數分別為(4.39±0.11) lgCFU和(2.30±0.43) lgCFU;H-R+VDH組較H-R組肺臟和脾臟活菌計數分別下降了0.59 lgCFU和1.72 lgCFU;治療8周后H-R組肺臟和脾臟活菌計數分別為(3.73±0.23) lgCFU和(2.26±0.24) lgCFU; H-R+VDH組肺臟活菌計數為(3.21±0.23) lgCFU,脾臟達到無菌化;H-R+VDH組較H-R組肺臟和脾臟活菌計數分別下降了0.52 lgCFU和2.26 lgCFU。治療4周后H-R+VD組脾臟活菌計數為(2.36±0.10) lgCFU, H-R+VD組較H-R組脾臟活菌計數下降了1.66 lgCFU(表3)。
三、病理結果
1.肉眼觀察:解剖豚鼠可見肺臟局部腫脹和攣縮變形,表面可見大小不等的結節樣原發病灶,直徑約0.1~0.4 cm,呈灰黃色。脾臟病變可見不同,治療4周時空白對照組(圖1)豚鼠脾臟明顯腫大,表面凹凸不平,可見布滿大小不等的結節;VD組和VDH組均未觀察到病變減輕,脾臟外觀與空白對照相近;H-R組(圖2)可見脾臟水腫及少量結節樣改變;H-R+VD組(圖3)、H-R+VDH組(圖4)則能看到病變明顯減輕,脾臟變小變薄,表面光滑,結節樣病變消失,接近正常豚鼠脾臟外觀。治療8周時,空白對照組、VD組、VDH組脾臟與圖1相似;H-R組、H-R+VD組、H-R+VDH組脾臟均與圖3和圖4相似。
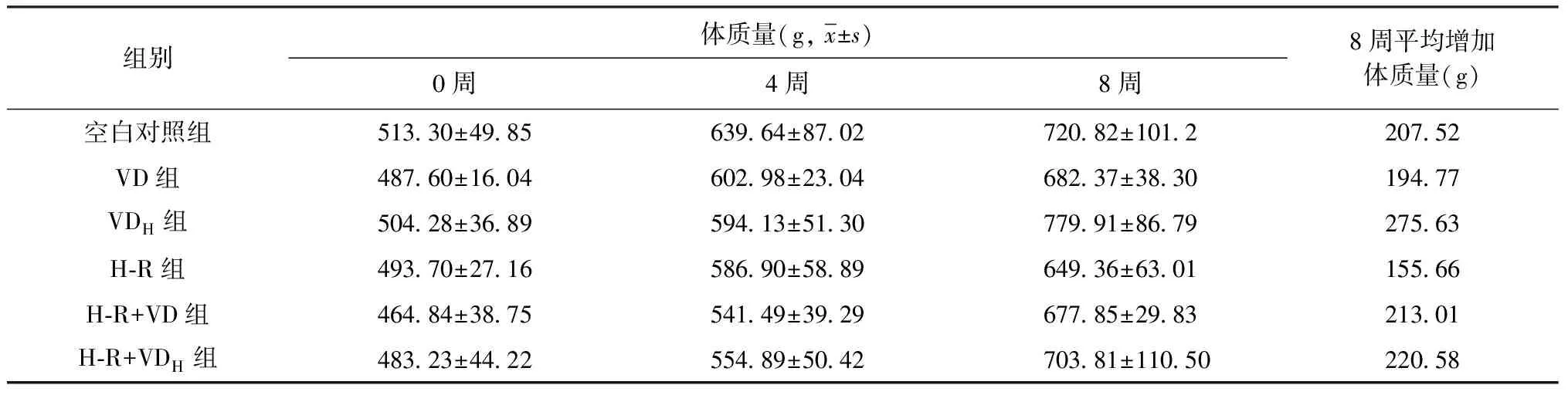
表2 不同組別結核感染豚鼠給藥0、 4和8周后的體質量
注VD:給常規劑量維生素D3原;VDH:給高劑量維生素D3原;INH:異煙肼;RFP:利福平
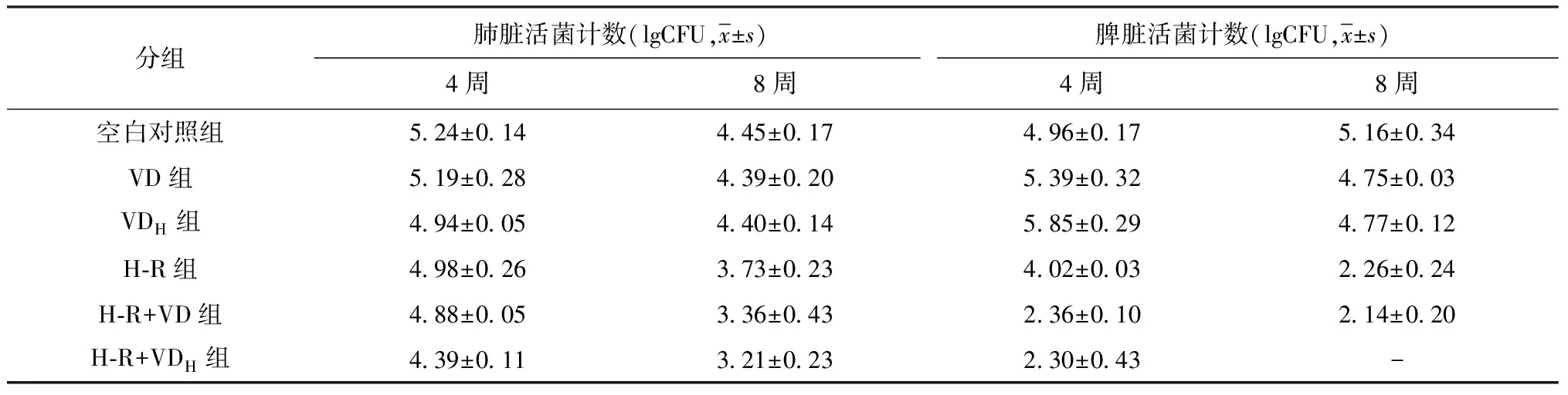
表3 不同組別結核感染豚鼠給藥4周和8周后的肺臟和脾臟活菌計數情況
注“-”表示H-R+VDH治療組給藥8周后脾臟未見菌落生長,無法取對數值,比較該組與其他各組的差值時,以活菌計數差值的對數表示
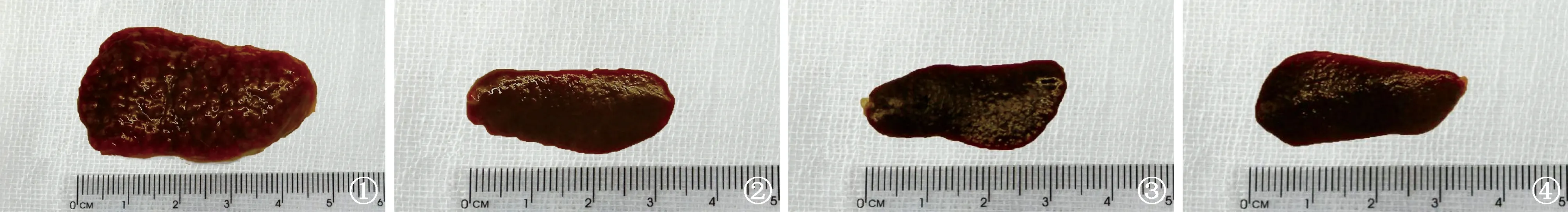
圖1~4 治療4周后空白對照組(圖1)、H-R組(圖2)、H-R+VD組(圖3)、H-R+VDH組(圖4)的脾臟外觀
2.組織病理學:在光學顯微鏡下觀察各組肺臟和脾臟的病理切片并評分。對每組評分進行匯總后可見:與空白對照組比較,VD組和VDH組均未見病變減輕;而H-R+VDH組治療4周后脾臟病理評分低于其他各組(表4),治療8周后肺臟病理評分低于其他各組(表5)。
高倍鏡下觀察:治療4 周時空白對照組肺臟病變范圍大,肉芽腫內有大量壞死和鈣化灶,肺泡細胞被上皮樣細胞和淋巴細胞取代(圖5);脾臟病變范圍大,組織結構被肉芽腫病變破壞,視野內布滿上皮樣細胞和淋巴細胞,并可見少量壞死和鈣鹽沉積(圖6)。H-R+VD 組治療8 周后肺臟未見肉芽腫及壞死,接近正常肺組織形態(圖7)。H-R+VDH組治療4周后脾臟也接近正常脾組織形態(圖8)。
表4 不同組別結核感染豚鼠給藥4周后的脾臟病理學評分

表5 不同組別結核感染豚鼠給藥8周后的肺臟病理學評分
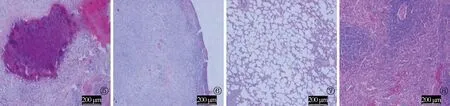
圖5~8 分別為高倍鏡下空白對照組治療4周后的肺臟標本病理切片(圖5)和脾臟標本病理切片(圖6),H-R+VD組治療8周后的肺臟標本病理切片(圖7),H-R+VDH組治療4周后的脾臟標本病理切片(圖8)
討 論
結核病仍然是危害人類健康的重要傳染性疾病,耐藥結核病形勢嚴峻。化學治療是結核病防治的主要手段,目前抗結核藥物治療存在周期長、依從性差,以及二線治療藥物不良反應多、治愈率低等問題。在抗結核新藥研發周期長、進展緩慢的情況下,開發化學輔助藥物以減輕患者癥狀,提高患者耐受性,增加療效是積極有益的嘗試。研究較多的輔助藥物主要有疫苗類藥物、細胞因子、抗體、免疫調節劑等,這些藥物大多給藥劑量和給藥時間不統一、療效評價指標過于單一、治療費用高,尚缺乏嚴格的多中心隨機對照試驗支持等問題。
維生素D是人體必需的脂溶性維生素,它的主要生理作用是通過其活性代謝產物調節鈣磷和骨代謝,隨著研究的深入,維生素D更廣泛的生理作用不斷被發現。文獻報道了維生素D缺乏與多種疾病有關,包括結核病、多發性硬化[13]、糖尿病[14]、癌癥[15]等。近年來,許多基礎研究報道了維生素D在結核病中的作用:體外實驗證實維生素D活性形式1,25(OH)2D3能刺激單核細胞向巨噬細胞的分化,并促進巨噬細胞的成熟,增強其殺菌能力[16-18];維生素D還能促進巨噬細胞抗菌肽的表達[19],并增強其殺滅MTB活性的作用;也有研究發現,維生素D能夠調節T淋巴細胞的增殖,介導免疫耐受[20-21];在C3HeB/FeJ品系小鼠的結核病模型中證實,維生素D在結核病后期能抑制免疫損傷[22]。臨床研究中也發現,維生素D缺乏能增加糖尿病患者罹患結核病的風險[23],多項Meta分析數據均顯示維生素D受體基因多態性也與結核病發病相關[24-25]。然而,臨床多中心隨機對照試驗未發現補充維生素D能加快痰菌陰轉的陽性結果[7];Cegielski and Vernon在關于這篇報道的評論中指出:以痰菌陰轉作為評價維生素D的療效指標不是很理想,它的作用體現在減輕炎癥反應、限制組織損傷、防止復發等[26]。據此本研究擬應用豚鼠動物模型從體質量變化、病理改變、MTB負荷等角度評價維生素D在結核病中的輔助治療作用。豚鼠對MTB高度敏感,低劑量MTB就能使豚鼠發展成與人類相似的結構典型的肉芽腫,可發展為壞死,且肉芽腫內含菌量低,與人體感染MTB一樣可造成相似的病理損傷;豚鼠模型存活率高。感染初期表現為CD4為主的強烈的細胞反應,而在感染30 d后表現為B細胞和粒細胞穩定增加[27],提示豚鼠建立了穩定的免疫反應,此時與人體感染MTB時的免疫狀態相一致。本研究模擬人體感染與發病的方式:以氣溶膠方式感染豚鼠,在感染4周后建立豚鼠慢性結核病模型,開始藥物干預性試驗。
本研究中將異煙肼和利福平的劑量設定為10 mg/kg,依據文獻[12],在陽光充足的條件下,人體每天合成的維生素D可達到10 000~25 000 IU,而每天補充10 000~50 000 IU維生素D是安全的;另根據Daley等[7]研究中高劑量維生素D給藥方式為100 000 IU,隔周1次,據此本研究設定了2種補充維生素D的方式:每日常規劑量(10 000 IU,1次/d)和單次高劑量(100 000 IU,隔周1次)。在豚鼠慢性結核病模型中分4周和8周2個時間點評價了維生素D的輔助治療作用。筆者觀察到單獨補充維生素D未減輕豚鼠的MTB負荷,也未減輕病理損傷,而異煙肼-利福平化療輔以單次高劑量維生素D隔周給藥,治療4周后肺臟和脾臟活菌計數較單純化療分別下降了0.59和1.72 lgCFU,治療8周后肺臟和脾臟活菌計數較H-R組分別下降了0.52和2.26 lgCFU;異煙肼-利福平化療輔以每日常規劑量維生素D治療4周后脾臟活菌計數較單純化療組下降了1.66 lgCFU;在輔以單次高劑量維生素D隔周給藥4周后脾臟病理改變輕于單獨化療組,治療8周后肺臟病理改變輕于單獨化療組,顯示維生素D在豚鼠結核病中具有一定的輔助治療作用,預示臨床應用可能在改變患者癥狀上有一定的作用和價值。
本研究存在以下不足:豚鼠體型較大、生長快,且個體間差異明顯,體質量和臟器質量也表現出較大差異,需要增大實驗動物數量才能得出更有力的結論;未能測定豚鼠血漿維生素D濃度是本研究的不足;本研究僅選取了2種補充維生素D的方式進行試驗,并未對維生素D的補充劑量進行探討,此外有研究報道了補充高劑量維生素D(60 000 IU,每周1次或600 000 IU單次給藥)的5例肉芽腫性疾病患者均發生了高鈣血癥,其中有2例患者為結核病[28],故維生素D最佳的補充劑量仍需進一步研究探討。最后,維生素D如何在豚鼠結核病模型中發揮免疫調節作用的機制仍存在爭議,有研究發現維生素D并非抑制Th1細胞分化而起免疫抑制作用[29],探索維生素D的免疫調節作用需要進行更深入的研究。
本研究是對豚鼠結核病模型中維生素D具有一定的輔助治療作用的首次報道,給維生素D在臨床的應用帶來新的希望。有必要對維生素D開展進一步研究,以發現和揭示其保護作用機制,為在結核病治療中的應用提供充分依據。
[1] World Health Organization. Global tuberculosis report 2017.Geneva: World Health Organization,2017.
[2] World Health Organization. The use of bedaquiline in the treatment of multidrug-resistant tuberculosis: interim policy guidance. Geneva:World Health Organization,2013.
[3] Fox GJ,Menzies D. A Review of the Evidence for Using Bedaquiline (TMC207)to Treat Multi—Drug Resistant Tuberculosis. Infect Dis Ther,2013,2(2):123-144.
[4] World Health Organization. Interim policy guidance for the use of delamanid in the treatment of MDR-TB. Geneva: World Health Organization,2014.
[5] Gler M,Skripconoka V,Sanche-Garavito E,et al. Delamanid for multidrug-resistant pulmonary tuberculosis. N Engl J Med,2012,366(23):2151-2160.
[6] Charpy J,Dowling GB. Vitamin D in cutaneous tuberculosis. Lancet,1947,2(6472):398.
[7] Daley P,Jagannathan V,John KR,et al. Adjunctive vitamin D for treatment of active tuberculosis in India:a randomised,double-blind,placebo-controlled trial. Lancet Infect Dis,2015,15(5):528-534.
[8] Tukvadze N,Sanikidze E,Kipiani M,et al. High-dose vitamin D3 in adults with pulmonary tuberculosis:a double-blind randomized controlled trial. Am J Clin Nutr,2015,102(5):1059-1069.
[9] Ralph AP,Waramori G,Pontororing GJ,et al. L-arginine and Vitamin D Adjunctive Therapies in Pulmonary Tuberculosis:A Randomised,Double-Blind,Placebo-Controlled Trial. PLoS One,2013,8(8):e70032.
[10] Salahuddin N,Ali F,Hasan Z,et al. Vitamin D accelerates clinical recovery from tuberculosis: results of the SUCCINCT Study [Supplementary Cholecalciferol in recovery from tuberculosis]. A randomized,placebo-controlled,clinical trial of vitamin D supplementation in patients with pulmonary tuberculosis. BMC Infect Dis,2013,13:22.
[11] Mily A,Rekha RS,Kamal SMM,et al. Significant Effects of Oral Phenylbutyrate and Vitamin D3 Adjunctive Therapy in Pulmonary Tuberculosis:A Randomized Controlled Trial. PLoS One,2015,10(9):e0138340.
[12] McCullough PJ,Lehrer DS. Vitamin D,cod liver oil,sunshine, and phototherapy:Safe,effective and forgotten tools for treating and curing tuberculosis infections-A comprehensive review. J Steroid Biochem Mol Biol,2017,177:21-29.
[13] Pierrot-Deseilligny C,Souberbielle JC. Vitamin D and multiple sclerosis:An update. Mult Scler Relat Disord,2017,14:35-45.
[14] Luong KV,Nguyen LT,Nguyen DN. The role of vitamin D in protecting type 1 diabetes mellitus. Diabetes Metab Res Rev,2005,21(4):338-346.
[15] Tagliabue E,Raimondi S,Gandini S. Vitamin D,Cancer Risk,and Mortality. Adv Food Nutr Res,2015,75:1-52.
[16] Abe E,Miyaura C,Sakaqami H,et al. Differentiation of mouse myeloid leukemia cells induced by 1 alpha,25-dihydroxyvitamin D3. Proc Natl Acad Sci USA,1981,78(8):4990-4994.
[17] Abe E,Miyaura C,Tanaka H,et al. 1 alpha,25-dihydroxyvitamin D3 promotes fusion of mouse alveolar macrophages both by a direct mechanism and by a spleen cell-mediated indirect mechanism. Proc Natl Acad Sci USA,1983,80(18):5583-5587.
[18] Koeffler HP,Amatruda T,Ikekawa N,et al. Induction of macrophage differentiation of human normal and leukemic myeloid stem cells by 1,25 dihydroxyvitamin D3 and its fluorinated analogues. Cancer Res,1984,44(12 Pt1):5624-5628.
[19] Chesdachai S, Zughaier SM,Hao L,et al. The effects of first-line anti-tuberculosis drugs on the actions of vitamin D in human macrophages. J Clin Transl Endocrinol,2016,6:23-29.
[20] Reich KM,Fedorak RN,Madsen K,et al. Vitamin D improves inflammatory bowel disease outcomes:Basic science and clinical review. World J Gastroenterol,2014,20(17):4934-4947.
[21] Cantorna MT,Snyder L,Lin YD, et al. Vitamin D and 1,25(OH)2D Regulation of T cells. Nutrients,2015,7(4):3011-3021.
[22] Reeme AE,Robinson RT. Dietary Vitamin D3 Suppresses Pulmonary Immunopathology Associated with Late-Stage Tuberculosis in C3HeB/FeJ Mice. J Immunol,2016,196(3):1293-1304.
[23] Zhao X,Yuan Y,Lin Y, et al. Vitamin D status in tuberculosis patients with diabetes,prediabetes and normal blood glucose in China:a cross-sectional study. BMJ Open,2017,7(9):e017557.
[24] Huang L,Liu C,Liao G, et al. Vitamin D Receptor Gene FokI Polymorphism Contributes to Increasing the Risk of Tuberculosis:An Update Meta-Analysis. Medicine (Baltimore),2015,94(51):e2256.
[25] Lee YH,Song GG.Vitamin D receptor gene FokI,TaqI,BsmI,and ApaI polymorphisms and susceptibility to pulmonary tuberculosis:a meta-analysis. Genet Mol Res,2015,14(3):9118-9129.
[26] Cegielski P,Vernon A. Tuberculosis and vitamin D:what’s the rest of the story. Lancet Infect Dis,2015,15(5):489-490.
[27] Orme IM,Ordway DJ. Mouse and guinea pig models of tuberculosis. Microbiol Spectr,2016,4(4):1-2.
[28] Sarathi P,Karethimmaiah H,Goel A. High-dose Vitamin D Supplementation Precipitating Hypercalcemic Crisis in Granulomatous Disorders. Indian J Endocrinol Metab, 2017,21(6):815-819.
[29] Rode AKO,Kongsbak M, HansenMM,et al. Vitamin D CounteractsMycobacteriumtuberculosis-Induced Cathelicidin Downregulation in Dendritic Cells and Allows Th1 Differentiation and IFNγ Secretion. Front Immunol,2017,8: 656.

