抗菌肽SMAP-29在大腸桿菌中表達條件的優化及純化研究
吳三橋, 趙冠杰, 萬 健, 陳 琛
(陜西理工大學生物科學與工程學院/中德天然產物研究所,陜西漢中 723000)
近年來,抗生素的長期使用所帶來的負面效應已越來越引起全社會的高度關注,藥物殘留和細菌耐藥性等問題日漸嚴重,特別是2010年出現的“超級細菌”[1]事件再一次將濫用抗生素引發的日益嚴重的耐藥菌株等問題擺在了公眾面前,長期濫用抗生素所引起的食品安全、人類健康、環境污染等問題也受到了公眾的廣泛關注。因此,研制安全、高效、環保型抗生素替代品已迫在眉睫。
抗菌肽(antibacterial peptides)是生物體特定基因編碼產生的一類小分子多肽,具有抵抗外界微生物侵害的作用,是生物天然免疫系統中的一個重要組成部分,與傳統抗生素相比,抗菌肽具有熱穩定好、水溶性好、強堿性、廣譜抗菌和作用機制獨特等特點[2-3]。
抗菌肽SMAP-29(sheep myeloid antibacterial peptides-29)是1995年Bagella等從綿羊Cathelicidins前體蛋白的羧基端截取的29個氨基酸殘基序列,具有兩親性α-螺旋結構域,分子量約為3.2 ku,有很強的抗細菌、真菌、病毒等生物學功能[4-11]。抗菌肽SMAP-29天然含量非常低,化學合成成本較高,因此通過基因工程表達具有較好的前景。抗菌肽SMAP-29基因工程表達已有大量研究報道,但是未見采用小分子泛素樣修飾蛋白(small ubiquitin-related modifier,SUMO)融合表達報道。
本試驗以抗菌肽SMAP-29為研究對象,通過已構建的表達載體pSUMO-SMAP-29在大腸桿菌中誘導表達融合蛋白SUMO-SMAP-29,優化了融合蛋白SUMO-SMAP-29在大腸桿菌中的表達條件,并通過Ni柱親和層析純化了目的蛋白,旨在為其生物活性以及產業化開發奠定基礎。
1 材料與方法
1.1 菌株、試劑
含有pSUMO-SMAP-29表達質粒的EscherichiacoliBL21(DE3)菌種由筆者所在實驗室保存。
Protein Marker、IPTG、卡那霉素購自生工生物工程(上海)股份有限公司;Ni Sepharose柱購自美國GE Healthcare公司;其余試劑均為國產分析純。
1.2 融合蛋白SUMO-SMAP-29表達條件的優化
1.2.1 細菌培養 將含重組質粒pSUMO-SMAP-29的E.coliBL21菌種接種于LB(50 μg/mL卡那霉素)固體培養基,37 ℃過夜培養。挑取新鮮單克隆接種于5 mL LB(50 μg/mL卡那霉素)液體培養基中,37 ℃、200 r/min振蕩培養過夜。
1.2.2 不同濃度IPTG對目的蛋白表達量的影響 細菌培養方法同“1.2.1”節,然后按體積比1 ∶100的轉接量將過夜培養的菌液接種于50 mL新鮮LB(50 μg/mL卡那霉素)液體培養基中,37 ℃、200 r/min振蕩培養。當D600 nm約0.6時加IPTG至終濃度為0.25、0.50、1.00、2.00 mmol/L,在 37 ℃ 誘導1 h后各取樣1 mL進行SDS-PAGE電泳分析。通過Quantity One和SPSS軟件,分析融合蛋白SUMO-SMAP-29的相對表達量,以及IPTG濃度梯度各組之間是否有統計學差異。
1.2.3 不同誘導溫度對目的蛋白表達量的影響 細菌培養方法同“1.2.1”節,然后按體積比1 ∶100的轉接量將過夜培養的菌液接種于50 mL新鮮LB(50 μg/mL卡那霉素)液體培養基中,37 ℃、200 r/min振蕩培養。當D600 nm約0.6時加IPTG至終濃度為0.50 mmol/L,分別在25、30、37、42 ℃誘導,1 h 后各取樣1 mL,進行SDS-PAGE電泳分析。通過Quantity One和SPSS軟件分析融合蛋白SUMO-SMAP-29的相對表達量,以及誘導溫度梯度各組之間是否有統計學差異。
1.2.4 不同誘導時間對目的蛋白表達量的影響 細菌培養方法同“1.2.1”節,然后按體積比1 ∶100的轉接量將過夜培養的菌液接種于50 mL新鮮LB(50 μg/mL卡那霉素)液體培養基中,37 ℃、200 r/min振蕩培養。在培養至D600 nm約0.6時,加0.50 mmol/L IPTG,在30 ℃條件下誘導,分別于0、1、3、5、7 h取樣1 mL,進行SDS-PAGE電泳分析。通過Quantity One和SPSS軟件分析融合蛋白SUMO-SMAP-29的相對表達量,以及誘導時間梯度各組之間是否有統計學差異。
1.3 融合蛋白SUMO-SMAP-29的分離純化
取誘導表達后的菌液離心收集菌體,用Binding Buffer(20 mmol/L Tris,500 mmol/L NaCl,10 mmol/L咪唑,pH值 8.0)重懸菌體,冰浴超聲破菌,離心收集上清。將含目的蛋白的細菌破碎液上樣于Ni-NTA純化柱,調整流速(≤1.5 mL/min)后,用Wash Buffer(20 mmol/L Tris,500 mmol/L NaCl,20 mmol/L咪唑,pH值8.0)洗去雜蛋白,再用Elution Buffer(20 mmol/L Tris,500 mmol/L NaCl,250 mmol/L 咪唑,pH值8.0)洗脫,收集洗脫液,SDS-PAGE分析,其余樣品用PBS于4 ℃過夜透析,透析液冷凍干燥后存于-80 ℃超低溫冰箱。
2 結果與分析
2.1 融合蛋白SUMO-SMAP-29誘導表達條件的優化
2.1.1 不同IPTG濃度對大腸桿菌表達融合蛋白SUMO-SMAP-29的影響 SUMO標簽蛋白分子量為14 ku,但是實際表現為18 ku,可能與其特殊的三級結構有關[12]。抗菌肽SMAP-29的分子量為3.2 ku,因此,融合蛋白的分子量表現為21 ku左右。SDS-PAGE電泳結果(圖1)表明,在21 ku處可以明顯看到融合蛋白SUMO-SMAP-29得到表達。0.25、0.50、1.00、2.00 mmol/L濃度的IPTG均能誘導大腸桿菌表達融合蛋白SUMO-SMAP-29。

通過Quantity One和SPSS軟件,對不同IPTG濃度誘導情況下融合蛋白SUMO-SMAP-29的相對表達量進行分析,結果如表1和圖2所示。誘導前,大腸桿菌本底水平表達了微量的融合蛋白,約占總蛋白的0.5%,當IPTG濃度為0.50、1.00 mmol/L時融合蛋白SUMO-SMAP-29的表達量相對較高,分別占菌體總蛋白的9.99%、10.02%,統計學分析顯示兩者差異不顯著。因此,IPTG濃度在0.50~1.00 mmol/L之間均能相對高效地誘導融合蛋白SUMO-SMAP-29的表達,出于節約成本考慮,在后續試驗中選擇0.50 mmol/L IPTG為誘導濃度。

表1 不同IPTG濃度融合蛋白SUMO-SMAP-29的相對表達量
注:同列數據后不同小寫字母表示組間差異顯著(P<0.05)。下表同。

2.1.2 不同誘導溫度對大腸桿菌表達融合蛋白SUMO-SMAP-29的影響 由圖2可知,在誘導溫度為25、30、37、42 ℃ 時,均能誘導大腸桿菌表達融合蛋白SUMO-SMAP-29。通過Quantity One軟件對融合蛋白SUMO-SMAP-29的相對表達量進行分析,結果如表2和圖2所示,當誘導溫度為30、37 ℃時表達量相對較高,分別占菌體總蛋白的10.10%、9.95%,兩者間差異不顯著,因此30~37 ℃均能相對高效地誘導融合蛋白SUMO-SMAP-29的表達,為了降低對恒溫培養箱的損耗,后續試驗選擇低一點的溫度30 ℃作為誘導溫度。
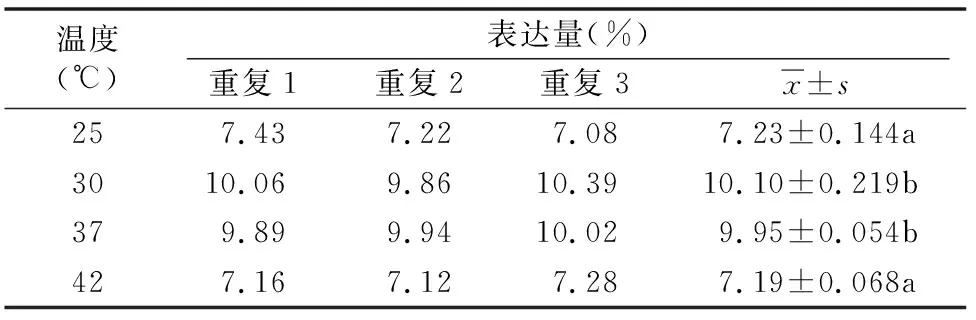
表2 不同誘導溫度融合蛋白SUMO-SMAP-29的相對表達量
2.1.3 不同誘導時間對大腸桿菌表達融合蛋白SUMO-SMAP-29的影響 通過Quantity One和SPSS軟件對融合蛋白SUMO-SMAP-29的相對表達量進行分析,結果如圖3和表3所示,誘導表達后,融合蛋白SUMO-SMAP-29表達量0~3 h不斷升高,在5 h處表達量達到相對較高的水平,占菌體總蛋白的11.35%;5 h后,融合蛋白SUMO-SMAP-29的表達量反而有所減少。統計學分析顯示,誘導3、5 h的相對表達量差異不顯著,出于節約時間的考慮,選取3 h作為誘導時間。
2.2 融合蛋白SUMO-SMAP-29的分離純化
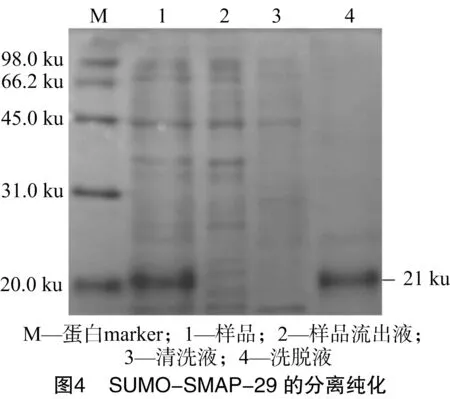
在誘導劑IPTG終濃度為0.50mmol/L、誘導溫度為30 ℃、誘導3 h后收集菌液離心。經Ni柱親和層析純化后,分別取樣品、樣品流出液、清洗液以及洗脫液用SDS-PAGE電泳分析(圖4),電泳結果顯示獲得了融合蛋白SUMO-SMAP-29。


表3 不同誘導時間對融合蛋白SUMO-SMAP-29的相對表達量
3 討論
大腸桿菌具有培養條件簡單、生長繁殖快、安全性好、可高效表達外源基因等優點,是目前抗菌肽表達采用最多的表達系統。抗菌肽SMAP-29因本身具有抗菌活性,對宿主菌具有殺傷作用,直接表達較困難。另外,因分子量小和陽離子特性容易被細胞中的蛋白酶降解,目前表達抗菌肽時常采用融合表達。融合表達模擬了抗菌肽在生物機體內合成時的前體結構[13],分子伴侶的作用類似于天然抗菌肽的前體部分。SUMO標簽蛋白能促進目的蛋白的可溶性表達和正確折疊[14];對熱和蛋白酶有很強的抗性,有利于保持目的蛋白的穩定性;SUMO分子量較小,表達融合蛋白中目的蛋白占比例較大,提高目的蛋白得率。
外界條件如IPTG濃度、誘導溫度、誘導時間等對大腸桿菌表達外源蛋白有著十分重要的影響。研究發現,通過優化上述條件能夠獲得更高的表達量,但因表達菌株、質粒和外源蛋白的差異,最佳的表達條件也各不相同。
誘導劑IPTG濃度過低時,啟動子沒有完全啟動,大腸桿菌無法最大化分泌外源蛋白;但IPTG濃度過高可能會對大腸桿菌有抑制作用,且IPTG一般價格不便宜,會造成試驗經費上的浪費。本試驗通過研究不同IPTG濃度對大腸桿菌表達SUMO-SMAP-29的影響發現,隨著IPTG濃度的升高,融合蛋白SUMO-SMAP-29表達量增加,當IPTG濃度為 0.50、1.00 mmol/L時融合蛋白SUMO-SMAP-29表達量相對較高,統計分析顯示表達量差異不顯著;但IPTG濃度為 2.00 mmol/L 時,表達量反而下降,這可能與高濃度的IPTG對大腸桿菌有抑制作用相關,出于成本考慮,在本試驗選擇 0.50 mmol/L IPTG作為誘導濃度。
溫度不僅影響大腸桿菌的生長,也對外源蛋白的穩定性有著一定的影響。在溫度相對偏低時,菌體生長速率緩慢,代謝速率較低,外源蛋白表達量偏低。但在另一方面,低溫有助于維持穩定外源蛋白的結構,高溫可能會破壞外源蛋白的結構,研究發現溫度過高(如42 ℃)時,融合蛋白SUMO-SMAP-29的表達量有所降低。本試驗中發現誘導溫度為30、 37 ℃ 時,融合蛋白SUMO-SMAP-29表達量相對較高,統計分析顯示30、37 ℃誘導時融合蛋白SUMO-SMAP-29相對表達量之間差異不顯著,為了降低對恒溫培養箱的損耗,本試驗選擇低一點的溫度(30 ℃)作為誘導溫度。
誘導表達時間的優化影響著外源蛋白的最終產量。從外源蛋白開始被大腸桿菌表達至培養基中養分耗盡的過程中,外源蛋白的表達是一個不斷變化的過程。因為隨著誘導時間的延長,表達的外源蛋白越來越多,但是,外源蛋白也不斷被蛋白酶降解。在本試驗中,大腸桿菌在0~5 h這段時間大量表達融合蛋白SUMO-SMAP-29;5 h后,由于大腸桿菌表達SUMO-SMAP-29的速率下降,低于SUMO-SMAP-29被降解的速率,所以SUMO-SMAP-29開始減少。統計學分析顯示,誘導3、5 h的相對表達量差異不顯著,出于節約時間的考慮,選取3 h作為誘導時間。
相對于表達載體的構建和蛋白的誘導表達,外源蛋白的純化更加困難和繁瑣。Ni柱親和層析是通過蛋白質暴露在表面的一些氨基酸殘基(如組氨酸)和樹脂上的金屬離子之間的特異性結合進行純化目的蛋白的,具有配體簡單、吸附性強、分離條件適宜以及不影響蛋白質自身的生物活性等優點。融合標簽SUMO自身帶有6×His標簽,因此本試驗利用Ni柱親和層析純化重組融合蛋白SUMO-SMAP-29,且純化效率較好。
本試驗結果表明,融合蛋白SUMO-SMAP-29相對最優的誘導表達條件為IPTG終濃度0.50 mmol/L、誘導溫度 30 ℃、誘導表達時間3 h。這為進一步研究抗菌肽SMAP-29的生物學活性及產業化開發奠定了必要的基礎。
:
[1]Yong D,Toleman M A,Giske C G,et al. Characterization of a new metallo-beta-lactamase gene,b1aNDM-1,and a novel erythromycin esterase gene carried on a unique genetic structure inKlebsiellapneumoniaesequence type 14 from India[J]. Antimicrobial Agents and Chemotherapy,2009,53(12):5046-5054.
[2]Zasloff M. Antimicrobial peptides of multicellular organisms[J]. Nature,2002,415(6870):389-395.
[3]Silva N C,Sarmento B,Pintado M. The importance of antimicrobial peptides and their potential for therapeutic use in ophthalmology[J]. International Journal of Antimicrobial Agents,2013,41(1):5-10.
[4]Bagella L,Scocchi M,Zanetti M. cDNA sequences of three sheep myeloid cathelicidins[J]. FEBS Letters,1995,376(3):225-228.
[5]Lee D G,Kim P I,Park Y,et al. Antifungal mechanism of SMAP-29 (1-18) isolated from sheep myeloid mRNA againstTrichosporonbeigelii[J]. Biochemical and Biophysical Research Communications,2002,295(3):591-596.
[6]Arzese A,Skerlavaj B,Tomasinsig L,et al. Antimicrobial activity of SMAP-29 against theBacteroidesfragilisgroup and clostridia[J]. The Journal of Antimicrobial Chemotherapy,2003,52(3):375-381.
[7]Giacometti A,Cirioni O,Ghiselli R,et al. Cathelicidin peptide sheep myeloid antimicrobial peptide-29 prevents endotoxin-induced mortality in rat models of septic shock[J]. American Journal of Respiratory and Critical Care Medicine,2004,169(2):187-194.
[8]Skerlavaj B,Benincasa M,Risso A,et al. SMAP-29:a potent antibacterial and antifungal peptide from sheep leukocytes[J]. FEBS Letters,1999,463(1/2):58-62.
[9]Anderson R C,Hancock R E,Yu P L. Antimicrobial activity and bacterial-membrane interaction of ovine-derived cathelicidins[J]. Antimicrobial Agents and Chemotherapy,2004,48(2):673-676.
[10]陳 琛,吳三橋,李新生,等. 抗菌肽SMAP-29結構功能及分子設計策略[J]. 生物工程學報,2011,27(6):846-859.
[11]欒 超. 利用SUMO融合技術在枯草芽孢桿菌中重組表達抗菌肽cathelicidin-BF及其生物活性研究[D]. 杭州:浙江大學,2014.
[12]Vassilevski A A,Kozlov S A,Grishin E V. Antimicrobial peptide precursor structures suggest effective production strategies[J]. Recent Patents on Inflammation & Allergy Drug Discovery,2008,2(1):58-63.
[13]Malakhov M P,Mattern M R,Malakhova O A,et al. SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins[J]. Journal of Structural and Functional Genomics,2004,5(1/2):75-86.
[14]Butt T R,Edavettal S C,Hall J P,et al. SUMO fusion technology for difficult-to-express proteins[J]. Protein Expression and Purification,2005,43(1):1-9.

