α-硫辛酸對高鹽誘導的大鼠高血壓反應過程的抑制作用*
胥 艷,袁 丹,劉東亮,王 宇,朱蜀俠,茍 偉
(1.四川省成都市363醫院泌尿外科 610000;2.西南醫科大學附屬醫院神經內科,四川瀘州 646000)
高鹽攝入作為一個重要的環境因素,在高血壓的發生、發展中起著重要的作用[1]。據報道,活性氧(reactive oxygen species,ROS)在頭端延髓腹外側區(rostral ventrolateral medulla,RVLM)中的過量產生與高鹽誘發的高血壓的發生明顯相關[2]。相關研究顯示,它可在體內代謝產生抑制ROS的抗氧化物質[3-4]。最新研究提示,α硫辛酸能夠降低血壓,并通過抵制過氧化物損傷而保護機體減輕心血管疾病所帶來的危害[5]。因此,本研究旨在探討補充α硫辛酸能否抑制RVLM中的ROS的產生從而對高鹽誘導的高血壓產生抑制作用。
1 材料與方法
1.1材料來源 成年雄性大鼠,清潔級,120~150 g,由南京模型動物研究所提供。
1.2試劑與儀器 胎牛血清購自美國Santa Cruz公司;還原型煙酰胺腺嘌呤二核苷酸磷酸[NAD(P)H]氧化酶2(NOX2)、NOX4、銅/鋅超氧化物歧化酶(Cu/Zn-SOD)及β-actin多克隆抗體購自美國Santa Cruz公司;鼠二抗購自美國Abacm公司;α硫辛酸(規格300 mg∶12 mL) 購自武漢天翼有限公司;電化學發光試劑盒購自美國Abcam公司。
1.3大鼠高血壓模型的建立和實驗分組[6]將雄性大鼠32只隨機分配到兩組:兩組分別給予正常鹽飲食(0.3% NaCl)8周(n=16)和高鹽飲食8周(8% NaCl)(誘導高血壓模型)(n=16)。之后將正常鹽飲食大鼠及高鹽飲食大鼠各自再分別分為兩組,每兩組分別給予溶于0.9%生理鹽水的α硫辛酸 (60 mg/kg)或單獨給予生理鹽水灌胃飼養9周。由此共4組,即:實驗組(n=8,高血壓模型樣本喂養α硫辛酸)、模型組(n=8,高血壓模型樣本喂養生理鹽水)、對照組(n=8,正常鹽飲食樣本喂養α硫辛酸)和空白對照組(n=8,正常鹽飲食樣本喂養生理鹽水)。
1.4方法
1.4.1血壓監測 所有大鼠動脈壓通過尾套儀器測量及系統記錄。血壓測量從實驗第7周開始,每天測量3次。取平均值,直至實驗結束。
1.4.2實驗標本制作 將氯胺酮(90 mg/kg)和甲苯噻嗪(10 mg/kg)混合麻醉大鼠。取標本。用Palkovits′s顯微解剖技術收集RVLM組織[7]。-80 ℃凍存。
1.4.3NOX2、NOX4及Cu/Zn-SOD的測定 大鼠面頜神經核尾端周圍 500~700 μm的區域被確認為 RVLM。解剖大鼠獲得標本后切片裝載固定,-80 ℃儲存。免疫組織化學和免疫熒光標記在流動截面上進行,一抗分別為NOX2 (sc-20782,Santa Cruz,1∶200)、NOX4 (sc-5827,Santa Cruz,1∶200)及(Cu/Zn-SOD,sc-11407,Santa Cruz,1∶200)。用來做免疫組織化學的腦組織用羊抗兔二抗(HistostainTM-Plus IHC Kit,SP-9001,Zsgb-Bio,China)孵育。用二氨基聯苯胺(3,3-diaminobenzidine,DAB) 試劑盒(AR 1002,Boster,China)染色。一抗NOX2(sc-20782,Santa Cruz,1∶400)、NOX4 (sc-5827,Santa Cruz,1∶400)及Cu/Zn-SOD(sc-11407,Santa Cruz,1∶200)。
1.4.4ELISA測定丙二醛(MDA)、超氧化物歧化酶(SOD)及谷胱甘肽(GSH) 用ELISA試劑盒(Invitrogen Corporation,CA,USA)對上述指標進行定量檢測。
1.4.5高效液相色譜法檢測血清去甲腎上腺素(NE)水平 用高效液相色譜法檢測血清NE水平。全心質量/體質量(whole heart weight/body weight,WHW/BW),全心質量/脛骨長度(whole heart weight/tibia length,WHW/TL)及左心室重量/脛骨長度(left-ventricular weight/tibia length,LVW/TL)作為心肌肥厚的指標被檢測。
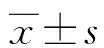
2 結 果
2.1給藥后各組平均動脈壓(MAP)的變化 給藥后第8周,模型組平均動脈壓為(162.4±11.3)mm Hg、空白對照組為(106.2±10.1)mm Hg,差異有統計學意義(P<0.05)。對照組平均動脈壓為(129.1±8.9)、實驗組為(159.4±9.2)mm Hg,差異有統計學意義(P<0.05)。見圖1。
2.2免疫熒光顯示給藥后RVLM中NOX2、NOX4陽性神經元的表達情況 免疫熒光結果顯示,模型組較空白對照組中表達NOX2和NOX4的陽性神經元要高。給藥后9周,實驗組和模型組RVLM中表達NOX2 和NOX4的陽性神經實驗組較模型組中表達NOX2和NOX4的陽性神經元要低,見圖2。

*:P<0.05,與對照組比較;#:P<0.05,與模型組比較
圖1各組MAP的變化

圖2 免疫熒光顯示給藥后RVLM中NOX2、NOX4陽性神經元的表達情況(×40)
2.3模型建立后和給藥后9周各組RVLM中二氫乙啶(DHE)熒光強度和Cu/Zn-SOD陽性神經元的表達情況 模型建立后,免疫熒光結果顯示模型組和空白對照組RVLM中Cu/Zn-SOD的陽性神經元數量分別為(9.2±2.1)、(32.4±4.6)個,空白對照組明顯高于模型組(P<0.05),二氫乙啶(DHE)熒光強度別為86.5±3.4和 22.3±1.7,模型組明顯高于空白對照組(P<0.05);給藥后,實驗組與模型組RVLM中Cu/Zn-SOD水平分別為19.7±1.6、10.3±1.2,差異均有統計學意義(P<0.05);實驗組和模型組二氫乙啶(DHE)熒光強度分別為63.4±2.9和101.3±4.1,實驗組明顯低于模型組(P<0.05)。
2.4模型建立后及給藥后9周各組RVLM中NOX2、NOX4表達情況 模型建立后,Western blot結果顯示,模型組和空白對照組RVLM中NOX2 和NOX4 蛋白表達(OD值)分別為模型組NOX2:103.6±4.1,NOX4:114.5±3.2;空白對照組NOX2:24.6±1.9,NOX4:32.1±3.0,模型組和空白對照組表達差異有統計學意義(P<0.05);給藥后9周, 實驗組和模型組NOX2 和NOX4蛋白表達分別為實驗組NOX2:80.2±1.7,NOX4:65.1±2.4;模型組NOX2:112.7±3.8,NOX4:99.4±1.7,實驗組明顯低于模型組(P<0.05) 。
2.5模型建立后及給藥后9周各組RVLM線粒體中MDA、SOD及GSH表達情況 模型建立后,用ELISA檢測模型組和空白對照組RVLM線粒體中 MDA水平分別為(10.2±2.9)、(5.1±2.0)μmol/g,空白對照組明顯低于模型組(P<0.05)。模型組和空白對照組RVLM線粒體中GSH和SOD水平分別為GSH:(2.1±0.3)、(5.7±1.2)μmol/g, SOD:(17.4±1.6)、(32.3±2.5)U/mg,模型組明顯低于空白對照組(P<0.05)。給藥后9周,實驗組和模型組MDA分別為(5.4±1.2)、(9.8±3.2)μmol/g,實驗組明顯低于模型組(P<0.05);實驗組和模型組RVLM線粒體中SOD水平分別為(35.2±3.1)、(16.2±1.3)U/mg,實驗組較模型組明顯增高(P<0.05),實驗組和模型組GSH水平分別為(5.6±0.4)、(2.0±0.4)μmol/g,實驗組較模型組明顯增高(P<0.05)。
2.6模型建立后和給藥后9周各組心肌肥厚相關指標和血清去甲腎上腺素(NE)水平的變化 模型建立后,模型組WHW/BW、WHW/TL及LVW/TL分別為4.6±0.7、46.9±0.3、31.6±2.4,空白對照組WHW/BW、WHW/TL及LVW/TL分別為2.0±0.5、31.4±0.1、18.2±1.1,模型組明顯高于空白對照組(P<0.05);給藥9周后,實驗組WHW/BW、WHW/TL及LVW/TL分別為3.0±0.5、35.7±0.6、21.3±2.1,模型組WHW/BW、WHW/TL及LVW/TL分別為4.6±0.7、46.9±0.3、31.6±2.4,實驗組明顯低于模型組(P<0.05)。模型建立后,用高效液相色譜法檢測模型組和空白對照組血清NE水平分別為(465.9±7.2)、(301.5±3.6)pg/mL,模型組明顯高于空白對照組(P<0.05);給藥9周后,實驗組和模型組血清NE水平分別為(332.8±6.5)、(512.3±7.9)pg/mL,實驗組明顯低于模型組(P<0.05)。
3 討 論
本研究結果顯示,補充α硫辛酸9 周可通過降低MAP 和代表交感神經系統活性的血清NE水平從而顯著緩解高鹽誘導的高血壓反應。此外,補充α硫辛酸還可降低RVLM中NOX2和NOX4的表達,減少線粒體 RVLM中 ROS 的過量產生,而且高鹽誘導高血壓大鼠WHW/BW、WHW/TL和LVW/TL比值的增加提示其可以提高抗氧化能力、延緩心肌肥厚。因此,本研究觀點可歸納為長期給予α硫辛酸可通過降低NOX2和 NOX4的表達、增強線粒體的生物能量、提高高血壓發展中的RVLM中細胞內抗氧化能力從而降低高鹽誘導的高血壓大鼠的MAP、交感神經活性及機體氧化應激損傷。
眾所周知,高鹽飲食可上調大腦區域如海馬和大腦皮層的氧化應激,在高血壓的病理機制中發揮重要作用[7-8]。RVLM 可決定心血管中心交感神經基本功能,且與交感神經系統活性密切相關[9]。本研究亦證實高鹽飲食可增加RVLM中超氧化物的產生進而激活交感神經系統,與前期研究結果一致[10-11]。
α硫辛酸被公認為強效生物抗氧化物及線粒體生物能量酶的必要輔助因子,可恢復細胞內還原型谷光甘肽(GSH)的表達[12-13],亦是抗氧化物中惟一一個脂水兼容的物質。因此,α硫辛酸可進入大腦底部清除自由基、修復 ROS 的過度損傷。本研究結果顯示長期補充α硫辛酸可降低高鹽誘導的大鼠模型中的MAP、延緩心肌肥厚的產生、降低NOX2和NOX4的表達及RVLM線粒體中過氧化物。因此筆者推測,補充α硫辛酸通過下調NOX2和NOX4的表達從而降低RVLM中的氧化應激、增強線粒體的生物能量、提高RVLM在細胞內的抗氧化能力,最終降低血壓和高鹽誘導高血壓產生的心肌肥厚 。
綜上所述,長期高鹽飲食可增加高血壓的風險并誘導NAD(P)H和RVLM內線粒體中的ROS過量產生,在高血壓的發生、發展中起到了重要作用;長期α硫辛酸補充可通過多種途徑緩解高血壓反應和延緩心肌肥厚產生。
[1]WU K L,CHAN S H,CHAN J Y.Neuroinflammation and oxidative stress in rostral ventrolateral medulla contribute to neurogenic hypertension induced by systemic inflammation[J].J Neuroinflammation,2012,9(1):212.
[2]OGAWA K,HIROOKA Y,SHINOHARA K,et al.Inhibition of oxidative stress in rostral ventrolateral medulla improves impaired baroreflex sensitivity in stroke-prone spontaneously hypertensive rats[J].Int Heart J,2012,53(3):193-198.
[3]譚穎穎,王亞運,張琪.電針“曲池”穴對中樞血管緊張素Ⅱ誘發的動脈血壓升高大鼠異常交感神經活性的影響[J].針刺研究,2016,41(2):144-149.
[4]趙冉冉,徐曉臣,徐飛,等.天然抗氧化劑α-硫辛酸對血管性癡呆大鼠線粒體的保護作用[J].山西醫科大學學報,2014,45(12):1136-1139.
[5]SU Q,LIU J J,CUI W,et al.Alpha lipoic acid supplementation attenuates reactive Oxygen species in hypothalamic paraventricular nucleus and sympathoexcitation in high salt-induced hypertension[J].Toxicol Lett,2016,241(241):152-158.
[6]劉美麗,宋海旭,邵曉平,等.趨化因子配體16在高鹽誘導的鹽敏感性高血壓大鼠心肌重構中的作用[J].解放軍醫學雜志,2015,40(11):873-879.
[7]HE F J,CAMPBELL N R,MACGREGOR G A.Reducing salt intake to prevent hypertension and cardiovascular disease[J].Rev Panam Salud Publica,2012,32(4):293-300.
[8]PARK J,CHANG K K.Sodium intake and prevalence of hypertension,coronary heart disease,and stroke in Korean adults[J].J Ethnic Foods,2015,2(3):92-96.
[9]王英,郭曲練,鄢建勤,等.DNA甲基轉移酶類在大鼠神經病理性疼痛發病機制中的作用[J].中南大學學報(醫學版),2016,41(6):578-585.
[10]WU K L,HUNG C Y,CHAN J Y,et al.An increase in adenosine-5′-triphosphate (ATP) content in rostral ventrolateral medulla is engaged in the high fructose diet-induced hypertension[J].J Biomed Sci,2014,21(1):8.
[11]GUDJONCIK A,GUENANCIA C,ZELLER M,et al.Iron,oxidative stress,and redox signaling in the cardiovascular system[J].Mol Nutr Food Res,2014,58(8):1721-1738.
[12]吳敏,袁剛,管曉峰,等.α-硫辛酸治療糖尿病周圍神經病變的療效觀察[J].中華全科醫學,2011,9(4):517-519.
[13]張晶晶,鄧后亮,季愛民.α-硫辛酸預處理對人臍靜脈內皮細胞缺氧復氧損傷的保護作用[J].實用醫學雜志,2014,30(7):1053-1056.

