甲巰咪唑致胰島素自身免疫綜合征1例*
鄧玉鳳,王賀元,王海民,彭若萱,張 紅,馮亞坤,孫成林
(吉林大學第一醫院內分泌代謝科,長春 130021)
胰島素自身免疫綜合征(IAS)是一種罕見類型的低血糖癥,甲巰咪唑致IAS更是少見,臨床易漏診、誤診。本文報道1例甲巰咪唑致IAS患者,增強對該病的認識,有利于提高臨床診斷的準確性。
1 臨床資料
患者,女,46歲,因“乏力、心悸、頸部腫大3個月余,反復低血糖7 d”于2016年9月26日就診于吉林大學第一醫院門診。3個月余前因乏力、心悸、頸部腫大于當地醫院明確診斷為甲狀腺功能亢進癥(甲亢),規律口服甲巰咪唑抗甲亢治療,至來本院時維持每天2次10 mg口服。7 d前患者無明顯誘因出現心悸、多汗、全身不自主抖動、反應遲鈍、言語模糊,于當地醫院測指尖血糖為1.9 mmol/L,給予濃糖后患者神志改善,癥狀明顯好轉。后上述癥狀反復發作7次,指尖血糖在1.4~2.3 mmol/L,均給予濃糖后患者癥狀好轉。既往史:否認糖尿病病史,否認其他自身免疫性疾病,否認胰島素及其他降糖藥物應用史,否認服用ACEI、ARB類藥物史,其母親為甲亢,行甲狀腺大部分切除術。查體:體溫36 ℃,心率92次/分,呼吸頻率17次/分,血壓120/80 mm Hg,體質量指數24.5 kg/m2。神志清楚,無突眼,兩側甲狀腺Ⅱ度腫大,質地中等,雙手平舉有震顫,查體無明顯異常。輔助檢查:促甲狀腺激素(TSH)0.005 IU/L,血清游離三碘甲腺原氨酸(FT3)9.74 pmol/L,血清游離甲狀腺素(FT4)38.41 pmol/L。口服葡萄糖耐量實驗(OGTT)示糖耐量異常。胰島素釋放實驗:0、60、120 min均大于6 945 pmol/L;C肽明顯升高;胰島素釋放指數小于0.3(表1)。糖尿病相關抗體:胰島素自身抗體陽性,抗胰島細胞抗體、抗酪氨酸磷酸酶抗體、抗谷氨酸脫羧酶抗體均陰性。頭CT未見明顯異常;腹部CT未見胰腺病變,可排除胰腺腫瘤。診斷“甲巰咪唑致IAS”,治療上停用甲巰咪唑,同時給予潑尼松5 mg,每天2次口服,期間偶有低血糖,至20 d后患者再未出現低血糖,自行停用激素。2016年11月復診OGTT示胰島素水平顯著下降、C肽水平正常,糖化血紅蛋白水平正常(表2),糖尿病相關抗體均為陰性。患者病情好轉,自身抗體轉陰,胰島素水平顯著下降,血糖水平大致正常,考慮IAS臨床治愈,目前患者處于隨訪中。
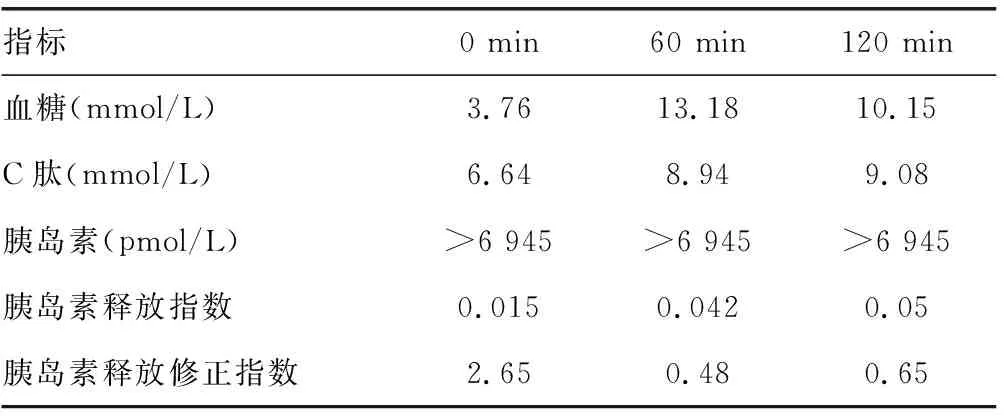
表1 患者初診時OGTT實驗結果
胰島素釋放指數=[血漿胰島素(μU/mL)]/[血漿葡萄糖(mg/dL)];胰島素釋放修正指數=[血漿胰島素(μU/mL)×100]/[血漿葡萄糖(mg/dL)-30]
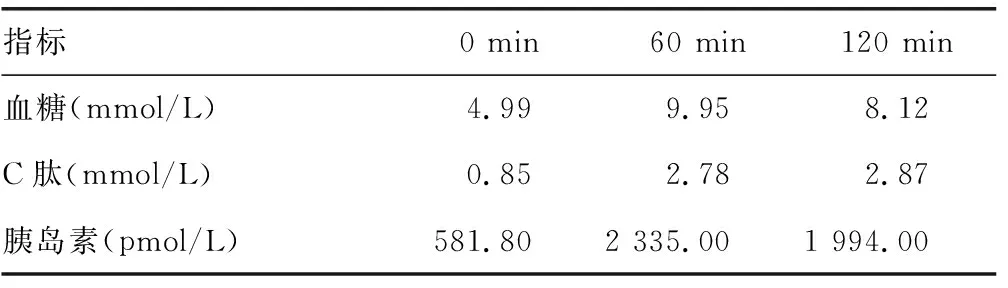
表2 患者治療期間復查OGTT實驗結果
2 討 論
IAS由日本學者HIRATA[1]于1970年首次報道,主要臨床表現為反復發作低血糖、高胰島素血癥及胰島素自身抗體(IAA)或胰島素受體抗體陽性,是除胰腺腫瘤及胰島素瘤外自發性低血糖癥的第三大病因[2]。陳敏等[3]研究發現,IAS可發病于各年齡段,40歲以上多見,發病高峰為60~69歲。
IAS存在遺傳免疫缺陷基礎,人類白細胞抗原(HLA)的HLA-DR4及HLA-DRBl*0406等位基因可能是主要的易感基因[4]。IAS常發生于有Graves病、系統性紅斑狼瘡、類風濕關節炎等自身免疫性疾病中。高效價的IAA是IAS 產生嚴重低血糖的關鍵,且IAA多數是由某些藥物免疫反應誘發,常見的藥物為含巰基藥物,近年來也有不含巰基的藥物引起IAS的報道,發病機制有待進一步研究闡明[5]。1992年UCHIGATA等[6]已經研究了人胰島素α鏈的“TSICSLYQLE”基序使用其IXXLXQ基序以高親和力結合DRB1*0406。因為二硫鍵的存在,這個片段在正常生理條件下存在很低的濃度,而巰基可以切割胰島素分子的二硫鍵,留下線性片段,暴露于DRα-DRB1*0406的α鏈上,以高親和力結合抗原呈遞細胞。這種相互作用觸發了自身胰島素特異性T輔助細胞的生成,從而產生IAA。有研究顯示,IAS患者的IAA具有低親和力及高容量結合的特點IAA與胰島素綜合體的解體導致循環胰島素激增,產生低血糖。停用藥物可緩解,而恢復藥物則導致低血糖復發。胰島素與IAA的結合與解離如何調控目前尚不清楚。當循環中的抗體消失后,血糖逐漸恢復正常[7]。
本文患者支持含有巰基的藥物導致IAS。在IAS中,胰島素總量顯著升高,通常高于100 μU/mL(717.5 pmol/L)[8],此患者突出特點是胰島素水平極高。胰島素升高程度可考慮外源性胰島素、胰島素瘤、自身免疫綜合征,包括IAS和抗胰島素受體抗體(B型胰島素抵抗綜合征)。雖然胰島素受體抗體沒有檢測,B型胰島素抵抗不太可能,幾乎沒有胰島素抗體和胰島素受體抗體同時存在的報道[7]。
IAS的治療以停用誘發藥物為主,同時可加用阿卡波糖、少量多餐、低碳水化合物飲食,大多數患者可以得到不同程度的緩解,不能緩解者可加用小劑量糖皮質激素或免疫抑制劑,嚴重者可行血漿置換甚至胰腺部分切除[9]。病程呈自限性,預后良好,80%患者停用誘發藥物后1個月內可自行緩解[6]。本例患者反復出現低血糖癥狀,停用甲巰咪唑并給予少量潑尼松口服后,未再出現低血糖癥狀。潑尼松的潛在益處包括(1)通過胰島素升高血糖抵抗性;(2)抑制自身免疫;(3)抑制T4轉化為T3[8]。復查C肽水平正常,胰島素仍處于高水平,血糖水平大致正常,考慮部分胰島素仍處于結合狀態。
由于IAS發病率低,臨床少見,故容易漏診。本例治療及時,避免了嚴重并發癥,因此在甲亢患者使用甲巰咪唑治療期間出現反復低血糖時應警惕該病。治療后應嚴格禁止再服用同類藥物,以免再次誘發低血糖。
[1]HIRATA Y.InsuIin autoimmune syndrome[J].nihon Rinsho,1973,31(7):2227-2231.
[2]楊曉平,李芳萍.胰島素自身免疫綜合征的診治[J].中華內分泌代謝雜志,2011,27(10):857-858.
[3]陳敏,莊曉明,竇京濤,等.胰島素自身免疫綜合征的臨床特征比較分析[J].首都醫科大學學報,2012,33(3):409-413.
[4]JAIN N,SAVANI M,AGARWAL M,et al.Methimazole-induced insulin autoimmune syndrome[J].Ther Adv Endocrinol Metab,2016,7(4):96.
[5]TORIMOTO K,OKADA Y,MORI H,et al.Two sisters with Graves disease and similar clinical features who tested positive for anti-insulin antibodies after thiamazole treatment[J].Int Med,2016,55(9):1125-1129.
[6]UCHIGATA Y,HIRATA Y,IWAMOTO Y.Insulin autoimmune syndrome(Hirata disease):epidemiology in Asia,including Japan[J].Diabetol Int,2010,1(1):21-25.
[7]ZHANG Y Y,ZHAO T Y.Hypoglycemic coma due to insulin autoimmune syndrome induced by methimazole:A rare case report[J].Exp Ther Med,2014,8(5):1581-1584.
[8]LEE S H,OH S H,CHUNG W Y.Insulin autoimmune syndrome induced by methimazole in a Korean girl with Graves′disease[J].Ann Pediatr Endocrinol Metab,2013,18(1):32-35.
[9]QUAN H,TAN H,LI Q,et al.Immunological hypoglycemia associated with insulin antibodies induced by exogenous insulin in 11 Chinese patients with diabetes[J].J Diabetes Res,2015,2015:1-9.

