miRNA-129-5p干擾技術對膽道閉鎖小鼠膽道EMT作用機制的研究*
王建堯,王 斌△,吳宙光,葉曉爍,陳子民,馮 奇,劉 冬,姚 君
(1.廣東省深圳市兒童醫院普外二科 518000;2.廣東省深圳市人民醫院消化內科 518000)
膽道閉鎖是嬰兒期累及肝內外膽管、最終導致終末期肝硬化的嚴重肝臟疾病[1-4]。miRNA-129-5p是新近發現的一個與纖維化疾病緊密相關的小分子RNA(miRNA)家族,在多種器官纖維化的調控中發揮著重要作用[5-8]。在膽道閉鎖膽管上皮細胞纖維化過程中,上皮間質轉化(epithelium-mesenchymal transition,EMT)機制發揮著至關重要的作用[9]。本研究將構建TGF-β1誘導的小鼠膽管EMT分化細胞模型,檢測TGF-β1刺激后膽道上皮細胞株EMT相關標志物及細胞外基質(ECM)表達水平,并檢測miRNA-129-5p的表達變化,探討miRNA-129-5p調控EMT的機制,現報道如下。
1 材料與方法
1.1實驗動物與試劑 動物BALB/c小鼠[廣東省醫學動物實驗中心,SCXK(粵)2014-0035],5周齡;Trizol(美國Invitrogen公司);DNA熒光染料SYBR Green Ⅰ(美國Invitrogen公司);引物(美國Invitrogen公司);RNA酶抑制劑(美國Invitrogen公司);Taq酶(美國Invitrogen公司);10×buffer(美國Invitrogen公司);5×buffer(美國Invitrogen公司);LipofectamineTM2000(美國Invitrogen公司);DMEM培養基(美國Gibco公司);Pre-miRTMmiRNA-129-5p(美國Invitrogen公司);Pre-miRTMmicroRNA Precursor陰性對照(美國Invitrogen公司);BCA蛋白濃度測定試劑盒(碧云天生物有限公司);重組人TGF-β1(美國Santa cruz Biotechnology公司);小鼠抗人β-actin單克隆抗體(美國Santa cruz Biotechnology公司);兔抗人鈣黏蛋白(E-cadherin)多克隆抗體(美國Santa cruz Biotechnology公司);山羊抗人claudin1多克隆抗體(美國Santa cruz Biotechnology公司);小鼠抗人波形蛋白(Vimentin)單克隆抗體(美國Santa cruz Biotechnology公司);兔抗人FN多克隆抗體(美國Santa cruz Biotechnology公司);辣根過氧化物酶標記抗山羊二抗(美國Santa cruz Biotechnology公司);辣根過氧化物酶標記抗山羊二抗(美國Santa cruz Biotechnology公司);miRNA提取試劑盒(美國Applied Biosystems公司);miRNA反轉錄試劑盒(美國Applied Biosystems公司);實時熒光定量PCR (RT-PCR)試劑盒(美國Invitrogen公司)。
1.2方法
1.2.1膽道閉鎖動物模型構建及肝臟蘇木精-伊紅(HE)染色 根據國內湯紹濤等[10]的造模方法,將BALB/c小鼠30只按照雄雌比例1∶3分籠飼養,待生下第1胎新生鼠后分2組,給新生12~18 h BALB/c小鼠經腹腔內分別注入生理鹽水(對照組)和輪狀病毒(實驗組),于注射后14 d取肝臟及膽管組織,連續切片行HE染色。
1.2.2RT-PCR檢測miRNA-129-5p的表達變化 分別取兩組小鼠膽管組織置于-70 ℃保存備用,切取部分標本后,每份稱量50 mg置于玻璃勻漿器中,依照mirVanaTMmiRNA Isolation Kit說明書進行總RNA提取,將提取物于-70 ℃保存。
RT reaction master mix的合成按照TaqMan MicroRNA Reverse Transcription Kit說明書的步驟合成,總反應體系為7.00 μL,其中0.15 μL 100 mmol/L dNTPs,1.00 μL MultiScribeTMReverse Transcriptase,1.50 μL 10×Reverse Transcription buffer,0.19 μL 20 U/μL的RNAse Inhibitor,4.16 μL無核酸酶水。
cDNA的合成按照TaqMan MicroRNA Reverse Transcription Kit說明書的步驟合成,總反應體系15.0 μL,其中7.0 μL RT reaction master mix,3.0 μL RT590,5.0 μL總RNA。RT反應程序:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,置冰上冷卻,-20 ℃保存。
PCR總反應體系20.00 μL,其中1.00 μL Taqman 590,1.33 μL RT反應標本,10.00 μL TaqMan 2*Universal PCR Master Mix,7.67 μL 無核酸酶水。反應程序:95 ℃ 10 min熱啟動;95 ℃ 15 s,60 ℃ 1 min擴增40個循環;每次PCR均設去離子水為模板的陰性對照。
1.2.3TGF-β1誘導后細胞中miRNA-129-5p及EMT標志物表達的變化 將對照組小鼠膽管上皮細胞進行體外分離,并進行傳代培養,流式細胞儀鑒定分離培養的膽管上皮細胞。待細胞長至80%融合時進行消化,加培養基終止后,用血球計數板行細胞計數,調節細胞濃度為1×105/mL接種到6孔培養板。待細胞長至約70%~80%融合時,進行干預實驗。
提取5 ng/mL TGF-β1刺激后,分別于0、12、24、48和72 h通過RT-PCR及Western blot檢測膽管上皮細胞中miRNA-129-5p、FMNL2、Vimentin蛋白、E-cadherin、細胞角蛋白-19(CK-19)的表達。
1.2.4通過細胞轉染技術過表達miRNA-129-5p,檢測膽道EMT的變化
1.2.4.1分組 (1)空白組:TGF-β1干預終濃度為5 ng/mL,刺激時間為48 h;(2)干預組:預先用50 nmol/L的pre-miRNA-129-5p干預24 h后,再以5 ng/mL的TGF-β1對細胞進行48 h刺激;(3)陰性干預組:預先用50 nmol/L的pre-mir陰性對照干預24 h后,再以5 ng/mL的TGF-β1對細胞進行48 h刺激。
1.2.4.2細胞轉染 按LipofectamineTM2000說明書進行細胞轉染。轉染前1 d,接種適當數量膽管上皮細胞至6孔板中,每孔加入不含抗菌藥物的DMEN完全培養基2 mL,使轉染時細胞密度能達到30%~50%。將pre-mir-lip2000混合物加入含有細胞及細胞培養液的6孔板中,搖動混合。同時以等量opti-MEMI低血清培養基設置空白對照孔。將6孔板置于5% CO2,37 ℃孵育6 h后換成DMEM完全培養基,孵育24 h后換液。
1.2.4.3免疫熒光法檢測EMT相關蛋白的表達變化 從孵化器和蓋玻片取出6孔板,預冷的磷酸鹽緩沖溶液(PBS)洗10次。吸取多余的液體,用4%多聚甲醛2 mL室溫下固定10~15min。吸干固定液,加入滲透液(0.1% TritonX-100/PBS)室溫孵育10 min。吸干滲透液,置于搖床PBS清洗3次,每次5 min。吸干封閉液,加E-cadherin(1∶30稀釋)、CK-19(1∶50稀釋)、FMNL2(1∶30稀釋)、Vimentin(1∶50稀釋),室溫下置于搖床上孵育1 h后置于4 ℃孵育過夜,孵育在濕盒內進行。吸出一抗稀釋液,置于搖床上PBS清洗3次,每次5 min。滴加異硫氰酸熒光素(FITC)標價的二抗,室溫避光孵育30 min;Hoechst33258染核10 min。吸出二抗稀釋液,置于搖床上PBS清洗3次,每次5 min。Fluoro-gel Ⅲ封片,于熒光顯微鏡下觀察并且拍照。激光掃描共聚焦顯微鏡檢測FMNL2、Vimentin、E-cadherin和CK-19的表達。
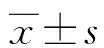
2 結 果
2.1小鼠肝臟HE染色特點的結果 對照組中小鼠肝臟HE染色未見明顯異常;實驗組小鼠肝臟明顯黃染發暗,質地明顯發硬,表面呈顆粒狀,同時膽囊萎縮,而肝外膽道呈閉鎖或索條狀狹窄。HE結果顯示,大量的炎性細胞浸潤肝內門脈系統,伴有明顯的肝內膽汁淤積,同時有點片狀壞死,見圖1。

A.正常膽管,正常肝臟匯管區炎性細胞極少;B.膽管呈閉鎖狀態,內皮細胞破壞,不規則增生,伴炎性細胞浸潤,肝臟中可見匯管區炎性細胞明顯浸潤
圖1小鼠肝臟HE染色(×100)
2.2各組小鼠膽道組織中miRNA-129-5p的表達 與對照組比較,miRNA-129-5p在實驗組小鼠膽道上皮組織中的表達顯著降低(P<0.01),見圖2。

圖2 兩組小鼠膽道組織中miRNA-129-5p的相對表達水平
2.3TGF-β1誘導后細胞中miRNA-129-5p及EMT標志物表達變化 TGF-β1誘導后膽道上皮細胞中miRNA-129-5p的表達水平呈時間依賴性下降,見圖3。

圖3 TGF-β1誘導后小鼠膽道組織中miRNA-129-5p各個時間點的相對表達水平變化
2.4TGF-β1誘導后各組細胞中EMT標志物表達變化 TGF-β1誘導后膽道上皮細胞FMNL2及Vimentin的蛋白表達水平隨時間增加逐漸增高,24 h的mRNA水平與之前時間點比較,差異有統計學意義(P<0.05),E-cadherin及CK-19的蛋白表達水平隨誘導時間增加逐漸降低,12 h的mRNA水平與之前時間點比較,差異有統計學意義(P<0.01),見圖4、5。

圖4 TGF-β1誘導后各時間點EMT標志物的表達水平

a:P<0.05
圖5 TGF-β1誘導后小鼠膽道組織>EMT標志物的表達水平
2.5過表達miRNA-129-5p后膽道上皮細胞的EMT標志物變化 空白組與陰性干預組在TGF-β1誘導48 h后FMNL2、Vimentin、E-cadherin、CK-19的表達水平差異無統計學意義(P>0.05),而干預組FMNL2、Vimentin的表達下調(P<0.01),E-cadherin及CK-19表達水平明顯上調(P<0.05),見圖6。

圖6 過表達miRNA-129-5p后小鼠膽道EMT標志物48 h免疫熒光圖(×400)
3 討 論
膽道閉鎖是嬰兒期累及肝內外膽管、最終導致終末期肝硬化的嚴重肝臟疾病,其特點為膽管進行性的炎癥、纖維化,并最終消失形成膽道閉鎖。
EMT是指分化成熟的極化上皮細胞喪失上皮/內皮細胞特征,向間充質細胞轉化,使其具有更大的活性和遷移性。EMT很可能參與了膽道閉鎖中多發性硬化性膽管炎的病理機制。
TGF-β1在體內外各種上皮細胞和組織纖維化過程中介導EMT的發生。目前,部分miRNA已被證實在TGF-β1誘導的EMT中發揮關鍵作用,miRNA可能成為新的治療各種慢性病的靶點。有研究發現miRNA-129-5p與EMT的過程密切相關,在心臟、肝臟、肺、皮膚纖維化的過程中,miRNA-129-5p的表達是下調的。
體內外轉染miRNA的前體,如pre-miRNA、pre-mir,以增強相應miRNA的作用,是當前最容易實現的miRNA干擾技術。本課題組通過5 ng/mL的TGF-β1的終濃度干預誘導膽道上皮細胞進一步纖維化,從細胞水平模擬膽道閉鎖的形成。同時進行EMT標志物的檢測,證實了TGF-β1誘導下細胞EMT的形成,miRNA-129-5p的表達隨時間延長逐漸下調。隨后轉染了pre-miRNA-129-5p以上調miRNA-129-5p的表達,并轉染了一段隨機并不會在體內產生任何影響的序列pre-mir作為陰性對照,再給予膽管上皮細胞TGF-β1刺激,檢測轉分化相關指標及細胞外基質成分的變化。結果發現過表達miRNA-129-5p后,膽道上皮細胞標志物E-cadherin、CK-19表達有所上調,而間充質細胞標志物Vimentin、FMNL2表達水平均有所下調,說明上調miRNA-129-5p的表達可以抑制TGF-β1誘導的膽道上皮EMT。這一結果提示miRNA-129-5p可能通過調節TGF-β1通路相關靶基因表達,參與調控膽道上皮細胞轉分化及細胞外基質沉積。在膽道閉鎖EMT進程中起著關鍵的作用。
[1]HARADA K.Sclerosing and obstructive cholangiopathy in biliary atresia:mechanisms and association with biliary innate immunity[J].Pediatr Surg Int,2017,33(12):1243-1248.
[2]HSU Y A,LIN C H,LIN H J,et al.Effect of microRNA-155 on the interferon-gamma signaling pathway in biliary atresia[J].Chin J Physiol,2016,59(6):315-322.
[3]YE Y,LI Z,FENG Q,et al.Downregulation of microRNA-145 may contribute to liver fibrosis in biliary atresia by targeting ADD3[J].PLoS One,2017,12(9):e0180896.
[4]GOLDMAN M,PRANIKOFF T.Biliary disease in children[J].Curr Gastroenterol Rep,2011,13(2):193-201.
[5]MA N,CHEN F,SHEN S L,et al.MiRNA-129-5p inhibits hepatocellular carcinoma cell metastasis and invasion via targeting ETS1[J].Biochem Biophys Res Commun 2015,461(4):618-623.
[6]ZHANG J,LI S,YAN Q,et al.Interferon-β induced miRNA-129-5p down-regulates HPV-18 E6 and E7 viral gene expression by targeting SP1 in cervical cancer cells[J].PLoS One,2013,8(12):e81366.
[7]DONG R,SHEN Z,ZHENG C,et al.Serum microRNA microarray analysis identifies miR-4429 and miR-4689 are potential diagnostic biomarkers for biliary atresia[J].Sci Rep,2016,16(6):21084.
[8]GOLDSCHMIDT I,THUM T,BAUMANN U.Circulating miR-21 and miR-29a as markers of disease severity and etiology in cholestatic pediatric liver disease[J].J Clin Med,2016,5(3):e28.
[9]SHAN Y,SHEN N,HAN L,et al.MicroRNA-499 Rs3746444 polymorphism and biliary atresia[J].Dig Liver Dis,2016,48(4):423-428.
[10]楊瑛,湯紹濤,曹國慶,等.L-12P35,P40和IFN-γ在膽道閉鎖小鼠模型肝臟組織中的表達[J].臨床小兒外科雜志,2008,7(6):26-29.

