MEK1/2抑制劑PD98059對ox-LDL誘導HUVEC損傷的保護機制及對LOX-1表達影響*
孫 珊,胡紅玲,段曉宇,吳欽欽,賀映俠,卜曉芬,明小燕,嚴鳳琴,朱 虹
(華中科技大學同濟醫學院附屬武漢中心醫院綜合二科,武漢 430022)
氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)對內皮細胞、平滑肌細胞等有毒性作用,能夠破壞細胞完整性,損壞內皮細胞的屏障保護功能[1-4]。低密度脂蛋白受體-1(lectin-like oxidized low density lipoprotein receptor-1,LOX-1)能夠與ox-LDL特異性結合促進一系列信號通路的激活,誘導內皮細胞發生炎性損傷[5]。干擾LOX-1的表達可以通過激活RhoA/Rho信號來抑制ox-LDL引起的內皮細胞損傷[6]。在人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVEC)中抑制MEK1/2信號通路可以顯著降低脂多糖誘導的細胞損傷[7-8]。本研究應用ox-LDL誘導HUVEC產生損傷,探究PD98059抑制MEK1/2信號通路是否可以通過調節LOX-1的表達以抑制ox-LDL對HUVEC產生的損傷,現報道如下。
1 材料與方法
1.1細胞和試劑 人HUVEC株購自美國典型菌種保藏中心(ATCC),DMEM高糖培養基及胎牛血清(fetal bovine serum,FBS)購自美國Gibco公司,四甲基偶氮唑藍(methyl thiazolyl tetrazolium,MTT)干粉和二甲亞砜(dimethyl sulfoxide,DMSO)購自美國Sigma公司,MEK抑制劑PD98059購自美國Invivgon公司,MEK1/2抗體購自美國Cell signaling technology公司,LOX-1抗體(ab126538)、RhoA抗體(ab54835)、ROCK1抗體(ab45171)和ROCK2抗體(ab71598)購自英國Abcam公司,RNA提取試劑Trizol裂解液和反轉試劑盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)購自中國大連Takara生物公司,蛋白濃度測定BCA試劑盒購自武漢Bio-swamp公司,RIPA蛋白裂解試劑盒購自中國碧云天生物公司,聚肌苷酸購自中國辰璽生物科技公司;一氧化氮(NO)檢測試劑盒購自碧云天生物公司,ELISA試劑盒購自武漢Bio-swamp公司。
1.2方法
1.2.1細胞培養和分組 HUVEC培養于含10% FBS的DMEM高糖培養基中,置于5% CO2的37 ℃培養箱中孵育;然后使用0.3%的胰酶消化并進行傳代培養,以對數生長期細胞作為實驗材料分為陰性對照組(普通培養基培養)、ox-LDL組(培養基中加入終濃度為50 μg/mL的ox-LDL)、陽性對照組(培養基中加入終濃度為250 μg/mL的聚肌苷酸及終濃度為50 μg/mL的ox-LDL)和PD98059+ox-LDL組(培養基中加入終濃度為50 μmol/L PD98059和終濃度為50 μg/mL的ox-LDL),所有細胞均培養72 h。
1.2.2反轉錄PCR檢測LOX-1 mRNA水平 采用Trizol裂解液提取細胞RNA,并測定RNA的質量和濃度。取1 μg RNA使用反轉錄試劑盒進行cDNA合成。LOX-1上游引物:5′-ACT CTC CAT GCT GCT GCC TGG-3′,下游引物:5′-CAT TCA GCT TCC GAA CAA GGG-3′;β-actin上游引物:5′-GAC CAC AGT CCA TGC CAT CAC-3′,下游引物5′-GTC CAC CAC CCT GTT GCT GTA-3′。反轉錄PCR 反應體系為20 μL (2×SYBR Premix Ex TaqTM9 μL,模板1 μL,上游引物和下游引物各0.5 μL,H2O 9 μL),95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,72 ℃ 20 s,40個循環。
1.2.3MTT法檢測細胞增殖 使用含10% FBS的DMEM培養基將培養24、48和72 h后的HUVEC重懸成單個細胞懸液,將細胞密度調整為1×104個/mL,并將細胞懸液接種于96孔板中,每孔加MTT 溶液(5 mg/mL) 20 μL,于37 ℃,5% CO2培養箱中培養4 h后,離心并去除上清液。每孔加入100 μL DMSO,充分震蕩至使晶體充分溶解;酶標儀檢測波長為490 nm時各組的吸光度(OD)值,并以時間為橫坐標,OD值為縱坐標繪制細胞生長曲線。
1.2.4Western blot檢測MEK1/2、RhoA、ROCK1和ROCK2蛋白水平 使用磷酸緩沖鹽溶液(PBS)沖洗細胞2次并用細胞裂解液裂解。使用BCA試劑盒測定蛋白濃度。各組取等量蛋白(30 μg)進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)電泳,隨后將表達產物電轉移至聚偏二氟乙烯(PVDF)膜上室溫環境反應2 h;5%脫脂牛奶封閉膜1 h后在4 ℃環境中加一抗孵育過夜;用PBS-Tween洗滌3次,加二抗室溫孵育1 h。以β-actin作為內參,使用BandScan5.0 軟件進行圖像的分析。
1.2.5ELISA檢測細胞培養液中炎性因子腫瘤壞死因子-α(TNF-α)和白細胞介素-6(IL-6)水平 收集各組細胞培養液,嚴格按照ELISA試劑盒說明書進行檢測培養液中的TNF-α和IL-6水平。
1.2.6硝酸還原法檢測細胞培養液中NO水平 收集細胞培養液,嚴格按照試劑盒說明書進行HUVEC培養液中NO水平的檢測。
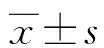
2 結 果
2.1各組HUVEC中LOX-1表達的變化 ox-LDL組LOX-1 mRNA表達水平顯著高于陰性對照組(P<0.05),陽性對照組和PD98059+ox-LDL組LOX-1的mRNA水平與ox-LDL組比較顯著降低(P<0.05)。使用Western blot進行LOX-1的蛋白表達分析,ox-LDL組顯著高于陰性對照組,且PD98059+ox-LDL組的LOX-1蛋白水平顯著低于ox-LDL組(P<0.05),見圖1。

A:各組LOX-1 mRNA表達情況;B:Western blot結果;C:各組LOX-1蛋白表達情況;a:P<0.05,與陰性對照組比較;b:P<0.05,與ox-LDL組比較

圖1 各組LOX-1表達變化
a:P<0.05,與陰性對照組比較;b:P<0.05,與ox-LDL組比較
2.2各組HUVEC增殖能力變化 與陰性對照組比較,各組增殖能力受到顯著抑制(P<0.05)。與ox-LDL組比較,陽性對照組和PD98059+ox-LDL組增殖能力得到顯著的提高(P<0.05),見表1。
2.3各組HUVEC中MEK1/2、RhoA、ROCK1和ROCK2蛋白表達水平 與陰性對照組比較,ox-LDL組MEK1/2、RhoA、ROCK1和ROCK2蛋白表達水平顯著升高(P<0.05);與ox-LDL組比較,陽性對照組和PD98059+ox-LDL組中MEK1/2、RhoA、ROCK1和ROCK2蛋白表達水平顯著降低(P<0.05),見圖2。

a:P<0.05,與陰性對照組比較;b:P<0.05,與ox-LDL組比較
圖2各組信號通路相關蛋白的變化
2.4各組HUVEC中TNF-α和IL-6水平變化 與陰性對照組比較,ox-LDL組TNF-α和IL-6水平顯著升高(P<0.05);與ox-LDL組比較,陽性對照組和PD98059+ox-LDL組HUVEC中的TNF-α和IL-6水平顯著降低(P<0.05),見圖3。

a:P<0.05,與陰性對照組比較;b:P<0.05,與ox-LDL組比較
圖3各組TNF-α(A)和IL-6(B)水平變化
2.5各組HUVEC培養液中NO水平變化 與陰性對照組比較,ox-LDL組NO水平顯著下降(P<0.05);與ox-LDL組比較,陽性對照組和PD98059+ox-LDL組NO水平上升(P<0.05),見圖4。

a:P<0.05,與陰性對照組比較;b:P<0.05,與ox-LDL組比較
圖4各組NO水平變化
3 討 論
LOX-1是一種在內皮細胞、巨噬細胞和血管平滑肌細胞中大量表達的ox-LDL受體,屬于C型凝集素家族Ⅱ型膜蛋白[9]。LOX-1可以通過與ox-LDL特異性結合誘導內皮細胞分泌和釋放大量細胞黏附分子,促進單核細胞與活化的內皮細胞之間黏附和聚集,這是誘發動脈粥樣硬化的主要因素[10-11]。本研究發現ox-LDL可以誘導HUVEC中MEK1/2和RhoA/ROCK信號通路活化,促進炎性因子的釋放[12-13]。HUANG等[14]研究表明四甲基吡嗪可以通過抑制ox-LDL誘導的MAPK信號通路激活,保護ox-LDL引起的內皮細胞損傷從而達到緩解動脈粥樣硬化的發展。MAPK是細胞內重要的信號傳遞和轉導通路,可以通過信號轉導將細胞外刺激轉移到細胞內,在細胞的生長、分化和增殖中發揮重要調節作用[14]。MEK1/2是MAPK信號通路中的重要家族之一,在細胞應激和炎性反應中具有重要作用[15]。已有多項研究證明PD98059能夠與MEK1/2的非活化形式特異性結合阻止其磷酸化的發生,從而阻斷ERK1/2信號轉導[16-17]。RhoA/Rho激酶信號通路在內皮功能障礙、炎癥、氧化應激、血管張力異常和血管重塑等多種血管疾病中具有重要作用[6]。本研究發現抑制MEK1/2信號通路能夠通過降低LOX-1的表達抑制ox-LDL誘導的MEK1/2和RhoA/ROCK信號通路激活。黃起壬等[8]在探究脂多糖對HUVEC作用的研究中也證實抑制MEK1/2信號通路可以降低脂多糖誘導的HUVEC中ICAM-1的上升,從而抑制脂多糖誘導的HUVEC損傷。
NO具有舒張血管的作用,可以通過抑制平滑肌細胞增殖及血小板的聚集,降低白細胞的黏附作用,具有減輕動脈粥樣硬化的作用[18]。研究表明氨氯地平可以抑制ox-LDL誘導的NO合酶下調,從而促進NO的合成,降低ox-LDL引起的內皮細胞損傷[19]。本研究中抑制MEK1/2信號通路可以通過降低NO和炎性因子的釋放抑制ox-LDL誘導的內皮細胞損傷。姜華等[20]研究中藥對脂多糖誘導HUVEC中炎性因子表達,表明降低HUVEC中的LOX-1和TNF-α可以有效緩解ox-LDL誘導的HUVEC損傷。
綜上所述,本研究通過體外細胞實驗證實PD98059抑制MEK1/2信號通路可以降低ox-LDL特異性受體LOX-1的表達,從而抑制RhoA/ROCK信號通路及降低炎性因子TNF-α和IL-6的釋放,促進HUVEC的增殖及NO的合成,從而抑制ox-LDL誘導的內皮細胞損傷,為臨床治療動脈粥樣硬化提供理論基礎。
[1]XU L,WANG S,LI B,et al.A protective role of ciglitazone in ox-LDL-induced rat microvascular endothelial cells via modulating PPARγ-dependent AMPK/eNOS pathway[J].J Cell Mol Med,2015,19(1):92-102.
[2]CHEN X,PANG S,LIN J,et al.Allicin prevents oxidized low-density lipoprotein-induced endothelial cell injury by inhibiting apoptosis and oxidative stress pathway[J].BMC Complement Altern Med,2016,16(1):1-6.
[3]CHANA R S,WHEELER D C.Fibronectin augments monocyte adhesion to low-density lipoprotein-stimulated mesangial cells[J].Kidney Int,1999,55(1):179-188
[4]何平平,歐陽新平,唐艷艷,等.甘油三酯水平升高與動脈粥樣硬化性心血管疾病的關系的研究新進展[J].中國動脈硬化雜志,2013,21(10):951-954.
[5]薛莉,單江,陳乃云,等.氧化型低密度脂蛋白誘導LOX-1在基因和蛋白水平表達[J].科技通報,2004,20(6):552-559.
[6]劉洪光,陶貴周,李俊,等.RNA干擾LOX-1表達對氧化型低密度脂蛋白誘導人臍靜脈內皮細胞損傷的保護機制[J].中國動脈硬化雜志,2014,22(9):891-896.
[7]NISHIMOTO S,NISHIDA E.MAPK signalling:ERK5 versus ERK1/2[J].Embo Rep,2006,7(8):782-786.
[8]黃起壬,陳和平,劉丹,等.MEK1/2在脂多糖誘導人臍靜脈內皮細胞ICAM-1表達中的作用[J].中國病理生理雜志,2005,21(12):2320-2323.
[9]李萍,盛志業,馬小峰,等.LOX-1在ox-LDL誘導人腎小球系膜細胞表達TGF-β1中的作用[J].沈陽部隊醫藥,2006,19(3):160-172.
[10]SMIRNOVA I V,SAWAMURA T,GOLIGORSKY M S.Upregulation of lectin-like oxidized low-density lipoprotein receptor-1 (LOX-1) in endothelial cells by nitric oxide deficiency[J].Am J Physiol Renal Physiol,2004,287(1):25-32.
[11]UJIHARA N,SAKKA Y,TAKEDA M,et al.Association between plasma oxidized low-density lipoprotein and diabetic nephropathy[J].Diabetes Res Clin Pract,2002,58(2):109-114.
[12]ZHANG Y,MU Q,ZHOU Z,et al.Protective effect of irisin on atherosclerosis via suppressing oxidized low density lipoprotein induced vascular inflammation and endothelial dysfunction[J].PLoS One,2016,11(6):e0158038.
[13]ZHANG Z,ZHANG D,DU B,et al.Hyperoside inhibits the effects induced by oxidized low-density lipoprotein in vascular smooth muscle cells via oxLDL-LOX-1-ERK pathway[J].Mol Cell Biochem,2017,433(1):169-176.
[14]HUANG W C,TU R S,CHEN Y L,et al.Conjugated linoleic acids suppress inflammatory response and ICAM-1 expression through inhibition of NF-κB and MAPK signaling in human bronchial epithelial cells[J].Food Funct,2016,7(4):2025-2033.
[15]MISALE S,ARENA S,LAMBA S,et al.Blockade of EGFR and MEK intercepts heterogeneous mechanisms of acquired resistance to anti-EGFR therapies in colorectal cancer[J].Sci Transl Med,2014,6(224):224ra26.
[16]WU J,WONG W L,KHOSRAVI F,et al.Blocking the Raf/MEK/ERK pathway sensitizes acute myelogenous leukemia cells to lovastatin-induced apoptosis[J].Cancer Res,2004,64(18):6461-6468.
[17]鄭繼軍,王閣,鄧婧,等.PD98059對肝癌HepG2細胞Tec信號轉導作用的初步研究[J].第三軍醫大學學報,2006,28(2):136-139.
[18]吳淳淳,杜心清.內皮型一氧化氮合酶與冠心病的研究進展[J].醫學綜述,2013,19(10):1756-1758.
[19]劉慧婷,楊簡,童海,等.氨氯地平對ox-LDL致大鼠骨髓EPCs損傷的保護作用與上調一氧化氮合酶表達有關[J].中南醫學科學雜志,2011,39(2):139-143.
[20]姜華,姜玉姬.3種中藥復方血清對脂多糖誘導的人臍靜脈內皮細胞炎癥因子LOX-1、TNF-α、VCAM-1和ICAM-1表達的影響[J].中國動脈硬化雜志,2015,23(10):985-988.

