CXCL12、CXCR4、MVD在多發性骨髓瘤骨髓微龕中表達及意義*
周 俊,葉 麗,林凡莉,汪姝玥,李曉明,黃純蘭△
(1.西南醫科大學臨床醫學院,四川瀘州 646000;2.西南醫科大學附屬醫院血液內科,四川瀘州 646000)
多發性骨髓瘤(multiple myeloma,MM)居血液系統惡性腫瘤第2位,目前仍是臨床無法治愈的疾病。MM以骨髓微龕中瘤型漿細胞克隆、增殖,血液、尿液中單克隆蛋白增多為主要特點,終末器官損害主要表現為貧血、腎功能不全、骨痛、高鈣血癥等[1-3]。趨化因子配體12(CXCL12)及趨化因子受體4(CXCR4)形成CXCL12/CXCR4生物軸在多種腫瘤中發現,能夠促進腫瘤細胞的生長,抑制腫瘤細胞的凋亡,促進腫瘤血管生成,影響某些腫瘤的靶向轉移,增強腫瘤細胞的黏附和遷移能力,影響腫瘤細胞的分泌行為等[4-7],其在MM中的作用機制有待進一步研究,本研究通過測定MM患者骨髓活檢組織中CXCL12、CXCR4、微血管密度(microvessel density,MVD)的表達、分布,以研究其在MM中表達并對臨床意義進行討論,現報道如下。
1 資料與方法
1.1一般資料 選擇2013年1月至2016年7月西南醫科大學附屬醫院血液科收治的MM患者63例作為試驗組,其中男34例,女29例,平均年齡(59.73±8.85)歲,MM分期Ⅰ期7例,Ⅱ期14例,Ⅲ期42例,免疫球蛋白分型輕鏈型11例,IgG型33例,IgA型19例,血清輕鏈分型λ型26例,κ型37例。所有患者均符合中國MM診治指南(2015年修訂)中MM診斷標準[8]。選擇同期健康人42例作為對照組,其中男20例,女22例,平均年齡(60.20±13.37)歲。
1.2方法
1.2.1檢測方式 用免疫組織化學SP法,檢測試驗組、對照組骨髓活檢組織標本中CXCL12、CXCR4及MVD的表達。收集骨髓活檢組織蠟塊4 μm厚連續切片,依次行脫蠟水化、抗原修復、一抗、二抗孵育、二氨基聯苯胺(DAB)顯色、蘇木精復染、分化-封片、鏡檢、拍照。用已知陽性切片做陽性對照,以磷酸緩沖鹽溶液(PBS)代替一抗做陰性對照。并收集兩組性別、年齡、臨床分期、免疫球蛋白、輕鏈分型臨床資料,將上述資料進行統計學相關分析。
1.2.2結果判定 骨髓組織細胞的細胞質和細胞膜內出現棕黃色著色顆粒為CXCL12和CXCR4陽性細胞,結果評價用SP法染色強度(陽性)和陽性細胞百分比確定。隨機觀察10個高倍視野(×400),每個視野計數100個細胞,根據其中陽性細胞所占百分比和染色強度分別進行評分,最后綜合評定結果。(1)陽性細胞所占百分比評分:<10%為0分,10%~25%為1分,>25%~50%為2分,>50%為3分。(2)染色強度評分:無染色為0分,淡黃色為1分,淡黃色至黃色為2分,黃色至棕黃色為3分。(3) 結果判斷:染色強度和陽性細胞分值之和為最終分值。總積分0~1分為陰性(-),2~3分為弱陽性(+),4~5分為中強陽性(++),6分及以上為強陽性(+++)。細胞質出現棕黃色著色顆粒為MVD陽性細胞,首先形態學觀察:在低倍光學顯微鏡下(×100)判斷骨髓病理切片的取材、染色是否成功,骨髓增生程度,微血管分布情況;高倍鏡下(×400)觀察內皮細胞、微血管形態,并進行微血管計數。骨髓MVD計數:對每張切片進行 MVD 計數。首先在低倍鏡下(×100)進行逐個視野的觀察,至少選出 3 個血管最豐富且不相連的熱點區域,然后在高倍鏡下(×400)計數微血管,共計數 3 次,取其平均值表示 MVD。任何呈棕黃色的能夠計數的血管,不以是否有管腔或管腔中是否有紅細胞作為判斷標準,骨小梁內或與骨小梁相連的血管被排除在外。
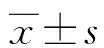
2 結 果
2.1CXCL12、CXCR4和MVD染色情況 CXCL12、CXCR4蛋白表達陽性染色位于骨髓細胞細胞質,染色顆粒呈淺黃色或棕黃色;MVD蛋白表達陽性染色位于細胞膜,見圖1~3。
A:對照組骨髓中細胞染色呈黃色,細胞散在表達,呈弱陽性;B:試驗組骨髓中細胞彌漫表達,呈棕黃色,呈強陽性
圖1兩組骨髓中CXCL12染色(×400)

A:對照組骨髓中細胞染色呈黃色,細胞散在表達,呈弱陽性;B:試驗組骨髓中細胞彌漫表達,呈棕黃色,呈強陽性
圖2兩組骨髓中CXCR4染色(×400)

A:對照組骨髓顯示微小血管形態規則,結構良好;B:試驗組骨髓顯示微血管明顯增多,微血管形態不規則,大小不一;C:試驗組骨髓可見單個內皮細胞,內皮細胞團簇,甚至成線狀排列未見明顯管腔

圖3 兩組骨髓中MVD染色(×400)
2.2CXCL12、CXCR4和MVD蛋白表達情況 試驗組骨髓CXCL12、CXCR4和MVD表達明顯高于對照組,差異有統計學意義(P<0.05)。MM患者骨髓CXCL12、CXCR4和MVD的表達與患者性別、年齡、免疫球蛋白、輕鏈分型表達差異無統計學意義(P>0.05)。
2.3相關性分析結果 MM的骨髓CXCL12表達與CXCR4、MVD表達均呈正相關,見表1。
3 討 論
MM是骨髓中漿細胞呈惡性克隆的增殖性疾病,可累及骨髓、血液、腎臟等多個靶器官,骨髓微環境也受漿細胞影響發生相應變化。諸多學者就分子、因子等多方面對MM微環境改變、血管生成機制等進行研究[9-14]。
CXCL12又稱基質細胞衍生因子-1(SDF-1),屬于CXC族趨化因子成員,對骨髓基質細胞、T淋巴細胞、單核細胞、中性粒細胞、樹突狀細胞等均有趨化作用,而這些細胞也都表達CXCR4。CXCR4是CXCL12的特異受體,是由352個氨基酸組成的G蛋白偶聯受體。CXCL12/CXCR4生物軸在調節腫瘤的發生、發展、侵襲、轉移、血管生成中具有重要作用[15-19]。MM細胞可表達CXCR4,CXCL12 與 CXCR4 相互作用,趨化MM細胞的遷移和定居在骨髓微環境[20-21]。本研究試驗組CXCL12、CXCR4的表達較對照組明顯增加,與以上觀點相符合,CXCL12、CXCR4與MM的發生相關,因此推測CXCL12/CXCR4生物軸在MM發病機制中具有重要作用。此外,該生物軸與骨髓微環境中血管新生具有密切關系。CXCL12/CXCR4生物軸可通過促進血管內皮生長因子(VEGF)分泌促進血管生成[22-25]。既往多項研究表明血管新生與惡性血液病發生、演變、預后密切相關[26-27]。MM骨髓活檢中MVD明顯高于對照組,表明血管新生與MM的發生有明顯關系。腫瘤的發生、發展有賴于新生血管的形成,而CXCL12/CXCR4與血管新生過程密切相關[28]。在腫瘤缺氧環境下,由缺氧因子誘導,VEGF大量表達,CXCL12表達也明顯升高。ECONOMIDOU等[29]研究發現CXCL12/CXCR4在惡性胸腔積液中高度表達,并發現CXCL12與VEGF呈正相關,因此認為CXCL12上調VEGF的表達,促進血管新生。本研究表明,MM組骨髓CXCL12/CXCR4的表達與MVD的表達呈正相關,故推測MM骨髓微環境中CXCL12/CXCR4生物軸可促進血管新生,因此可認為抑制CXCL12/CXCR4在微血管形成的作用會成為抗腫瘤治療的新途徑。
綜上所述,骨髓微環境中血管新生機制可能成為治療MM的新靶點,通過抑制CXCL12/CXCR4生物軸抗血管新生可為MM的發病機制及尋找有效的診斷和治療提供新的途徑。
[1]MATEOS M V,OCIO E M,PAIVA B,et al.Treatment for patients with newly diagnosed multiple myeloma in 2015[J].Blood Rev,2015,29(6):387-403.
[2]KYLE R A,RAJKUMAR S V.Multiple myeloma[J].N Engl J Med,2004,351(18):1860-1873.
[3]MOREAU P,SAN M J,LUDWIG H,et al.Multiple myeloma:ESMO clinical practice guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2013,24(suppl 5):vi133-137.
[4]RUBIE C,KOLLMAR O,FRICK V O,et al.Differential CXC receptor expression in colorectal carcinomas[J].Scand J Immunol,2008,68(6):635-644.
[5]RUBIE C,FRICK V O,WAGNER M,et al.Chemokine expression in hepatocellular carcinoma versus colorectal liver metastases[J].World J Gastroenterol,2006,12(41):6627-6633.
[6]MIYANISHI N,SUZUKI Y,SIMIZU S,et al.Involvement of autocrine CXCL12/CXCR4 system in the regulation of ovarian carcinoma cell invasion[J].Biochem Biophys Res Commun,2010,403(1):154-159.
[7]DO C A,PATRICO I,CURZ M T,et al.CXCL12/CXCR4 promotes motility and proliferation of glioma cells[J].Cancer Biol Ther,2010,9(1):56-65.
[8]中國醫師協會血液科醫師分會,中華醫學會血液學分會,中國協會醫師MM專業委員會.中國MM診治指南(2015修訂)[J].中華內科雜志,2015,54(12):1066-1070.
[9]PAPADAS A,ASIMAKOPOULOS F.Mechanisms of resistance in multiple myeloma[M].Handbook of Experimental Pharmacology,Springer,Berlin,Heidelberg,2017:1-38.
[10]CIAVARELLA S,LAURENZANA A,DE S S,et al.u-PAR expression in cancer associated fibroblast:new acquisitions in multiple myeloma progression[J].BMC Cancer,2017,17(1):215.
[11]ZHAO P,CHEN Y,YUE Z,et al.Bone marrow mesenchymal stem cells regulate stemness of multiple myeloma cell lines via BTK signaling pathway[J].Leuk Res,2017(57):20-26.
[12]RIBATTI D,VACCA A.Role of endothelial cells and fibroblasts in multiple myeloma angiogenic switch[J].Cancer Treat Res,2016(169):51-61.
[13]KAWANO Y,MOSCHETTA M,MANIER S,et al.Targeting the bone marrow microenvironment in multiple myeloma[J].Immunol Rev,2015,263(1):160-172.
[14]RIBATTI D,NICO B,VACCA A.Multiple myeloma as a model for the role of bone marrow niches in the control of angiogenesis[J].Int Rev Cell Mol Biol,2015(314):259-282.
[15]OOI L L,DUNSTAN C R.CXCL12/CXCR4 axis in tissue targeting and bone destruction in cancer and multiple myeloma[J].J Bone Miner Res,2009,24(7):1147-1149.
[16]DE N F,SCHIANO C,INFANTE T,et al.CXCR4 inhibitors:tumor vasculature and therapeutic challenges[J].Recent Pat Anticancer Drug Discov,2012,7(3):251-264.
[17]DIAMOND P,LABRINIDIS A,MARTIN S K,et al.Targeted disruption of the CXCL12/CXCR4 axis inhibits osteolysis in a murine model of myeloma-associated bone loss[J].J Bone Miner Res,2009,24(7):1150-1161.
[18]BROMAGE D I,TAFEMER S,PILLAI M,et al.A novel recombinant antibody specific to full-length stromal derived factor-1 for potential application in biomarker studies[J].PLoS One,2017,12(4):e0174447.
[19]LIANG Z,BROOKS J,WILLARD M,et al.CXCR4/CXCL12 axis promotes VEGF-mediated tumor angiogenesis through AKT signaling pathway[J].Biochem Biophys Res Commun,2007,359(3):716-722.
[20]SANZ-RODRIGUEZ F,HIDALGO A,TEIXIDO J.Chemokine stromal cell-derived factor-1 alphamodulates VLA-4 integrin-mediated multiple myeloma cell adhesion to CS-1 fibronectin and VCAM-1[J].Blood,2001,97:346-351.
[21]HIDESHIMA T,CHAUHAN D,HAYASHI T,et al.The biological sequelae of stromal cell-de-rived factor-1 alpha in multiple myeloma[J].MolCancer Ther,2002,1(7):539-544.
[22]KIJOWSKI J,BAJ-KRZYWORZEKA M,MAJKA M,et al.The SDF-1-CXCR4 axis stimulates VEGF secretion and activates integrins but does not affect proliferation and survival in lympho-hematopoietic cells[J].Stem Cells 2001,19(5):453-466.
[23]DARASH-YAHANA M,PIKARSKY E,ABRAMOVITH R,et al.Role of high expression levels of CXCR4 in tumor growth,vascularization,and metastasis[J].FASEB J,2004,18(11):1240-1242.
[24]DEKKER L V,SEGAL A W.Perspectives:signal transduction.Signals to move cells[J].Science,2000,287(5455):982-985.
[25]MARINACCIO C,NICO B,MAIORANO E,et al.Insights in Hodgkin lymphoma angiogenesis[J].Leuk Res,2014,38(8):857-861.
[26]GONCALVES K A,胡國富.血管生成素在造血系統惡性腫瘤中的作用及機制[J].中國生物化學與分子生物學報,2015,31(12):1267-1275.
[27]HAN Y,WANG X,WANG B.The progress of angiogenic factors in the development of leukemias[J].Intractable Rare Dis Res,2016,5(1):6-16.
[28]TANG J M,WANG J N,ZHANG L,et al.VEGF/SDF-1 promotes cardiac stem cell mobilization and myocardial repair in the infarcted heart[J].Cardiovasc Res,2011,91(3):402-411.
[29]ECONOMIDOU F,ANTONIOU K M,SOUFLA G,et al.Role of VEGF-stromal cell-derived factor-1 alpha/CXCL12 axis in pleural effusion of lung cancer[J].J Recept Signal Transduct Res,2010,30(3):154-160.

