MRI聯合MRS輔助立體定向放射治療復發高級別膠質瘤的療效觀察
梁 鴻,任明亮,姚一搏,許民輝,徐倫山
(陸軍軍醫大學大坪醫院神經外科,重慶 400042)
對于新診斷的高級別膠質瘤(high grade glioma,HGG),最大程度的手術切除聯合同步放化療已成為標準治療方案。但對于復發HGG目前還沒有標準的治療方案,可以考慮手術切除、二線化療和生物治療等。立體定向放射治療(stereotactic radiosurgery,SRS)作為一種主要依賴放射劑量特殊分布來達到殺傷膠質瘤、保護正常腦組織的精確放療手段,可以作為復發HGG的補救治療措施,考慮到容積效應,病灶的大小和治療的預后密切相關[1]。而確定病灶大小和治療靶灶首先必須較精確地明確復發HGG范圍,根據磁共振波譜分析(MRS)輔助確定病灶大小和靶區,MRS對非增強及壞死組織的范圍的確定優于磁共振(MRI),通過MRI+MRS定位對復發HGG患者實施SRS,有一定效果,現報道如下。
1 資料與方法
1.1一般資料 對2010年9月至 2013 年 9月本院神經外科進行SRS的54例復發HGG患者進行回顧分析,其中男26例,女28例,平均年齡54.3(32.0~78.0)歲。43例患者(79.6%)為膠質母細胞瘤,11例(20.4%)為WHO Ⅲ級。所有患者都接受過放療,其中48例患者接受過替莫唑胺同步化療,MRI+MRS提示復發,病灶直徑小于3 cm。分為常規定位組26例和MRI+MRS組28例。SRS治療前的卡氏(KPS)評分是82.8分(50.0~100.0分),其中36例患者KPS≥70.0分(66.7%),18例KPS>60.0~<70.0分(33.3%)。
1.2方法
1.2.1定位方法 在1.5 T或3.0 T MRI薄層平掃及增強掃描的基礎上,用MRS序列(PRESS)進行1H-MRS掃描。用OUR-XGD旋轉式伽瑪刀規劃系統進行規劃和處方劑量計算。常規定位組根據MRI增強部分及周圍短T1、長T2確定腫瘤的范圍和靶灶。MRI+MRS組根據增強病灶及周圍短T1、長T2區間MRS呈膠質瘤表現者為靶灶范圍[2]。MRS膠質瘤表現為:Cho/NAA指數(CNI)≥1.6。計劃參數:等中心數目1~8個,等劑量曲線40%~50%,中心劑量23.77(17.52~32.11)Gy,邊緣劑量16.63(13.03~26.21)Gy。
1.2.2隨訪 治療后每2~4個月進行臨床評估和MRI+MRS影像隨訪,隨訪至少1年。使用包括T2和FLAIR加權在內的RANO標準評價治療反應[3]。統計無進展生存期(PFS)、1年生存率和水腫指數。水腫指數較治療前增大10%視為有腦水腫發生,并根據水腫情況給予甘露醇和激素治療。
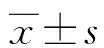
2 結 果
所有患者均按計劃完成治療,兩組年齡、性別、病理分級、KPS比較,差異無統計學意義(P>0.05)。首次SRS后平均隨訪14.8(12.0~32.0)個月。所有患者進行至少1次影像學隨訪,平均隨訪3.3(1.0~6.0)次。影像學檢查4例患者(7.4%)完全緩解,9例(16.7%)部分緩解,29例(53.7%)病情穩定,12例(22.2%)病情發展。無進展生存期為6.2 (3.0~12.6)個月。22例患者術后腦水腫,使用了甘露醇和激素。與常規定位組比較,MRI+MRS組邊緣劑量明顯增加,靶灶平均直徑更小,無進展生存期更長,1年生存率更高,而腦水腫發生情況明顯下降,差異有統計學意義(P<0.05),見表1。

表1 兩種定位方式的比較
3 討 論
HGG復發常發生在初次放射野內,對于體積較小的復發灶,再次放療、手術、藥物治療的效果并不確切[4],SRS定位準確、治療簡便、并發癥少,可以作為復發HGG患者的補救治療手段。但由于膠質瘤的生長特性以及手術、放化療的影響,根據MRI平掃和增強掃描,病灶大小范圍往往難以精確判定,如何選擇合適患者、治療靶灶如何確定,都面臨極大困難,成為影響SRS臨床應用的重要因素[5]。
臨床主要通過MRI平掃、增強掃描,短T1、長T2確定腦膠質瘤的范圍,即使在MRI影像上似有清晰邊界,但多數情況下由于腫瘤侵襲的自然特性,膠質瘤的范圍也并非腫瘤的實際范圍。立體定向活檢雖是可靠的鑒別方法,但卻因有創操作而引發其他并發癥可能。FLAIR、MRS、正電子發射計算機斷層顯像(PET-CT)、灌注成像等在腦膠質瘤范圍確定中的價值越來越受到重視。MRS是在MRI技術基礎上發展起來的,簡便易行,一次掃描就可無創性獲得腫瘤代謝的信息,并進行定量或半定量分析,且代謝能真實反映生理病理變化。研究顯示,膠質瘤有其特定的代謝特征:細胞膜磷脂代謝成分膽堿(Cho)上升,神經元內代謝物N-乙酰天門冬氨酸(NAA)下降,Cho/NAA比值明顯升高[6]。
影響SRS的效果很重要一點是瘤體直徑不能太大,一般認為不超過3 cm,受周圍重要組織耐受劑量的限制,回顧性研究表明,對于SRS,較小的病灶更有效,毒性風險也更低[7]。MRI異常T2區域比MRS顯示的代謝異常區域大,但又不能完全覆蓋代謝異常區,目前的研究發現MRS預測HGG的靈敏度和特異度較T2明顯升高[8]。利用MRS輔助判斷病灶的范圍更加精確,能夠將病變真實范圍較大(直徑大于3 cm)、可能不適合行SRS的患者排除在外。同時,明顯縮小了治療范圍,不增加腦水腫的風險和程度,有利于發揮SRS定位精確、而靶區外放射劑量下降銳利的特點,使邊緣劑量顯著增加,提高了腫瘤生長控制率,延長了生存期。
總之,本研究顯示根據MRI+MRS較單一MRI常規輔助確定病變范圍和靶灶定位,選擇腫瘤范圍相對較小的HGG復發患者,不能耐受手術及拒絕外科手術的患者,應用SRS療效顯著,能有效延長無進展生存期,提高1年生存率,且并發癥更少。本研究結果為MRI+MRS引入HGG的SRS提供了初步依據。由于是回顧性研究,病例同時接受的化療、生物治療等不盡相同,所獲結果可能存在一定的偏差,有待大樣本量、前瞻性、長期隨訪的進一步研究。
[1]YAZICI G,CENGIZ M,OZYIGIT G,et al.Hypofractionated stereotactic reirradiation for recurrent glioblastoma[J].J Neurooncol,2014,120(1):117-123.
[2]姚一搏,許民輝,徐倫山,等.1H-MRS
引導輔助伽瑪刀治療20例腦膠質瘤的初步觀察[J].第三軍醫大學學報,2012,34(18):1881-1883.
[3]NASSERI M,GAHRAMANOV S,NETTO J P,et al.Evaluation of pseudoprogression in patients with glioblastoma multiforme using dynamic magnetic resonance imaging with ferumoxytol calls RANO criteria into question[J].Neuro Oncol,2014,16(8):1146-1154.
[4]PALMER J D,SIGLIN J,YAMOAH K,et al.Re-resection for recurrent high-grade glioma in the setting of re-irradiation:more is not always better[J].J Neurooncol,2015,124(2):1-7.
[5]NGUYEN M L,WILLOWS B,KHAN R,et al.The potential role of magnetic resonance spectroscopy in image-guided radiotherapy[J].Front Oncol,2014,4(4):91.
[6]COLLET S,VALABLE S,CONSTANS J M,et al.[(18)F]-fluoro-L-thymidine PET and advanced MRI for preoperative grading of gliomas[J].Neuroimage Clin,2015,8(C):448-454.
[8]DI C A,SCARABINO T,TROJSI F,et al.Recurrent glioblastoma multiforme versus radiation injury:a multiparametric 3-T MR approach[J].Radiol Med,2014,119(8):616-624.

