益生菌發酵胡蘿卜汁活性成分與抗氧化活性研究
陳永芳,胡榮康,2,吳林秀,2,巫夢婷,鐘思敏,劉 斌,2*
(1.福建農林大學 食品科學學院,福建 福州 350002;
2.國家菌草工程技術研究中心,福建 福州 350002)
胡蘿卜是傘形科胡蘿卜屬的一年生或兩年生的草本植物,具有很高的營養價值[1]。其含有豐富的蛋白質、碳水化合物、胡蘿卜素、β-類胡蘿卜素和維生素C,其中維生素的含量達1%。但是由于胡蘿卜自身的異味以及貯藏過程中會產生辛辣味的口感,并不能被大眾所接受[2]。乳酸菌發酵在過去的幾十年里因其提高原料的營養、生理和風味等特性而受到越來越多的關注[3]。
已有報道指出[4],乳酸菌在果蔬發酵過程中對營養功能成分能夠產生有益影響,其中包括酚類物質、有機酸和游離氨基酸等。SEELAM D N S等[5]用天然分離的球形芽孢桿菌發酵胡蘿卜汁,發現發酵液中的總酚和抗氧化性都要高于未發酵組,并且菌株存活率達到7.8×107CFU/mL,表現出良好的感官品質和豐富的營養成分。徐萌萌[6]從發酵胡蘿卜汁中檢測發現了16種游離氨基酸,并且含有6種必需氨基酸,游離氨基酸總含量達到8.836 mmol/kg。王俊華等[7]研究發酵前后胡蘿卜汁中的有機酸含量變化發現,乳酸、蘋果酸、檸檬酸和琥珀酸含量增加,推斷其可能是乳酸菌發酵過程中的主要代謝物。胡蘿卜富含豐富的β-類胡蘿卜素和維生素C因而具有較強的抗氧化性,不僅如此,研究發現乳酸發酵能夠防止抗壞血酸的降解,同時能夠維持總抗氧化能力[8]。
本研究利用鼠李糖乳桿菌對胡蘿卜汁進行發酵,比較發酵前后酚類物質含量、有機酸、游離氨基酸、抗氧化活性的變化情況,以期為發酵胡蘿卜汁的深度開發提供依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
鼠李糖乳桿菌(Lactobacillus rhamnosus):中國普通微生物菌種保藏管理中心,CGMCC編號1.3724。
1.1.2 藥品及試劑
沒食子酸、兒茶素、綠原酸、槲皮素、山奈酚、乙酸、丙酸、丁酸、草酸、蘋果酸、乳酸、檸檬酸、琥珀酸標準品:上海麥克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):上海源葉生物有限公司;其余試劑均購自國藥集團化學試劑有限公司。
1.2 儀器與設備
Eyelan-1100旋轉蒸發儀:東京理化器械株式會社;Agilent 1260高效液相色譜儀(high performance liquid chromatography,HPLC):美國Agilent公司;DHG-9070A電熱鼓風干燥箱:上海一恒科學儀器有限公司;L-8900全自動氨基酸分析儀:日本HITACHI公司;Uvmini-1240紫外可見分光光度計:日本島津公司;MK3酶標儀:美國Thermo公司。
1.3 試驗方法
1.3.1 制備發酵胡蘿卜汁
新鮮制備的胡蘿卜汁,使用NaHCO3調節pH至6.5,在80℃條件下殺菌20 min,所得果汁冷卻后加入葡萄糖至終質量分數為10%,4℃條件下儲存。
向1 L胡蘿卜汁中接入約106CFU/mL鼠李糖乳桿菌,將接種后的胡蘿卜汁放置在37℃恒溫培養箱內靜置發酵培養48 h至發酵果蔬汁中含有約109CFU/mL的鼠李糖乳桿菌,將相同實驗條件下以未接種的胡蘿卜汁作為對照。
1.3.2 鼠李糖乳桿菌發酵對胡蘿卜汁中酚類物質影響
參照PAIVA F F等[9]的方法并略有修改,提取發酵前后游離態酚類物質,HPLC進行測定。向50 mL胡蘿卜汁中加入2倍體積冰預冷的體積分數80%丙酮,均質后離心收集上清液,將上清液旋蒸至無水狀態后,用雙蒸水溶解殘余物,定容至10 mL,HPLC測定含量。
參照FINOCCHIARO F等[10]的方法并略有修改,提取發酵前后結合態酚類物質,HPLC進行測定。向50 mL胡蘿卜汁中加入2倍體積冰預冷的體積分數80%丙酮,均質后離心收集沉淀,加入40 mL 4 mol/L NaOH溶液,充入適量氮氣后密封振蕩3h,加入6mol/LHCl溶液調節pH值至1,抽濾去除殘渣后加入2倍體積乙酸乙酯萃取5次,45℃條件下旋蒸至無水狀態,用水溶解殘余物,定容至10 mL,HPLC測定含量。
1.3.3 鼠李糖乳桿菌發酵對胡蘿卜汁中有機酸的影響
稱取0.5 g發酵前后的樣本液,加入0.5 mL預冷的乙酸乙酯,移入EP管內,超聲提取60 min,離心取上清液,殘渣用0.2 mL乙酸乙酯超聲20 min,離心取上清,合并上清,用乙酸乙酯定容至1 mL,混勻,針頭式過濾器過濾后HPLC進行測定。
1.3.4 鼠李糖乳桿菌發酵對胡蘿卜汁中游離氨基酸的影響
吸取5mL樣本液至水解管中,向水解管內加5mL6mol/L HCl混勻后,繼續加入5 mL 6 mol/L HCl,向水解管內滴加3~4滴苯酚。將水解管冷凍3~5min,接到真空泵的抽氣管上,0 Pa抽真空后充入氮氣,重復抽真空,充入氮氣3次后將水解管封口。將封口的水解管放在110℃電熱鼓風干燥箱內水解22 h,自然冷卻至室溫。
打開水解管,將水解液過濾至50 mL容量瓶內,用少量水多次沖洗水解管,合并水洗液和水解液,用水定容至50 mL,振蕩混勻。吸取1 mL濾液移入至15 mL試管內,在45℃條件下減壓干燥,干燥后殘留物用1 mL水溶解,再減壓干燥,最后蒸干。向干燥后的試管內加入1 mL pH 2.2的檸檬酸鈉緩沖液,振蕩混勻后過0.22 μm濾膜,用于氨基酸自動分析儀檢測。
1.3.5 測定方法
清除DPPH自由基能力:按照參考文獻[11]的方法進行測定。
DPPH自由基的清除率=
式中:Ax為樣品與DPPH反應的吸光度值;Ax0為用蒸餾水代替DPPH的吸光度值;A0為蒸餾水代替樣品的吸光度值,重復3次。
清除羥基自由基能力:按照參考文獻[12]的方法進行測定。
羥基自由基清除率=
式中:Ax為樣品的吸光度值;Ax0為用蒸餾水代替H2O2的吸光度值;A0為蒸餾水代替樣品的吸光度值,重復3次。
總還原力的測定:按照參考文獻[13]的方法進行測定。
2 結果與分析
2.1 乳酸菌發酵前后胡蘿卜汁中的酚類物質的比較
鼠李糖乳桿菌發酵胡蘿卜汁發酵前后結合態和游離態的多酚和黃酮含量變化情況見圖1。由圖1可知,鼠李糖乳桿菌發酵后胡蘿卜汁中的游離態酚類物質含量明顯增加(P<0.05),而結合態酚類物質的含量明顯下降(P<0.05),發酵后沒食子酸、兒茶素、綠原酸、槲皮素和山奈酚的含量分別為(0.21±0.02)μg/mL、(7.85±0.18)μg/mL、(150.54±6.52)μg/mL、(0.65±0.10)μg/mL和(0.19±0.02)μg/mL,比未發酵胡蘿卜汁中酚類物質含量分別提高了34.17%、14.77%、9.94%、243.91%和49.18%,槲皮素的含量明顯升高。
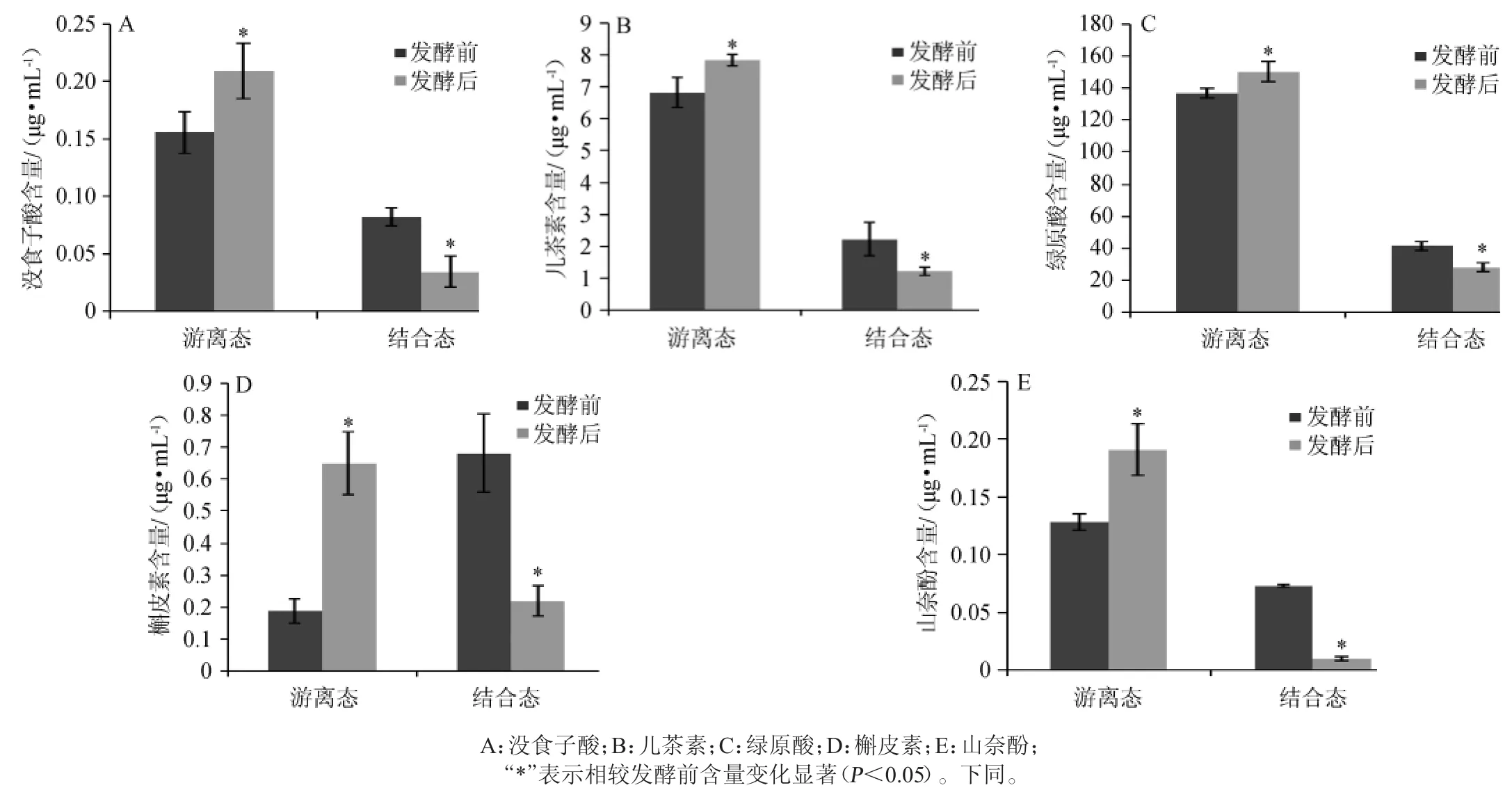
圖1 鼠李糖乳桿菌發酵前后胡蘿卜汁中結合態和游離態的多酚和黃酮含量變化Fig.1 Changes of the contents of combined and free polyphenols and flavonoids in carrot juice before and after fermentation withL.rhamnus
2.2 乳酸菌發酵前后胡蘿卜汁中的有機酸含量的比較
鼠李糖乳桿菌發酵胡蘿卜汁發酵前后有機酸的含量變化情況見圖2。由圖2可知,鼠李糖乳桿菌發酵后胡蘿卜汁中的草酸含量沒有明顯變化,發酵后乳酸、乙酸、檸檬酸、琥珀酸、丙酸和丁酸含量明顯增加(P<0.05),相較于未發酵中有機酸含量分別增加了0.463 mg/mL、5.376 mg/mL、0.256 mg/mL、1.009 mg/mL、0.371 mg/mL、0.218 mg/mL和0.312 mg/mL。

圖2 鼠李糖乳桿菌發酵前后胡蘿卜汁中有機酸含量變化Fig.2 Changes of organic acid content in carrot juice before and after the fermentation withL.rhamnus
2.3 益生菌發酵前后胡蘿卜汁中的游離氨基酸含量的比較
鼠李糖乳桿菌發酵前后胡蘿卜汁中的游離氨基酸種類及含量的變化情況見表1。由表1可知,發酵前胡蘿卜汁中共檢測到17種氨基酸,含量最高的分別是天冬氨酸、谷氨酸、甘氨酸和丙氨酸。發酵后胡蘿卜汁中游離氨基酸與發酵前相比,蘇氨酸[(0.13±0.004 8)mg/g]、絲氨酸[(0.25±0.006)mg/g]、甘氨酸((0.34±0.008 4)mg/g]、蛋氨酸[(0.05±0.007)mg/g]和賴氨酸[(0.12±0.0044)mg/g]這5種氨基酸含量明顯升高(P<0.05);天冬氨酸((0.3±0.0036)mg/g)和谷氨酸[(0.46±0.007)mg/g]含量呈明顯下降趨勢(P<0.05)。
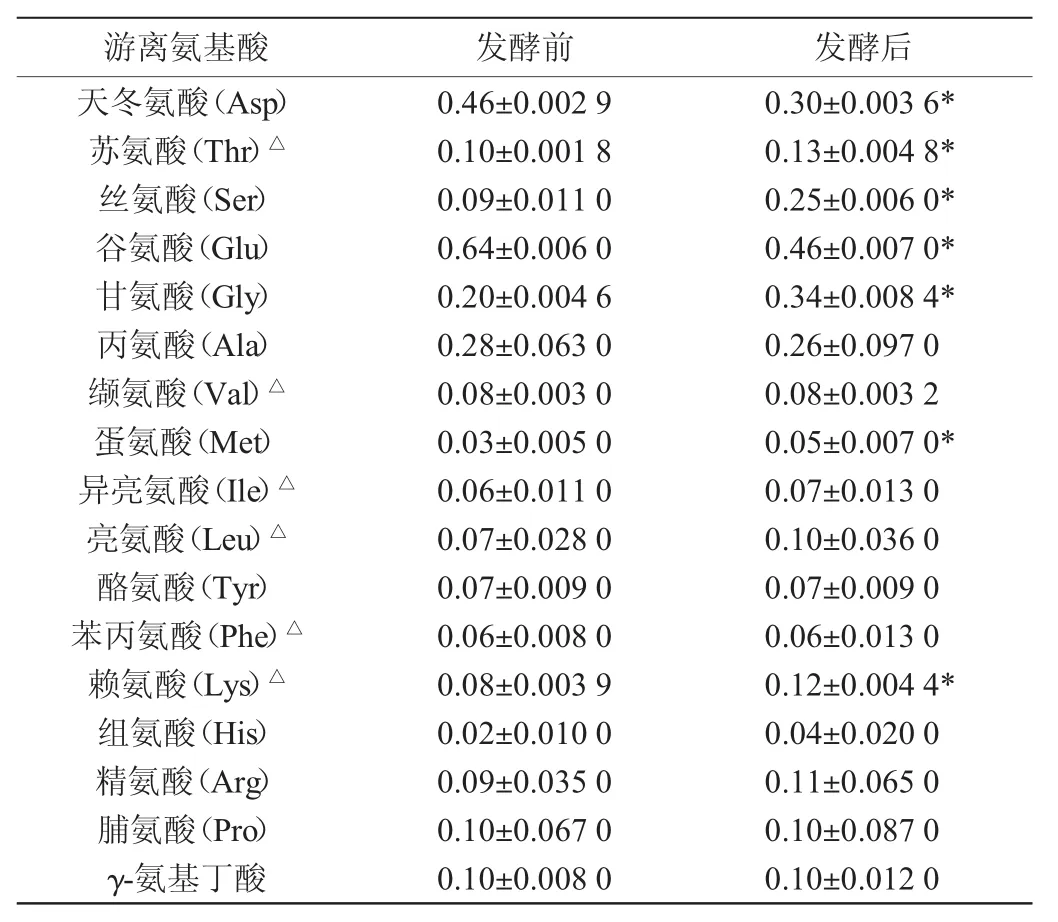
表3 鼠李糖乳桿菌發酵前后胡蘿卜汁中游離氨基酸含量變化Table 3 Changes of free amino acids content in carrot juice before and after fermentation withL.rhamnus mg/g
2.4 益生菌發酵對胡蘿卜汁的抗氧化活性的影響
鼠李糖乳桿菌發酵前后胡蘿卜汁對DPPH自由基和羥基自由基的清除率見圖3。由圖3可知,發酵后的胡蘿卜汁的抗氧化活性明顯增加(P<0.05),與發酵前后酚和黃酮含量的變化趨勢相符。發酵后的胡蘿卜汁對DPPH和羥基自由基的清除率分別為70.6%和26.45%,相比起發酵前的清除率分別提高了30.42%和21.45%。

圖3 鼠李糖乳桿菌發酵前后胡蘿卜汁對DPPH、羥基自由基清除率變化Fig.3 Changes of free radical scavenging rate of carrot juice on DPPH and hydroxyl free radical before and after fermentation withL.rhamnus
鼠李糖乳桿菌發酵胡蘿卜汁前后總還原力的變化見圖4。由圖4可知,總還原力在發酵后顯著增加(P<0.05)。發酵后胡蘿卜汁的總還原力的吸光度值為0.58±0.01,發酵后的胡蘿卜汁比發酵前總還原力提高了28.89%。

圖4 鼠李糖乳桿菌發酵前后胡蘿卜汁總還原力變化Fig.4 Changes of total reducing power of carrot juice before and after fermentation withL.rhamnus
3 討論
乳酸菌是人和動物腸道內最重要的益生菌群,乳酸菌發酵能夠釋放果蔬中的酚類物質、有機酸和游離氨基酸等功能性物質的含量,提高生物利用率、增強抗氧化性和抑制糖尿病相關酶的能力。
酚類是一種易被氧化的物質,能夠有效的在細胞和生理水平上防止氧化[14]。果蔬中的酚類物質主要以游離態和結合態存在,CHU Y F等[15]對胡蘿卜中酚類物質含量和抗氧化能力的研究表明胡蘿卜中的酚類物質以游離態為主,結合酚的含量同樣占總酚含量的24%左右。目前,相較于結合酚,游離酚因其易開發,生理活性強的特點受到越來越多的關注。乳酸菌發酵時產生阿魏酸酯酶等酚酸酯酶水解果蔬中的部分結合酚,釋放果蔬中的游離酚,并且釋放大量的有機酸,防止酚類物質的降解,從而提高了抗氧化活性。某些乳酸菌在發酵過程中,也會產生一些酚酸脫羧酶,這種能使酚類物質之間相互轉化。由此可見,乳酸菌發酵而導致果蔬酚類物質間的相互轉化,能明顯改變其抗氧化性[16]。
乳酸菌發酵主要通過同型發酵和異型發酵兩種代謝途徑。同型發酵過程中乳酸菌參與糖酵解、三羧酸循環等途徑產生乳酸,并且伴隨丙酮酸和琥珀酸等部分中間產物[17]。異型發酵過程中乳酸菌除了產生乳酸和乙酸等主要產物之外,還會產生少量的甲酸、丁酸和琥珀酸等代謝產物[18]。胡蘿卜汁經過鼠李糖乳桿菌發酵后乳酸、檸檬酸、琥珀酸、乙酸、丙酸和丁酸的含量明顯增加(P<0.05),而蘋果酸的含量顯著減少(P<0.05),這可能涉及到乳酸菌發酵過程中的一種特殊代謝途徑(蘋果酸-乳酸發酵)[19]。本研究結果表明,鼠李糖乳桿菌在發酵胡蘿卜汁過程中,蘋果酸轉化為乳酸,蘋果酸含量由發酵前的(0.506±0.045)mg/mL下降為發酵后的(0.043±0.002)mg/mL。
胡蘿卜汁經過鼠李糖乳桿菌發酵后天冬氨酸和谷氨酸的含量明顯下降。七谷圭等[20]發現某些乳酸菌能夠將天冬氨酸置換成丙氨酸,不僅能夠增強菌的繁殖力還能夠降低酸味增加適口性。谷氨酸是合成γ-氨基丁酸重要的前體物質,乳酸菌發酵能夠將谷氨酸轉化成為具有降血壓功能的γ-氨基丁酸[21]。
4 結論
本實驗初步探討了鼠李糖乳桿菌在果蔬發酵過程中對其活性成分與抗氧化活性的影響,結果表明,鼠李糖乳桿菌發酵后胡蘿卜汁中的游離態酚類物質含量明顯增加(P<0.05),而結合態酚類物質的含量明顯下降(P<0.05),其中槲皮素相較于發酵前提高了243.91%;發酵后乳酸含量最高,比發酵前提高了5.376 mg/mL;發酵后蘇氨酸(0.13mg/g)、絲氨酸(0.25mg/g)、甘氨酸(0.34mg/g)、蛋氨酸(0.05mg/g)和賴氨酸(0.12mg/g)含量均明顯升高(P<0.05)。
發酵后的胡蘿卜汁對DPPH自由基和羥基自由基的清除率分別為70.6%和26.45%,比發酵前分別提高了30.42%和21.45%。
發酵后的胡蘿卜汁總還原力吸光度值為0.58±0.01,比和發酵前提高了28.89%。
[1]張振賢,俞景權,于賢昌,等.蔬菜栽培學[M].北京:中國農業大學出版社,2003:275-280.
[2]趙曉燕,馬 越.胡蘿卜果蔬汁開發前景分析[J].蔬菜,2004(1):30-31.
[3]STILES M E.Biopreservation by lactic acid bacteria[J].Anton Leeuw,1996,70(2-4):331-345.
[4]賴 婷,劉漢偉,張名位,等.乳酸菌發酵對果蔬中主要活性物質及其生理功能的影響研究進展[J].中國釀造,2015,34(3):1-4.
[5]SEELAM D N S,AKULA H,KATILE U,et al.Production,characterization and optimization of fermented tomato and carrot juices by usingLysinibacillus sphaericusisolate[J].J Appl Biol Biotechnol,2017,5(4):66-75.
[6]徐萌萌.益生菌發酵胡蘿卜飲料營養特性及其儲藏穩定性研究[D].南昌:南昌大學,2016.
[7]王俊華,楊 潔,申 彤.乳酸發酵胡蘿卜汁中有機酸的HPLC測定[J].現代食品科技,2006,22(4):235-238.
[8]DI C R,SURICO R F,PARADISO A,et al.Effect of autochthonous lactic acid bacteria starters on health-promoting and sensory properties of tomato juices[J].Int J Food Microbiol,2009,128(3):473-483.
[9]PAIVA F F,VANIER N L,BERRIOS J D J,et al.Physicochemical and nutritional properties of pigmented rice subjected to different degrees of milling[J].J Food Compos Anal,2014,35(1):10-17.
[10]FINOCCHIAROF,FERRARIB,GINAINETTIA,et al.Characterization of antioxidant compounds of red and white rice and changes in total antioxidant capacity during processing[J].Mol Nutr Food Res,2007,51(8):1006-1019.
[11]HUA D,ZHAN D,HUANG B,et al.Structural characterization and DPPH radical scavenging activity of a polysaccharide from Guara fruits[J].Carbohyd Polym,2014,103:143-147.
[12]李奕星,袁德保,鄭曉燕,等.諾麗果汁的抗氧化性研究[J].熱帶作物學報,2013,34(8):1531-1534.
[13]張春梅,宋 海,魏生龍.荷葉離褶傘菌絲體多糖的提取及還原力的研究[J].中國食用菌,2012,31(6):44-48.
[14]SZWAJGIER D,WASKO A,TARGONSKI Z,et al.The use of a novel ferulic acid esterase fromLactobacillus acidophilusK1 for the release of phenolic acids from brewer's spent grain[J].J I Brewing,2010,116(3):293-303.
[15]CHU Y F,SUN J,WU X Z,et al.Antioxidant and antiproliferative activities of common vegetables[J].J Agric Food Chem,2002,50(23):7449-7454.
[16]RODRIGUEZ H,LANDETE J M,CURIELJ A,et al.Characterization ofthe p-coumaric acid decarboxylase fromLactobacillus plantarumCECT 748(T)[J].J Agric Food Chem,2008,56(9):3068.
[17]田 璐,汪立平.利用柿子皮混菌發酵制備果醋及品質分析[J].食品科學,2016,37(19):197-203.
[18]CHAILLOU S,POUWELS P H,POSTMA P W.Transport of d-xylose inLactobacillus pentosus,Lactobacillus casei,andLactobacillus plantarum:evidence for a mechanism of facilitated diffusion via the phosphoenolpyruvate:mannose phosphotransferase system[J].J Bacteriol,1999,181(16):4768-4773.
[19]姚永紅.腸膜明串珠菌WZ30-2在蘋果酒發酵工藝中的應用研究[D].北京:北京林業大學,2011.
[20]七谷圭,阿部敬悅.乳酸菌的天冬氨酸脫羧及其產能[G].趙 欣譯.日本釀造協會雜讠志.
[21]李 理,劉 冶,滿朝新,等.產γ-氨基丁酸乳酸菌及其應用[J].中國乳品工業,2014,42(2):31-34.

