灼燒技術治療慢性扁桃體炎對患者免疫功能的影響*
孫永東,賀曉芳,楊朝綱,劉 雷,童興科,向小紅
(1.西南醫科大學附屬中醫醫院耳鼻咽喉科,四川瀘州 646000; 2.西南醫科大學中西醫結合學院,四川瀘州 646000)
慢性扁桃體炎(chronic tonsillitis,CT)為扁桃體的持續感染性疾病,該病的發生多因急性扁桃體炎反復發作,或因腭扁桃體隱窩引流不暢,以及隱窩內細菌、病毒滋生演變成的慢性炎癥性疾病[1]。目前CT的發病機制還未完全明確,但免疫反應在CT的發病機制中起著非常重要的作用,白細胞介素(IL)、單核細胞趨化因子-1(MCP-1)、核因子-κB(NF-κB)等在CT發病機制中的作用是現在國內外研究的熱點之一。CT的治療方法較多,西醫多以藥物治療及手術治療為主。中醫的治療方法中,灼燒技術具有獨特的優勢[2]。西醫手術治療可以徹底解決了病灶的存在,但手術治療的風險較大,術后咽痛、咽干、咽癢等不適癥狀較多[3]。藥物治療CT雖然可起到良好的治療效果,但存在病菌對抗生素的耐藥問題,容易導致CT長期反復發作使得治療不徹底。中醫灼燒技術對CT具有治療方法簡單、價格低廉、痛苦小、治愈率高的優點,并且可以有效的將扁桃體體積縮小,同時改善患者免疫功能[4]。Toll樣受體(toll-like receptors,TLR)是一種跨膜受體蛋白[5],與多種炎癥發生相關。本研究選擇TLR-NF-κB信號通路中的TLR2、TLR4、NF-κB及細胞因子中的IL-4、IL-5、IL-10、干擾素γ(INF-γ)、轉化生長因子β(TGF-β)為檢測指標,探討灼燒技術治療方式對CT患者免疫功能的影響及其可能的作用機制。
1 資料與方法
1.1一般資料 選擇2013年6月至2016年12月于西南醫科大學附屬中醫醫院耳鼻咽喉科門診就診并臨床診斷為CT的患者20例為觀察組,其中男12例,女8例,平均年齡(17.50±20.20)歲。所有患者按就診先后順序納入觀察組。術后電話隨訪患者治療效果,有3例患者失訪。選擇同期西南醫科大學在校學生及本院招募的健康志愿者6例作為對照組,其中男4例,女2例,平均年齡(25.50±19.00)歲。均先與受試者做詳細的醫患溝通解釋,并簽署《受試者知情同意書》。納入標準:(1) 按國家中醫重點專科CT(乳蛾) 中醫診療方案[6]診斷標準,凡具備急性扁桃體炎反復發作病史及檢查中擠壓舌腭弓,自隱窩口有膿液及干酪樣物溢出即可作出診斷;(2)年齡8~60歲;(3)患者簽署《受試者知情同意書》。排除標準:(1)誤納入試驗者;(2)扁桃體炎急性發作期,扁桃體結核,良、惡性腫瘤;(3)全身嚴重疾病,危及生命者;(4)正在接受其他有關治療,影響療效觀察者;(5)造血系統疾病易出血者;(6)孕婦、精神病患者。
1.2方法
1.2.1器械與儀器 專用器械:使用扁桃體灼烙器(新原牌TCA-1型扁桃體灼烙器,瀘州市江陽區南城機械鑄造廠,川瀘州藥監械[準]字2005第1050001號)。灼烙器分成Ⅰ、Ⅱ、Ⅲ、Ⅳ號4支為一套,每支由柄和頭組成。其柄為(17.00 cm×0.50 cm);Ⅰ號頭部尖形(0.20 cm);Ⅱ號頭部呈圓柱形(0.40 cm×0.20 cm);Ⅲ號頭部為球形(直徑0.50 cm);Ⅳ號頭部為扁橢圓形(1.00 cm×0.50 cm)。治療時根據扁桃體大小選擇不同型號的烙鐵器。灼烙劑:主要成分為香油,治療時起到止痛、消炎、防止烙鐵頭與扁桃體粘連等作用,裝于60 mL的醫用廣口玻璃瓶內備用。酶聯免疫吸附試驗(ELISA)所有檢測指標的試劑盒由上海蔚霆商貿有限公司提供。
1.2.2觀察組患者治療方法 (1)治療操作前,醫師應事先告知患者灼燒操作全過程,以便患者能配合治療。治療中如不出現疼痛,不使用表面及浸潤麻醉。(2) 醫師左手持壓舌板,右手將小烙鐵置于酒精燈外焰上,均勻加熱烙鐵頭約20 s(此時的溫度約250 ℃)。(3)快速將已加熱的烙鐵頭浸入灼烙劑瓶內,使烙鐵頭蘸滿灼烙劑,所涂灼烙劑劑量以不下滴為度,過多灼烙劑用無菌干紗布吸去(此時的溫度約120 ℃)。(4)患者張口,左手將壓舌板伸進患者口腔,壓平舌體,充分暴露扁桃體。(5)右手所持灼烙器(此時的溫度90 ℃左右)迅速伸入口腔,將烙鐵頭輕觸患者扁桃腺表面黏膜,接觸時間常規為0.50 s,以黏膜變白為終止標志。然后快速將烙鐵退出口腔,既完成1鐵治療。變白黏膜面積一般為0.10~0.60 cm2。(6)第1鐵灼烙完,用無菌干紗布清潔烙鐵頭,同時了解患者的反應。(7)再按上法,不重疊、不連續的灼烙第2、3鐵,一側扁桃體烙3鐵后,再對另一側扁桃體烙3鐵,兩側共烙6鐵即為1次治療量。給予觀察組患者10次灼燒治療,對照組不予以任何治療上的處理。
1.2.3采集受試者靜脈血 觀察組患者分別于灼燒治療前及10次灼燒治療后采集靜脈血各5 mL于潔凈的真空采血試管中。對照組僅采集受試者靜脈血共5 mL于潔凈的真空采血試管中。以上靜脈抽血所得標本均送至實驗中心分離血清后進行ELISA檢測相關免疫指標。
1.2.4觀察指標 采用ELISA檢測血清中TLR2、TLR4、NF-κB、IL-4、IL-5、IL-10、INF-γ、TGF-β水平。嚴格按照試劑盒操作要求操作:先獲取未標定抗體,再進行加樣、稀釋及加酶,最后洗滌并顯色,終止并測定吸光度(OD)值。按各檢測指標的試劑說明書,繪出各個指標的相應標準曲線,再按曲線公式得出每個樣本相對應的最后濃度數值。
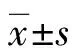
2 結 果
2.1兩組對象血清免疫指標水平比較 觀察組患者治療前血清中TLR2、TLR4、NF-κB、IL-4、IL-5、IL-10、INF-γ、TGF-β水平明顯高于對照組,差異均有統計學意義(P<0.05)。與治療前比較,觀察組治療后血清中TLR2、TLR4、NF-κB、IL-4、IL-5、IL-10、INF-γ、TGF-β水平明顯降低(P<0.05);但仍高于對照組,且差異有統計學意義(P<0.05),見表1。

表1 觀察組治療前后與對照組血清免疫指標水平比較
a:P<0.01,b:P<0.05,與對照組比較;c:P<0.05,與同組治療前比較
2.2觀察組患者治療前、后血清中免疫指標與NF-κB的相關性 觀察組患者治療前血清中免疫指標TLR2、TLR4、IL-4、IL-5、L-10、INF-γ、TGF-β與NF-κB無明顯相關性(P>0.05);治療后TLR2與NF-κB呈正相關(r=0.49,P<0.05),其他指標與NF-κB無明顯相關性(P>0.05),見表2。

表2 觀察組患者治療前、后血清中免疫指標與NF-κB的相關性分析
3 討 論
TLR-NF-κB通路是近幾年發現的與炎癥、免疫類疾病關系極為密切的信號傳導通路,在免疫炎癥性疾病的進展中起著非常重要的作用[7]。近年研究認為TLR家族中的TLR2、TLR4在該類疾病的發生、發展過程中有著非常重要的作用,肽聚糖、磷壁酸等結構可以被具有TLR2的免疫細胞所識別,而脂多糖則可被具有TLR4結構的細胞所識別[8]。當病原菌侵襲機體時,首先通過病原體相關分子模式(PAMPs)的識別作用與免疫細胞上的TLRs相結合,然后通過激活細胞內TLR-NF-κB信號通路并導致特定基因表達[9],最后使得諸多抗原呈遞細胞(APC)及T淋巴細胞等產生各種類型的細胞因子,如IL-4、IL-5、IL-10等[10-12]。
本研究結果表明TLR2、TLR4、NF-κB在CT患者血清中的水平均高于健康志愿者。國外的MANSSON等[13]研究表明多種TLR家族的因子在復發性扁桃體炎及扁桃體增生患者的病變組織中廣泛表達。上述研究結果一致表明TLR2、TLR4、NF-κB參與CT的發病過程。本研究還發現經灼燒治療后上述3種因子水平均降低,表明灼燒技術可以通過影響TLR2、TLR4、NF-κB在血中的水平起到治療作用。本研究還發現CT患者血清中IL-4、IL-5、IL-10、INF-γ、TGF-β的表達均增加。羅蓉[14]的研究同樣表明部分細胞因子參與了CT的發生。因此,IL-4、IL-5、IL-10、INF-γ、TGF-β參與了該病發病過程的假設被進一步證實。且經灼燒技術治療后,患者血清中的上述細胞因子表達降低,說明灼燒技術治療可通過影響TLR-NF-κB通路相關細胞因子的表達而起到治療CT的作用。
臨床研究已證實,灼燒技術對CT具有有效、可靠、安全、簡便的治療優勢[15]。隨著科學技術的發展,中醫灼燒治療技術也得到了臨床的廣泛運用,同時其作用機制正被不斷深入研究。其中改良灼燒技術及微波烙法等治療方式正逐步得到廣泛的臨床運用[16],促使CT的治療得到了進一步的發展。既往已經有研究從臨床效果,角蛋白(CK)4、CK13及急性時相蛋白、β防御素和免疫細胞等角度在免疫細胞的基礎上對灼燒技術治療CT的機制進行了相關研究[17-19]。上述的研究結果均說明了灼燒技術對于CT具有免疫調節作用。盡管目前對于灼燒技術治療CT的作用機制進行了廣泛的研究,但是該治療方式治療CT的具體作用機制仍不甚明確,因此有待進一步擴寬研究廣度,加強研究深度,以期在明確灼燒技術作用機制的基礎上更好發揮中醫學非藥物特色診療項目的優勢,為人類疾病的治療做出更大的貢獻。
綜上所述,IL-4、IL-5、IL-10、INF-γ、TGF-β均在CT的發病及進展過程中發揮了重要作用,而灼燒技術治療具有降低上述細胞因子表達的作用。此外,本研究同時顯示灼燒治療后TLR2水平與NF-κB水平呈正相關(r=0.49,P=0.04)。從而證實,灼燒治療技術可以通過影響TLR2介導的TLR-NF-κB信號通路,進而影響免疫細胞中細胞因子的產生,最終起到治療CT的作用。本研究所檢測的免疫指標均參與了CT的發病,并且中醫灼燒技術可以通過影響以上免疫因子的表達起到治療CT的作用。
[1]黃選兆,汪吉寶,孔維佳,等.實用耳鼻咽喉頭頸外科學[M].2版.北京:人民衛生出版社,2008:291-293.
[2]張肖瑾,趙瓊,張彩彥,等.扁桃體炎中醫外治法應用規律研究[J].山西中醫,2014,30(8):39-41.
[3]邢秀峰,馮振山.扁桃體切除術對機體免疫功能遠期影響的觀察[J].中國藥物與臨床,2015,15(4):549-550.
[4]陳隆暉,楊思進,張勉,等.灼燒技術治療慢性扁桃體炎97例臨床觀察[J].中醫雜志,2012,53(13):1119-1122.
[5]DE N D.Toll-like receptors:Activation,signalling and transcriptional modulation[J].Cytokine,2015,74(2):181-189.
[6]國家中醫藥管理局醫政司.24個專業105個病種中醫臨床路徑(合訂本 試行版)[M].北京:國家中醫藥管理局醫政司,2011:455.
[7]KAWASAKI T,KAWAI T.Toll-like receptor signaling pathways[J].Front Immunol,2014,5(9):461-464.
[8]SNOW W M,ALBENSI B C.Neuronal gene targets of NF-κB and their dysregulation in alzheimer′s disease[J].Front Mol Neurosci,2016,9(9):118-120.
[9]KüCüKSEZER U C,PALOMARES O,RüCKERT B,et al.Triggering of specific Toll-like receptors and proinflammatory cytokines breaks allergen-specific T-cell tolerance in human tonsils and peripheral blood[J].J Allergy Clin Immunol,2013,131(3):875-885.
[10]VARRICCHI G,BAGNASCO D,BORRIELLO F,et al.Interleukin-5 pathway inhibition in the treatment of eosinophilic respiratory disorders:evidence and unmet needs[J].Curr Opin Allergy Clin Immunol,2016,16(2):186-200.
[11]楊珍.扁桃體組織中IL-4與IL-5的表達和意義[J].內蒙古醫學雜志,2011,43(4):398-400.
[12]MA X,YAN W,ZHENG H,et al.Regulation of IL-10 and IL-12 production and function in macrophages and dendritic cells[J].F1000Res,2015,4(s 42/43/44):1031-1036.
[13]MANSSON A,ADNER M,CARDELL L O.Toll-like receptors in cellular subsets of human tonsil T cells:altered expression during recurrent tonsillitis[J].Respir Res,2006,7(1):36-39.
[14]羅蓉.慢性扁桃體炎對機體免疫功能的影響和機制研究[D].武漢:華中科技大學,2009.
[15]黃永林,孫永東,陳隆暉,等.中醫灼烙方法治療慢性扁桃體炎的臨床效果[J].陜西中醫,2015,36(7):875-876.
[16]王麗鳴.改良烙法治療慢性扁桃體炎30例[J].中國中醫藥現代遠程教育,2014,12(22):34-35.
[17]吳華英.探討灼燒技術在治療慢性扁桃體炎中對扁桃體M細胞及CK4、CK13的影響[D].瀘州:瀘州醫學院,2010.
[18]孫海波,冷輝,呂洪,等.中醫烙法治療慢性扁桃體炎急性時相反應蛋白的實驗研究[J].中醫耳鼻喉科學研究,2012(1):13-16.
[19]孫興俊,陳新年,李娟,等.慢性扁桃體炎中人β-防御素-3的表達及意義[J].蘭州大學學報(醫學版),2013,39(2):7-10.

