MDS、AML患者T淋巴細胞及相關細胞因子表達水平的研究
郭含夢,倪 婧,鄭美娟,陳 冰,楊明珍,
骨髓增生異常綜合征(myeodysplastic syndromes,MDS)起源于造血干細胞,骨髓中存在分化、成熟障礙的異常細胞,導致病態造血發生,在骨髓原位或釋放入血后不久被破壞,導致無效造血,是一種高風險向急性髓系白血病轉化的難治性血細胞質、量異常性疾病。白血病是一類造血干祖細胞的惡性克隆性疾病,因白血病細胞自我更新增強、增殖失控、分化障礙、凋亡受阻,因而停止在細胞發育的不同階段。發病時骨髓中異常的原始細胞及幼稚細胞大量增殖并抑制正常造血[1]。大量的臨床和實驗數據[2-3]表明,免疫機制參與MDS的發病機制,低風險MDS的特點是自身免疫介導的骨髓抑制,骨髓的細胞凋亡增加具有自身免疫性特點,多種免疫分子參與導致過度細胞死亡,而高風險MDS包括免疫逃避和次級DNA損傷,原始細胞大量增殖從而可進展為急性髓系白血病(acute myelogenous leukemia,AML)。因此,免疫機制對MDS疾病發生發展產生怎樣影響以及不同時期MDS和AML的免疫情況有何差異值得探究。該研究通過流式細胞儀檢測MDS、AML患者調節性T細胞(regulatory cell,Treg)水平,通過流式細胞微球芯片捕獲術(cytometric bead array,CBA)檢測Th1細胞分泌的細胞因子白細胞介素-2(interleukin-2,IL-2)、腫瘤壞死因子(tumor necrosis factor,TNF)、γ-干擾素(interferon-γ,IFN-γ)、Th2分泌的白細胞介素-4(interleukin-4,IL-4)、白細胞介素-6(interleukin-6,IL-6)、白細胞介素-10(interleukin-10,IL-10)以及Th17分泌的白細胞介素-17(interleukin-17,IL-17)表達水平作對比分析,從而探討MDS、AML的免疫功能狀態與疾病發生發展的關系,并為疾病是否需要進行免疫抑制劑治療提供依據。
1 材料與方法
1.1病例資料選取2016年10月~2017年8月在安徽醫科大學第一附屬醫院血液科收治的MDS、AML共35例,所有患者符合診斷標準[1]。AML患者15例,男7例,女8例,年齡25~75歲,中位年齡38歲,其中M3患者2例、M2患者6例、M4患者2例、M5患者4例、M6患者1例,MDS患者20例,男15例,女5例,年齡29~75歲,中位年齡53歲,根據FAB分型分為兩組[1],骨髓原始細胞<5%的難治性貧血(refracrory aremia,RA)及難治性貧血伴有環形鐵粒幼細胞(RA with ring sideroblst,RARS)為RA組,骨髓原始細胞>5%的難治性貧血伴原始細胞增多(RA with an excess of blast, RAEB)、轉化中的RAEB(RAEB in transformation,RAEB-T)、慢性粒單核細胞白血病(chronic myelo-monocytic leukemia,CMML)為RAEB組,其中RA組(低風險MDS)10例,RAEB組(高風險MDS)10例。正常對照組10例,為安徽醫科大學第一附屬醫院同期健康體檢者,其中男5例,女5例,年齡25~75歲,中位年齡46歲。
1.2試劑與儀器CBA人Th1/Th2/Th17細胞因子檢測試劑盒、淋巴細胞分離液購自美國BD公司,Treg (CD4+CD25+Foxp3+)檢測試劑包括FITC-CD4、PE-CD25、Alexa647-Foxp3購自美國BD公司。流式細胞儀、12×75 mm FalconTM流式上樣管、15 ml聚丙烯圓錐底離心管購自美國BD公司,5810R離心機購自德國Eppendorf公司,生物安全柜購自美國Thermo公司。
1.3方法
1.3.1Treg的測定 ① 取外周血100 μl,分別加入CD4-FITC /CD25-PE 混合液5 μl;② 混勻,4 ℃避光孵育15 min,加1 ml溶血素混勻,避光孵育10 min; ③ 1500 r/min離心5 min,棄上清液,加1 ml PBS,離心,棄上清液;④ 加100 μl固定液,避光孵育40 min;⑤ 加穿膜液1 ml,1 500 r/min離心5 min;⑥ 加5 μl FOXP3抗體、避光孵育1 h;⑦ 加1 ml PBS 1 500 r/min離心5 min,棄上清液;⑧ 加200 μl PBS,上機操作;⑨ 應用流式細胞儀測定表達CD4+CD25+Foxp3+的細胞比例。
1.3.2細胞因子的測定 ① 配置標準管:根據說明書使用分析稀釋劑以及人Th1/Th2/Th17細胞因子標準管配置標記TOP,1 ∶2,1 ∶4至1 ∶256各空標準管;② 配置測試管:配備人IL-2、IL-4、IL-6、IL-10、IL-17、TNF、IFN-γ捕獲珠混合液,按照每個樣本(標準品)加50 μl捕獲珠混合液計算比例混勻;③ 配備好的捕獲珠混合液200 r/min離心5 min,棄上清液加入同等體積的血清增強緩沖液,混勻,避光30 min;④ 取50 μl捕獲珠混合液分別加入測試管(每管加入50 μl患者血清),然后每管分別加入50 μl捕獲抗體;⑤ 向標記為TOP,1 ∶2,1 ∶4至1 ∶256的各標準管中,每管分別加入已配備好的相應50 μl標準管試劑,每管均再加入50 μl捕獲珠混合液和50 μl捕獲抗體,混勻,避光3 h;⑥ 孵育完畢后分別加入1 ml洗滌緩沖液,200 r/min離心5 min,棄上清液;每管加入300 μl洗滌緩沖液,上流式細胞儀檢測;⑦ 用CBA軟件分析:用TOP至1 ∶256各標準管的流式結果繪制IL-2、IL-4、IL-6、IL-10、IL-17、TNF及IFN-γ各細胞因子標準曲線,在標準曲線下得出各測試管IL-2、IL-4、IL-6、IL-10、IL-17、TNF及IFN-γ的含量,見圖1。
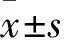
2 結果
2.1各組與總體比較結果各指標組間總體比較差異均有統計學意義,Treg、TNF、IFN-γ、IL-2、IL-4、IL-6、IL-10、IL-17的F值依次為27.650、16.277、102.800、37.537、7.333、92.453、69.594、457.892。
2.2各實驗組與正常對照組比較結果MDS組IFN-γ、TNF、IL-17、IL-6、IL-2表達水平較正常對照組高,差異有統計學意義(P<0.05), IL-4、IL-10、Treg表達水平差異無統計學意義;RA組Treg、IL-6、IL-4表達水平差異無統計學意義,TNF、IL-17、IL-2、IFN-γ表達水平較正常對照組高,差異有統計學意義(P<0.05),IL-10表達水平較正常對照組低,差異有統計學意義(P<0.05);RAEB組Treg、IL-10、IL-6、IL-4表達水平較正常對照組高,差異有統計學意義(P<0.05),TNF表達水平較正常對照組低,差異有統計學意義(P<0.05),IL-17、IL-2、IFN-γ表達水平差異無統計學意義;AML組Treg、IL-10、IL-6、IL-4表達水平較正常對照組高,差異有統計學意義(P<0.05),TNF表達水平較正常對照組低,差異有統計學意義(P<0.05),IL-17、IL-2、IFN-γ表達水平差異無統計學意義。
2.3各實驗組間相互比較結果與MDS組比較,AML組Treg、IL-10、IL-6表達水平較高,差異有統計學意義(P<0.05),TNF、IL-17、IL-2、IFN-γ表達水平較低,差異有統計學意義(P<0.05),IL-4差異無統計學意義;與RA組比較,RAEB組Treg、IL-10、IL-6、IL-4表達水平較高,差異有統計學意義(P<0.05),TNF、IL-17、IL-2、IFN-γ表達水平較低,差異有統計學意義(P<0.05);AML組Treg、IL-10、IL-6、IL-4表達水平較高,差異有統計學意義(P<0.05),TNF、IL-17、IL-2、IFN-γ表達水平較低,差異有統計學意義(P<0.05);與RAEB組比較,AML組Treg表達水平較高,差異有統計學意義(P<0.05),其余7種細胞因子差異無統計學意義。細胞因子表達水平見表1。

表1 各組Treg、IL-10、IL-6、IL-4、TNF、IL-17、IL-2、IFN-γ表達水平

圖1 外周血中細胞因子的表達水平
3 討論
眾所周知,免疫系統是人體主要的防御機構,對辨識、消滅、排除“非自體物質”起到重要作用,其功能的亢進與抑制都會導致疾病的發生,其中T淋巴細胞在其中占有很重的比例。Treg是一群調節機體免疫反應的淋巴細胞,有維持自身免疫耐受及避免免疫反應過度損傷機體的作用,同時參與腫瘤細胞的免疫逃逸。Th細胞可根據所分泌的不同功能的細胞因子分為Th1、Th2細胞,Th1細胞主要參與細胞免疫,Th2細胞主要參與體液免疫,兩者間的平衡是免疫調節重要環節,平衡失調可引起免疫缺陷。Th1細胞主要分泌IL-2、IFN-γ、TNF等細胞因子,Th2細胞主要分泌IL-4、IL-6、IL-10等細胞因子。Th17是新發現的T細胞亞群,其主要效應因子為IL-17,在誘導炎癥、自身免疫組織損傷方面有重要作用,部分研究[2-9]表明其在保護性抗腫瘤免疫方面也存在影響。
本研究結果顯示,與正常對照組相比,MDS組IFN-γ、TNF、IL-17、IL-6、IL-2表達水平較高,其他細胞因子水平差異無統計學意義。對MDS進一步進行分層分析結果表明,RA組TNF、IL-17、IL-2、IFN-γ表達水平較高, RAEB組Treg、IL-10、IL-6、IL-4表達水平較高,同時兩組之間相互比較,與RA組相比,RAEB組Treg、IL-10、IL-6、IL-4表達水平較高,TNF、IL-17、IL-2、IFN-γ表達水平較低,以上各組間比較差異均有統計學意義。從上述結果可看出,在低風險MDS階段,Th1/Th2的平衡中Th1占優勢地位,Th17/Treg平衡中Th17占優勢地位,而在高風險MDS階段,Th2及Treg占優勢地位。這與大多數研究結果相符合,由此可以看出在MDS發展的不同階段,其T淋巴細胞的免疫狀態也不同。而RAEB組與AML組比較,AML組Treg表達水平較高,差異有統計學意義,其余7種細胞因子差異無統計學意義,可以看出兩組有相似的免疫狀態,這與多數研究[5-10]結果相一致。
MDS是一種造血干細胞異常克隆的疾病,通過無效以及病態造血導致外周正常血細胞減少。多項研究[10-11]表明,Th1以及Th17分泌的細胞因子主要具有負性調節作用,因此在低風險MDS,Th1及Th17占據優勢,主要發揮免疫介導的過度細胞凋亡以及清除異常細胞、抗腫瘤的作用,并且少量的Treg可激活自動反應T細胞克隆,促進細胞凋亡程度,使造血干細胞以及祖細胞破壞增加,從而引起骨髓衰竭。因此在臨床實驗中可見,部分MDS患者通過免疫抑制劑治療可延緩病情進展。
對于MDS-RAEB及AML,兩者診斷標準主要區別在于原始細胞比例的不同,在MDS-RAEB中原始細胞進一步累積發展可轉化為AML。根據研究結果,與正常對照組比較,兩組均提示Treg、IL-10、IL-6、IL-4表達水平較高。在高風險MDS以及AML中,Th2及Treg占據優勢,Th2分泌的細胞因子以及Treg主要具有免疫抑制、增加免疫耐受的作用,并可介導腫瘤細胞參與免疫逃逸,促進異常細胞的擴張以及疾病發展,Th1以及Th17的減少也導致機體對于清除異常細胞能力的下降[12-15]。因此,在RAEB及AML中,原始細胞的增加、免疫功能的抑制兩者相互影響,導致機體內腫瘤細胞不斷累積影響正常造血功能。此時免疫抑制劑治療效果不佳,僅能通過化療、造血干細胞移植等大量殺滅腫瘤細胞的治療手段獲得療效。而對于AML、MDS-RAEB組Treg表達水平較高,可能提示AML腫瘤細胞進一步累積,免疫系統進一步破壞,從而提示疾病的進展。
綜上所述,不同階段MDS、AML具有不同免疫狀態,低風險MDS系負性調節因子過多導致細胞凋亡引起骨髓造血功能衰竭,而高風險MDS及AML則是免疫抑制以及免疫逃逸增加,腫瘤細胞不斷積聚導致正常造血功能障礙。
[1] 張之南,沈 悌.血液病診斷與療效標準[M].3 版.北京:科學出版社,2007:33-8,349-60.
[2] Zhang Z, Li X, Chang C,et al. Interleukin-17 enhances the production of interferon-γ and tumour necrosis factor-α by bone marrow T lymphocytes from patients with lower risk myelodysplastic syndromes[J]. Eur J Haematol,2013,90(5):375-84.
[3] Shao L L,Zhang L, Hou M,et al.Th22 cells as well as Th17 cells expand differentially in patients with early-stage and late- stagemyelodysplastic syndrome[J]. PLoS One,2012,7(12):e51339.
[4] Li J, Yue L, Shao Z,et al.Th17 cells exhibit antitumor effects in MDS possibly through augmenting functions of CD8+T cells[J]. J Immunol Res, 2016,2016:9404705.
[5] Bouchliou I,Miltiades P,Kotsianidis I,et al. Th17 and Foxp3(+) T regulatory cell dynamics and distribution in myelodysplastic syndromes[J].Clin Immunol,2011,139(3):350-9.
[6] 尹冬梅,許洪志,甄長青,等. AA,MDS 和AML 患者CD4+T 細胞亞群的變化及其臨床意義[J].山東大學學報(醫學版),2012,50 (3):66-70.
[7] 馮秀梅,許洪志,隋瀟徽,等. 再生障礙性貧血,骨髓增生異常綜合征和急性髓系白血病患者CD4+T 細胞亞群轉錄因子表達的變化及其臨床意義[J]. 中國實驗血液學雜志,2014,22(4):1038-42.
[8] 張婧瑤,許洪志,馬春燕,等. 再生障礙性貧血,骨髓增生異常綜合征,急性髓系白血病患者CD8+T 細胞亞群的變化及臨床意義[J]. 中國實驗血液學雜志,2013,21(1):203-8.
[9] 張 越,許洪志,王 菲,等 AA、MDS 和AML 患者外周血T 淋巴細胞相關細胞因子表達水平的對比研究[J]. 新醫學,2016,47(6):384-7.
[10] Ge M,Zheng Y,Feng S,et al.Differential expression profile of Th1 /Th17 /Th2-related chemokines and their receptors in patients with acquired bone marrow failure syndromes[J]. Hum Immunol,2013,74(2):176-80.
[11] Du H Z,Wang Q,Ji J,et al. Expression of IL-27, Th1 and Th17 in patients with aplastic anemia[J]. J Clin Immunol,2013,33(2):436-45.
[12] Ziegler S F, Buckner J H. FOXP3 and the regulation of Treg/Th17 differentiation[J]. Microbes Infect,2009,11(5):594-8.
[13] Aggarwal S, van de Loosdrecht A A, Bontkes H J,et al.Role of immune responses in the pathogenesis of low-risk MDS and high-risk MDS:implications for immunotherapy[J]. Br J Haematol,2011,153(5):568-81.
[14] Serio B,Risitano A,Selleri C,et al. Immunological derangement in hypocellular myelodysplastic syndromes[J]. Transl Med Unisa,2014,8(5):31-42.
[15] 孔令君,葛 健,夏瑞祥.Treg 和淋巴細胞亞群在急性髓系白血病中的意義[J].安徽醫科大學學報,2015,50(4):512-5.

