白靈菇蛋白提取及功能特性和結(jié)構(gòu)分析
張艷榮,高宇航,劉婷婷,宋云禹,陳丙宇,王大為*
(吉林農(nóng)業(yè)大學(xué)食品科學(xué)與工程學(xué)院,吉林 長春 130118)
白靈菇(Pleurotus nebrodensis),又名白靈側(cè)耳,隸屬于擔(dān)子菌門,傘菌目,側(cè)耳科,側(cè)耳屬,是阿魏菇的白色變種。白靈菇子實體色澤潔白,碩大肥厚,子實體形狀有掌狀、馬蹄狀、棒狀等,是我國唯一具有自主知識產(chǎn)權(quán)及明確原產(chǎn)地的食用菌品種資源[1]。目前,國內(nèi)白靈菇主要來源于工廠化栽培,產(chǎn)地集中在北京、河南、河北、江蘇等地,產(chǎn)量逐年遞增,據(jù)2014年統(tǒng)計全國白靈菇年產(chǎn)量已突破30.80萬 t。白靈菇營養(yǎng)物質(zhì)含量豐富,干品白靈菇子實體中蛋白質(zhì)為14.70%,碳水化合物為43.30%,脂肪為4.31%,纖維為15.40%,氨基酸總量為10.70%,17 種氨基酸中有8 種必需氨基酸,占氨基酸總量的35%[2]。白靈菇以其細(xì)膩脆韌的口感和鮮香的風(fēng)味走俏國內(nèi)外市場,隨著栽培技術(shù)的逐步成熟以及優(yōu)良種質(zhì)資源持續(xù)開發(fā),未來白靈菇產(chǎn)業(yè)定會得到長足發(fā)展。
目前國內(nèi)對白靈菇的加工應(yīng)用較多是以開發(fā)高附加值產(chǎn)品為主的工藝研究和以白靈菇多糖為主的功能成分基礎(chǔ)研究,而忽略了對白靈菇蛋白質(zhì)(white oyster mushroom protein,WOMP)資源的開發(fā)利用。李志濤等[3]對白靈菇多糖的提取及免疫活性進(jìn)行了研究。王耀輝等[4]對白靈菇多糖的抗氧化活性進(jìn)行了探討。楊國偉等[5]研究結(jié)果表明,以1 000 mL為100%,添加35%白靈菇漿料(自制)、60%麥芽汁、加糖量6%,經(jīng)過36 h發(fā)酵,制作的白靈菇乳酸飲料品質(zhì)最佳。李鳳林等[6]對白靈菇山楂復(fù)合飲料研究結(jié)果表明,利用白靈菇菌絲發(fā)酵液為原料開發(fā)白靈菇飲料,白靈菇發(fā)酵液培養(yǎng)條件為:裝液量80 mL/瓶、接種量為15%、調(diào)pH值為6.5、180 r/min振蕩、25 ℃培養(yǎng)8~9 d。復(fù)合白靈菇飲料最佳配方為:發(fā)酵液20%、山楂漿15%、蔗糖10%、總酸質(zhì)量分?jǐn)?shù)0.4%。
一般植物蛋白具有良好的溶解性、持水性、乳化性等功能性質(zhì),在面制品、乳制品等食品工業(yè)中有廣泛的應(yīng)用前景。目前對WOMP的制備、功能性質(zhì)和結(jié)構(gòu)較為系統(tǒng)的研究鮮見報道,因此為了進(jìn)一步開發(fā)白靈菇潛在的營養(yǎng)和應(yīng)用價值,本研究采用超聲波-微波復(fù)合輔助堿法提取WOMP并對提取工藝進(jìn)行優(yōu)化,同時對WOMP功能特性和結(jié)構(gòu)進(jìn)行研究,為白靈菇的高附加值利用提供相關(guān)理論依據(jù)。
1 材料與方法
1.1 材料與試劑
白靈菇 實驗室馴化栽培優(yōu)良菌株(編號AJ01)栽培;無水乙醇、氫氧化鈉、溴化鉀(均為分析純)北京化工廠;彩虹245廣譜蛋白Marker 北京索萊寶科技有限公司;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium doecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)試劑盒(包括30%聚丙烯酰胺、pH 8.8 Tris/SDS分離膠緩沖液、pH 6.8 Tris/SDS分離膠緩沖液、過硫酸銨干粉、上樣緩沖液、四甲基乙二胺溶液) 北京鼎國昌盛生物技術(shù)有限公司;AccQ-Tag熒光衍生試劑盒(包括熒光衍生試劑、硼酸鹽緩沖液、AccQ-Tag流動相A和AccQ-Tag流動相B、17 種混合氨基酸標(biāo)準(zhǔn)液) 美國Waters公司。
1.2 儀器與設(shè)備
UWave-1000型微波-紫外-超聲波三位一體合成萃取反應(yīng)儀 上海新儀微波化學(xué)科技有限公司;HR2168型攪拌器 飛利浦(中國)投資有限公司;CT15RT臺式高速冷凍離心機(jī) 上海天美科學(xué)儀器有限公司;UV-2300紫外分光光度計 北京普析通用儀器有限公司;Acquity UPLCH-Class型超高效液相色譜系統(tǒng) 美國Waters公司;冷凍干燥機(jī) 德國Ghrist公司;MOS-450型圓二色光譜儀 法國Bio-Logic公司;IR Prestige型傅里葉紅外光譜儀 日本島津公司。
1.3 方法
1.3.1 WOMP等電點測定
將10.0 g脫脂白靈菇在溫度45 ℃、微波功率24 W、超聲波功率400 W、NaOH溶液濃度0.08 mol/L、料液比1∶25(g/mL)條件下提取1.0 h,將提取液pH值分別調(diào)到2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5。于3 800 r/min離心15 min,采用考馬斯亮藍(lán)法測定上清液中蛋白質(zhì)含量[7]。
1.3.2 WOMP的提取
1.3.2.1 工藝流程
鮮品白靈菇→45 ℃熱風(fēng)干燥、粉碎(過40 目孔徑篩)→脫脂處理→超聲波-微波輔助堿法提蛋白(750 r/min,提取1 h)→離心(3 800 r/min,15 min)→上清液→酸沉(1 mol/L的HCl溶液調(diào)pH值至3.5)→離心(3 800 r/min,30 min)→蛋白沉淀→真空冷凍干燥→WOMP。
1.3.2.2 WOMP提取的單因素試驗
各組試驗中稱取脫脂后白靈菇子實體粉末(過40 目孔徑篩)10.0 g和微波功率24 W保持不變,在單因素試驗中考察提取溫度、超聲波功率、NaOH溶液濃度、料液比和提取時間對蛋白得率的影響。設(shè)定提取溫度50 ℃、超聲波功率500 W、NaOH溶液濃度0.08 mol/L、料液比1∶30(g/mL)、提取時間1.0 h。單因素試驗為固定其他因素研究某因素對蛋白得率的影響。各因素水平:提取溫度分別為30、35、40、45、50、55、60 ℃;超聲波功率分別為200、300、400、500、600、700 W;NaOH溶液濃度分別為0.02、0.04、0.06、0.08、0.10、0.12 mol/L;提取時間分別為0.1、0.4、0.7、1.0、1.3、1.6 h;料液比分別為1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)。
1.3.3 正交試驗設(shè)計
在單因素試驗的基礎(chǔ)上,以提取溫度、超聲波功率、NaOH溶液濃度、料液比、提取時間為考察因素,以蛋白質(zhì)得率為考察指標(biāo),進(jìn)行L16(45)正交試驗,每組試驗3 次平行,并應(yīng)用SPSS 18.0軟件對數(shù)據(jù)進(jìn)行分析處理,優(yōu)化出最佳的WOMP提取工藝,正交試驗因素與水平見表1。
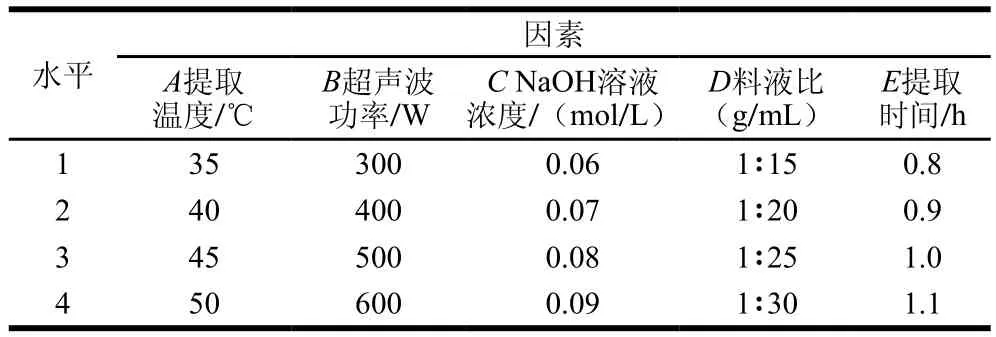
表1 正交試驗設(shè)計因素與水平Table1 Variables and levels used in orthogonal array design
1.3.4 蛋白得率的計算
參考趙玉紅等[8]方法,脫脂白靈菇輔助堿法提取、酸沉后離心,收集上清液,采用考馬斯亮藍(lán)法測定上清液中蛋白質(zhì)含量,取1.0 mL上清液放入試管中,加入5.0 mL考馬斯亮藍(lán)溶液混勻靜置3 min,測定吸光度,蛋白得率按公式(1)計算:
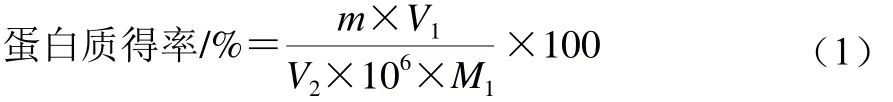
式中:m為標(biāo)準(zhǔn)曲線中查得的蛋白質(zhì)質(zhì)量/μg;M1為樣品白靈菇質(zhì)量/g;V1為離心得上清液總體積/mL;V2為測定吸光度所用上清液體積/mL。
1.3.5 WOMP功能性質(zhì)測定
對WOMP的溶解性、持水性、持油性、起泡性和泡沫穩(wěn)定性、乳化性和乳化穩(wěn)定性測定參考劉婷婷等[9]的方法。
1.3.5.1 WOMP溶解性測定
配制10.0 mg/mL樣品溶液17 份;將9 份調(diào)節(jié)不同pH值至2.5、3.5、6.0、7.0、7.5、8.0、8.5、9.0、10.0,室溫條件下攪拌20 min,另外8 份分別于30、40、50、60、70、80、90、100 ℃條件下水浴攪拌20 min,離心測上清液中蛋白質(zhì)含量;WOMP溶解度按公式(2)計算:

1.3.5.2 WOMP持水性和持油性測定
準(zhǔn)確稱取1.00 g WOMP樣品12 份于離心管中,其中6 份加入30 mL蒸餾水,6 份加入10 mL大豆油,分別在30、40、50、60、70、80 ℃條件下水浴振蕩1.5 h,靜置30 min,3 800 r/min離心40 min,棄去上清液,測殘留物的質(zhì)量,持水性和持油性按公式(3)計算:

1.3.5.3 WOMP起泡性和泡沫穩(wěn)定性測定
配制10.0、15.0、20.0、25.0、30.0、35.0 mg/mL的WOMP溶液各100 mL,高速攪打10 min,用量筒測量泡沫體積及液體體積。室溫靜置60 min后再記錄泡沫體積,WOMP起泡性和泡沫穩(wěn)定性按公式(4)、(5)計算:

1.3.5.4 WOMP乳化性和乳化穩(wěn)定性測定
配制10.0、15.0、20.0、25.0、30.0、35.0 mg/mL的WOMP溶液各100 mL,加入100 mL玉米油,高速勻漿10 min,3 800 r/min離心15 min,測乳化層體積,所得混合液于100 ℃條件下保溫60 min,冷卻至室溫后再次離心,再測乳化層體積,WOMP乳化性和乳化穩(wěn)定性測定按公式(6)、(7)計算:

1.3.6 WOMP結(jié)構(gòu)測定
1.3.6.1 WOMP氨基酸組成分析
超高效液相色譜分析WOMP氨基酸組成及含量,方法參考文獻(xiàn)[10-11],準(zhǔn)確稱取WOMP樣品50.0 mg于100 ℃條件下水解20 h,取1 mL水解液蒸干,用超純水定容到10 mL備用。將17 種氨基酸標(biāo)準(zhǔn)品梯度稀釋,備用。取樣品10 μL,加70 μL硼酸鹽緩沖溶液渦旋混合,再加20 μL衍生劑充分混合,放置5 min,封口,移入55 ℃烘箱中加熱10 min;測定條件:ACQUITY UPLC BEH C18色譜柱(2.1 mm×100 mm,1.7 μm),紫外波長266 nm,柱溫49 ℃,樣品溫度20 ℃;根據(jù)測定的必需氨基酸含量按公式(8)、(9)計算WOMP氨基酸評分、氨基酸化學(xué)評分:

1.3.6.2 WOMP的分子質(zhì)量測定
參考孔毅等[12]方法,使用SDS-PAGE凝膠試劑盒配制分離膠質(zhì)量分?jǐn)?shù)12%,電壓100 V;濃縮膠質(zhì)量分?jǐn)?shù)15%,80 V電壓;上樣量15 μL;常溫固定、染色、脫色。
1.3.6.3 WOMP的二級結(jié)構(gòu)測定
參考韓宇鵬等[13]方法,配制1 mg/mL WOMP中性溶液,選擇遠(yuǎn)紫外光區(qū)波長范圍190~260 nm;比色池為0.1 cm;光譜帶寬1 nm;分辨率0.2 nm;響應(yīng)時間0.25 s;掃描速率10 nm/min;圓二色光譜分辨率20 mdeg;室溫條件下測定蛋白質(zhì)二級結(jié)構(gòu)并計算相對含量。
1.3.6.4 WOMP的官能團(tuán)結(jié)構(gòu)分析
參考魏春光等[14]方法,準(zhǔn)確稱取2 mg干燥WOMP和200 mg干燥KBr粉末,充分研磨混勻后壓片。以KBr為背景,在500~4 000 cm-1波數(shù)下對WOMP進(jìn)行紅外光譜分析。
2 結(jié)果與分析
2.1 WOMP等電點測定結(jié)果
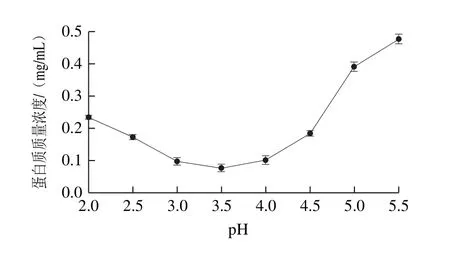
圖1 WOMP等電點Fig.1 Isoelectric point of WOMP
由圖1可以看出,WOMP提取液pH值在2.0~5.5范圍內(nèi)變化時,蛋白提取液經(jīng)過酸沉、離心后測得上清液中蛋白質(zhì)質(zhì)量濃度逐漸降低,pH值為3.5時最低,pH值大于3.5之后,蛋白質(zhì)量濃度上升趨勢明顯,因此蛋白等電點為3.5。
2.2 單因素試驗結(jié)果
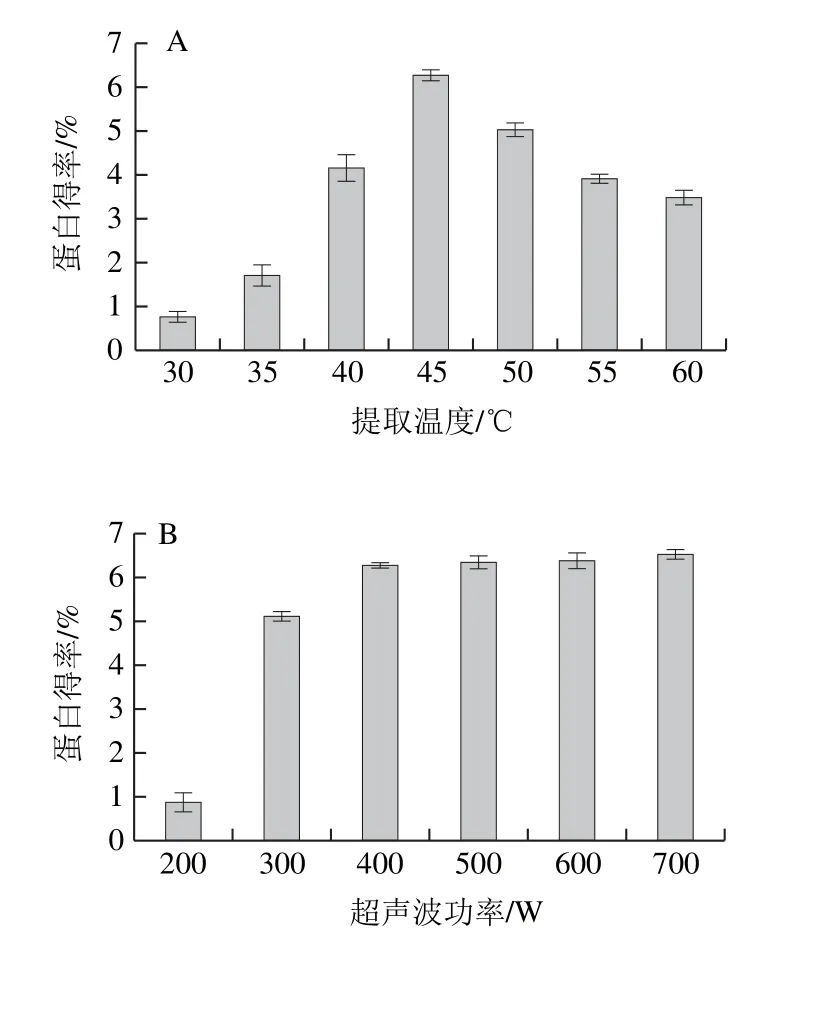
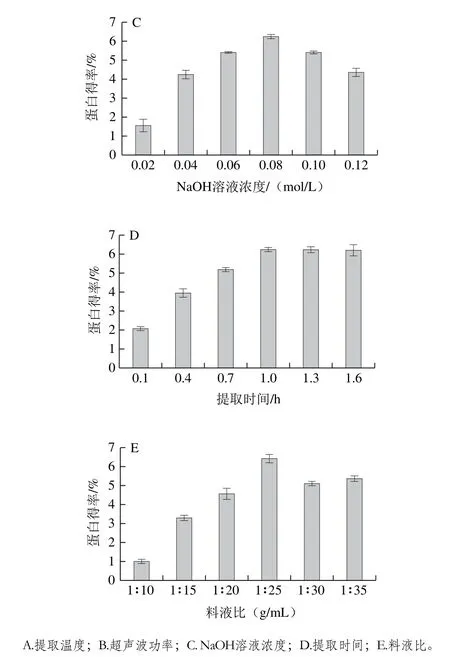
圖2 各因素對蛋白得率的影響Fig.2 Individual effects of factors on protein yield
由圖2A可知,隨著提取溫度升高,蛋白得率呈先上升后下降的趨勢,在提取溫度為45 ℃時得率最高。當(dāng)提取溫度低于45 ℃,升高溫度使蛋白質(zhì)分子空間構(gòu)象改變,立體結(jié)構(gòu)適當(dāng)伸展,加強(qiáng)了水分子和蛋白分子之間的相互作用,蛋白質(zhì)溶解度增加,得率增加;提取溫度大于45 ℃,升高溫度分子間運動加劇使維持蛋白質(zhì)空間構(gòu)象和立體結(jié)構(gòu)的弱作用力消失,一些非極性的基團(tuán)暴露在分子表面[15],影響蛋白質(zhì)和水分子之間的相互作用,蛋白質(zhì)溶解度降低,蛋白得率降低。
由圖2B可知,隨著超聲波功率的增加蛋白得率呈先上升后趨于平緩的趨勢。超聲波的空化效應(yīng)和機(jī)械效應(yīng)破壞蛋白質(zhì)四級結(jié)構(gòu),使蛋白質(zhì)小分子的亞基釋放[16],一些極性氨基酸殘基向蛋白質(zhì)分子外部遷移,增強(qiáng)蛋白與水分子的相互作用,使溶解度增加[17];超聲波能阻止蛋白質(zhì)中自由氨基群和臨近羧基群之間的靜電作用而提高蛋白的溶解度[18],當(dāng)超聲波功率大于400 W時反應(yīng)體系中的蛋白質(zhì)已經(jīng)最大程度溶出,因此蛋白得率會趨于平穩(wěn)[19]。
由圖2C可知,蛋白得率隨NaOH溶液濃度的增加呈先上升后下降的趨勢,在NaOH溶液濃度為0.08 mol/L時得率最高為6.25%,隨著NaOH溶液濃度的增加,反應(yīng)體系中蛋白質(zhì)分子攜帶的同種符號的凈電荷增加,同種電荷相互排斥阻止了單個分子的聚集,因此溶解度增大[20];而過高的NaOH溶液濃度會使蛋白質(zhì)水解變性,使蛋白溶解度降低,同時加速其美拉德反應(yīng)生成黑褐色物質(zhì),降低蛋白質(zhì)純度[21];過高的NaOH溶液濃度會改變蛋白的營養(yǎng)特性,生成賴氨酰丙氨酸,降低蛋白質(zhì)的營養(yǎng)價值[22]。
由圖2D可知,提取時間大于1 h后蛋白得率隨時間的延長變化不大,這與李桂菊等[23]報道的時間對蛋白提取率的影響結(jié)果一致,原因是在提取1 h后白靈菇中大部分的蛋白已經(jīng)溶解在體系中。
由圖2E可知,蛋白得率在料液比為1∶25(g/mL)時達(dá)到最高,為6.43%,隨料液比增加得率稍有下降后趨于平緩。原因是隨著溶劑體積的增加,溶質(zhì)的分散程度增加,溶質(zhì)與溶劑之間的接觸更充分,加速了蛋白質(zhì)溶出,當(dāng)料液比增加到一定量時,兩相體系接觸程度最大化,因此得率變化趨于平緩。
2.3 正交試驗結(jié)果
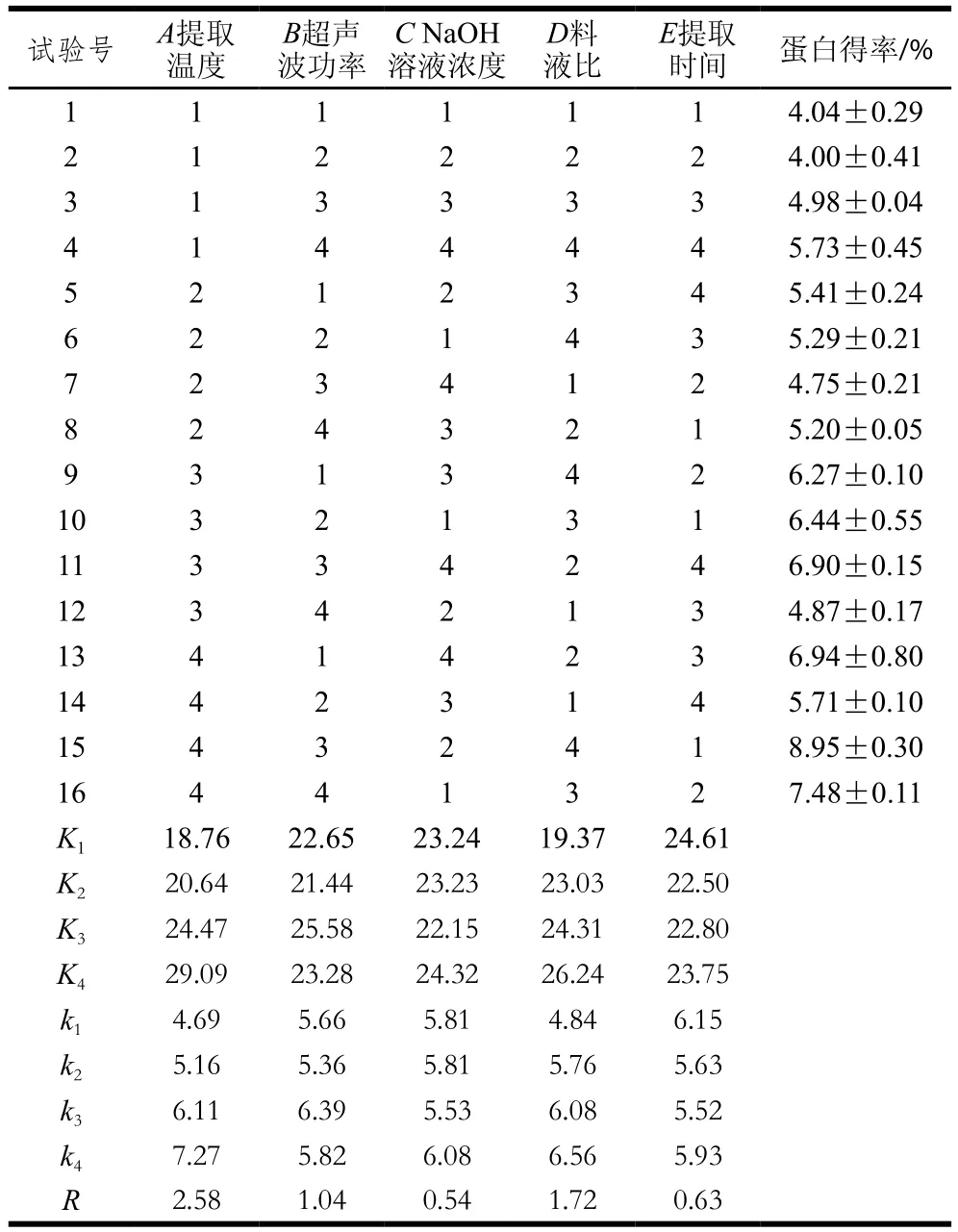
表2 L16(45)正交試驗設(shè)計及結(jié)果Table2 Orthogonal array design L16 (45) with range analysis of experimental results
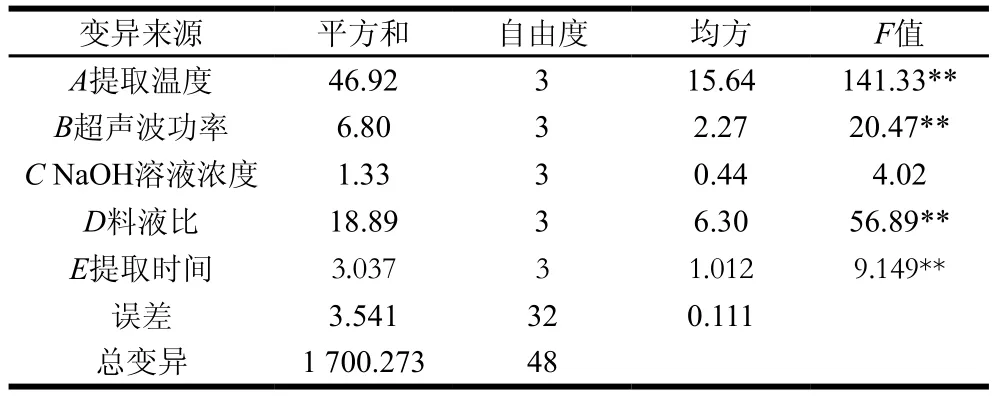
表3 正交試驗方差分析結(jié)果Table3 Analysis of variance for the eff ects of five factors on protein yield
由表2可知,各因素對蛋白得率的影響程度大小依次為提取溫度>料液比和超聲波功率>提取時間>NaOH溶液濃度。由表3可知,除NaOH溶液濃度外其他因素都達(dá)到極顯著水平(P<0.01),而NaOH溶液濃度對蛋白得率的影響不顯著(P>0.05),這一結(jié)果與極差分析結(jié)果相符。正交分析得到的最優(yōu)組合為A4B3C4D4E1,該組合不在16組正交試驗中,對其進(jìn)行驗證實驗,結(jié)果得率為(10.28±0.62)%,大于16 組試驗中的最優(yōu)組第15組,故最終確定WOMP最佳提取條件為:提取溫度50 ℃、超聲波功率500 W、NaOH溶液濃度0.09 mol/L、料液比1∶30(g/mL)、提取時間0.8 h。
2.4 WOMP功能特性
2.4.1 溶解性測定結(jié)果
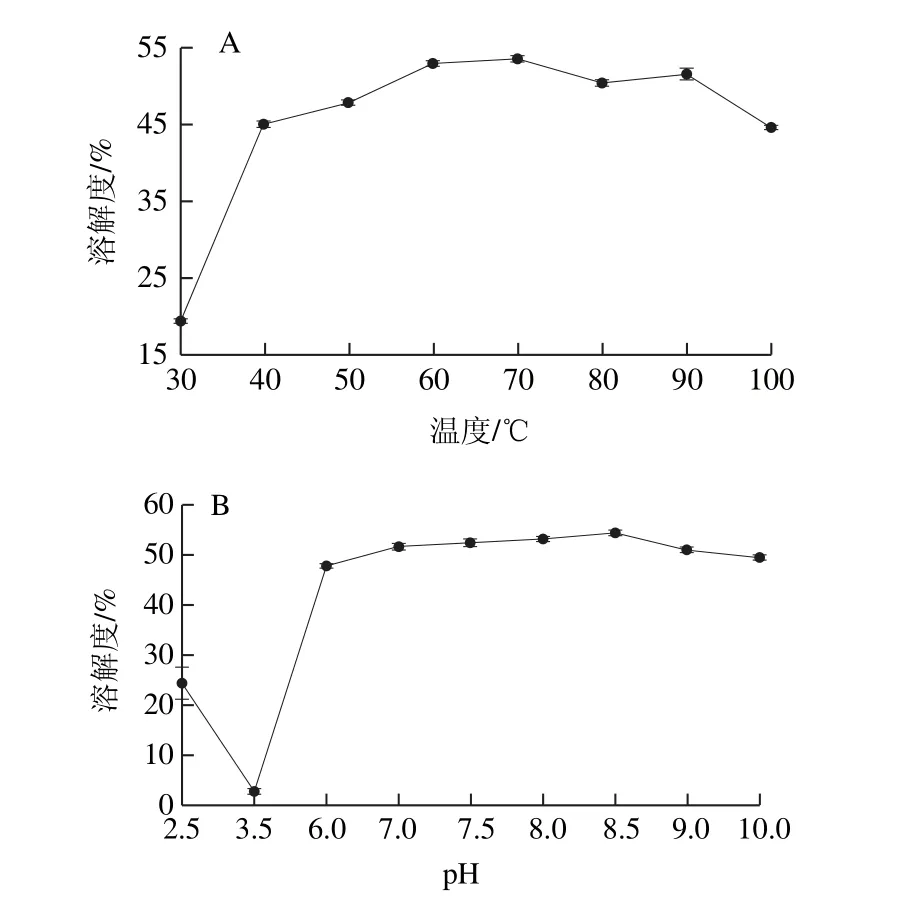
圖3 溫度(A)和pH值(B)對蛋白質(zhì)溶解度的影響Fig.3 Effect of pH on solubility of the protein
由圖3A可知,pH 7條件下WOMP的溶解度隨溫度的升高呈先增加后趨于平緩最后降低的趨勢,在70 ℃條件下蛋白溶解度最高為53.61%,表明溫度對蛋白的溶解度有較大影響[24],適當(dāng)?shù)纳郎赜兄诘鞍踪|(zhì)分子的溶解,而溫度過高則會導(dǎo)致蛋白質(zhì)變性使溶解度降低,根據(jù)張波等[25]報道,紅小豆分離蛋白在55 ℃時溶解度最高,與其相比WOMP在較高溫度時有較高的溶解度,說明WOMP有較好的耐熱性。由圖3B可知,當(dāng)pH值在等電點附近時,溶解性很低,當(dāng)pH值偏離等電點時,蛋白質(zhì)溶解性增加,pH 8.5時蛋白質(zhì)溶解度最高為54.31%,當(dāng)pH繼續(xù)增加時蛋白溶解度有緩慢下降的趨勢,WOMP在堿性條件下比酸性條件下的溶解性好。
2.4.2 持水性和持油性測定結(jié)果
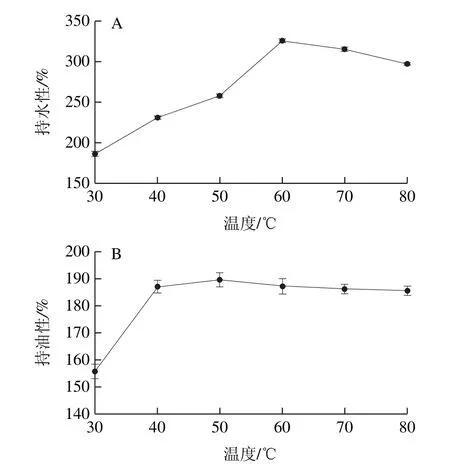
圖4 溫度對蛋白持水性(A)和持油性(B)的影響Fig.4 Effect of temperature on water-holding (A) and oil-holding (B) of the protein
由圖4A可知,溫度對WOMP持水性的影響呈現(xiàn)出先上升后下降的趨勢,在60 ℃時達(dá)到最大為325.27%,蛋白分子在低于變性溫度的環(huán)境中隨著溫度的升高,蛋白分子進(jìn)行適當(dāng)?shù)纳煺筟26],一些親水性基團(tuán)充分的與水分子結(jié)合[27],當(dāng)溫度高于變性溫度后,蛋白質(zhì)變性使非極性基團(tuán)大量暴露,與水分子之間相互作用減弱,持水性降低[28];由圖4B可知,當(dāng)溫度在50 ℃時蛋白持油性達(dá)到最大為189.60%,之后持油性逐漸降低,原因是隨著溫度的升高,蛋白質(zhì)的變性,分子間的相互作用減弱,使其持油性降低。據(jù)文獻(xiàn)[9]報道,紅小豆分離蛋白和大豆分離蛋白的持油性分別為202%和231%,均高于WOMP。
2.4.3 起泡性和泡沫穩(wěn)定性測定結(jié)果
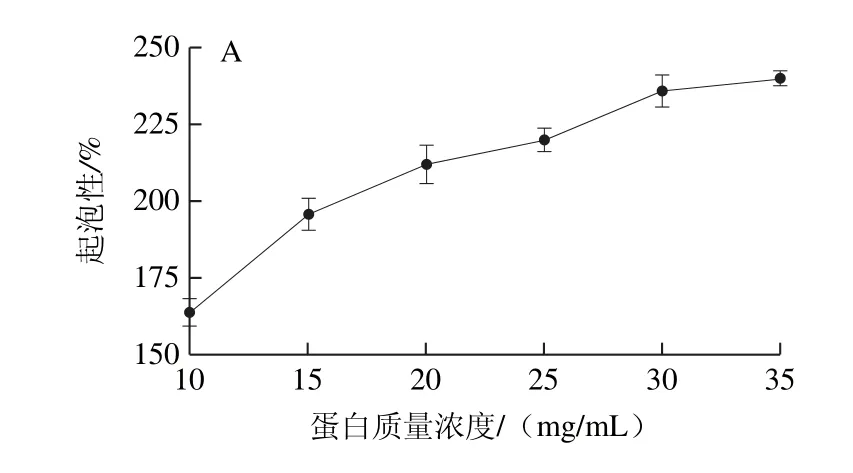
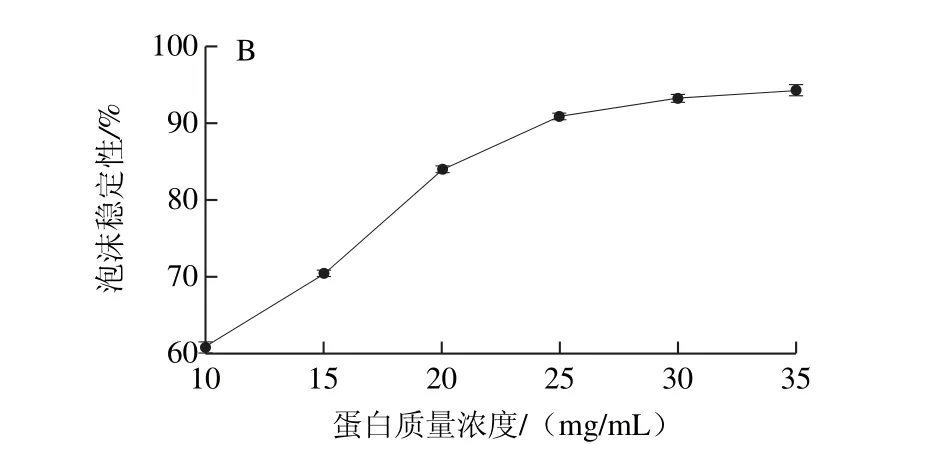
圖5 蛋白質(zhì)量濃度對蛋白起泡性(A)和泡沫穩(wěn)定性(B)的影響Fig.5 Effect of protein concentration on foaming capacity (A) and foam stability (B) of the protein
蛋白質(zhì)起泡性的本質(zhì)是蛋白質(zhì)分子在一定條件下與水分子和空氣形成一種特殊形態(tài)混合物的能力,泡沫穩(wěn)定性是衡量泡沫穩(wěn)定能力的指標(biāo),在食品加工中可以利用蛋白質(zhì)的起泡性和泡沫穩(wěn)定性使產(chǎn)品達(dá)到特殊的組織狀態(tài)和口感[29]。由圖5可知,在考察的質(zhì)量濃度范圍內(nèi),WOMP的起泡性和泡沫穩(wěn)定性都隨著蛋白質(zhì)量濃度的增加而增加,這是因為蛋白質(zhì)分子濃度增加,高速攪打時分子間的相互作用增強(qiáng),表面張力進(jìn)一步降低進(jìn)而結(jié)合更多氣體,形成穩(wěn)定的氣泡。當(dāng)WOMP質(zhì)量濃度為35 mg/mL時,WOMP起泡性為237.5%,與大豆分離蛋白123%和紅小豆分離蛋白127.5%的起泡性相比[25],WOMP具有較好的起泡性,可以較好地運用到焙烤食品等需要產(chǎn)生并保持氣泡的食品中。
2.4.4 乳化性和乳化穩(wěn)定性測定結(jié)果
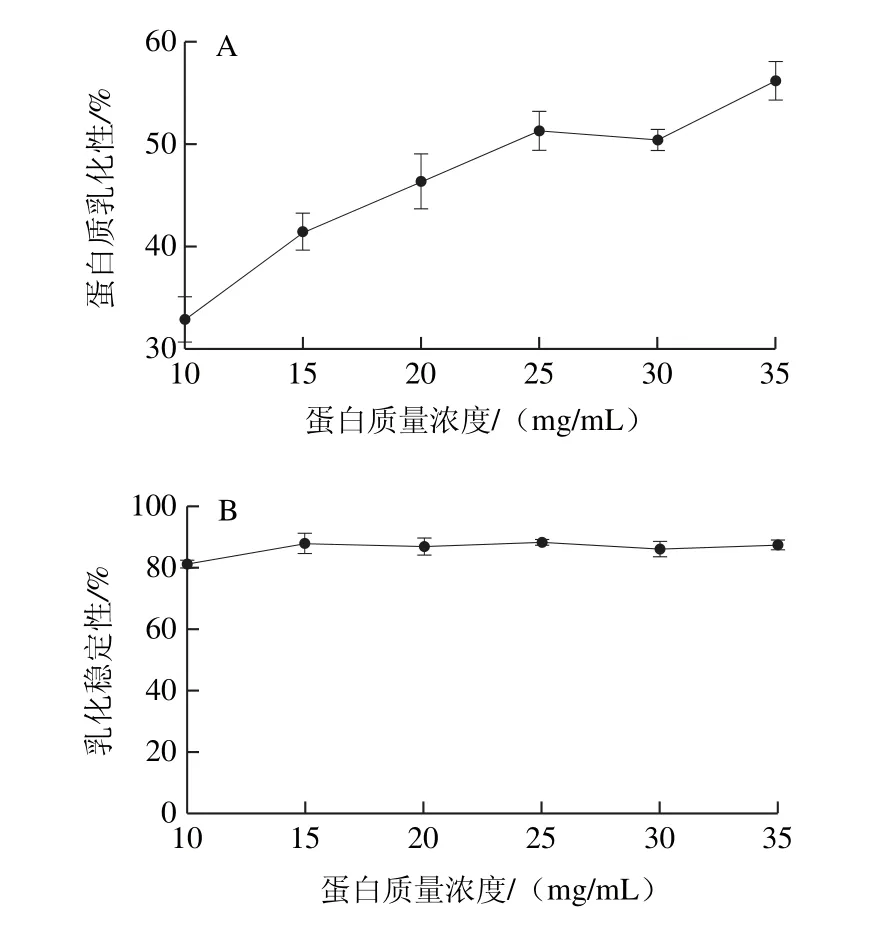
圖6 蛋白質(zhì)量濃度對乳化性(A)和乳化穩(wěn)定性(B)的影響Fig.6 Effect of protein concentration on emulsifying capacity (A) and emulsion stability (B) of the protein
蛋白質(zhì)作為一種表面活性物質(zhì),既含有親水性基團(tuán)又含有親油性基團(tuán),具有降低水-油界面表面張力的作用,同時其降低水和空氣表面張力的能力表現(xiàn)為乳化穩(wěn)定性[30],在食品加工中應(yīng)用蛋白質(zhì)的表面活性,使產(chǎn)品具有乳化穩(wěn)定狀態(tài)進(jìn)而可以延長產(chǎn)品貨架期[31]。由圖6可知,WOMP的乳化性隨蛋白質(zhì)量濃度的增加呈緩慢上升的趨勢,而乳化穩(wěn)定性隨蛋白質(zhì)量濃度增加變化不大,說明在不同的蛋白濃度條件下,WOMP有良好的乳化穩(wěn)定性。當(dāng)WOMP質(zhì)量濃度為35 mg/mL時,WOMP乳化性為58.3%明顯高于大豆分離蛋白47%和紅小豆分離蛋白46%[25],說明WOMP可以作為良好乳化劑應(yīng)用到食品中。
2.5 WOMP結(jié)構(gòu)測定結(jié)果
2.5.1 氨基酸組成結(jié)果
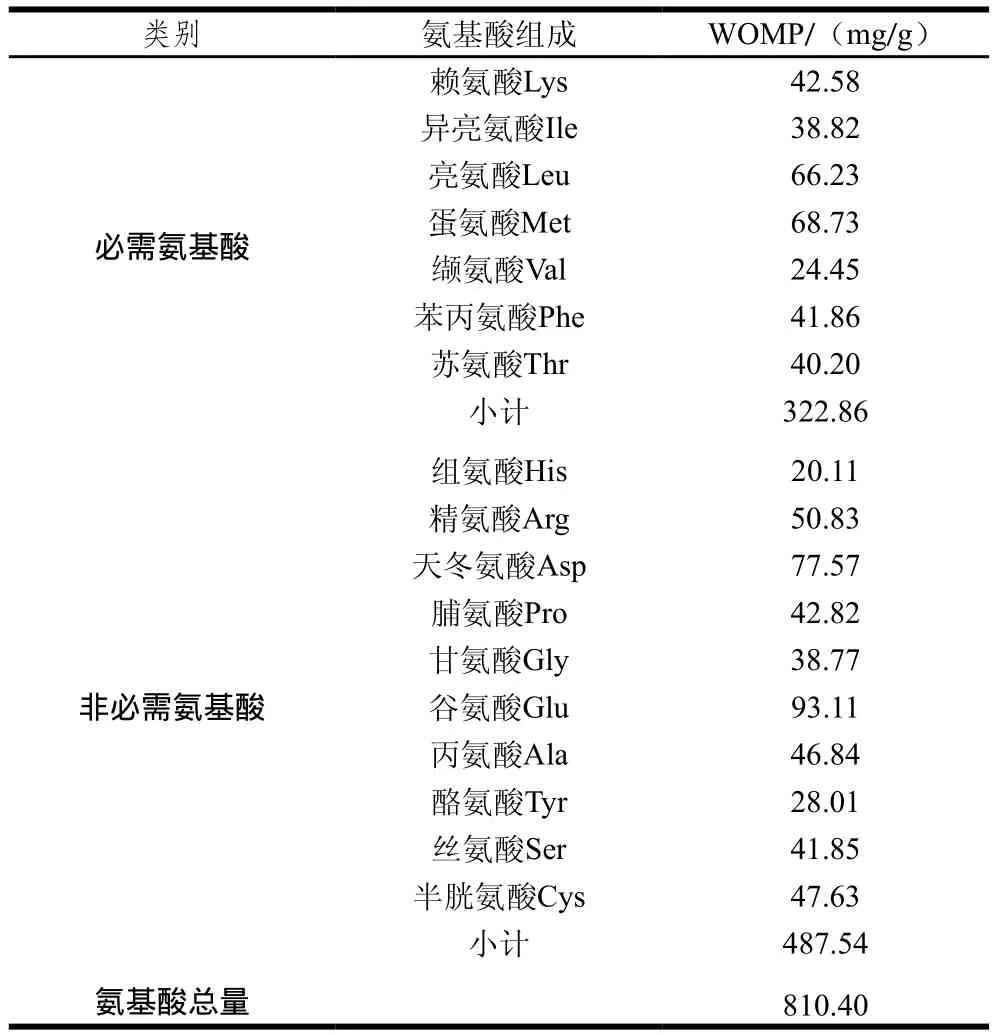
表4 WOMP的氨基酸組分Table4 Amino acid composition of WOMP
由表4可以看出,WOMP含有17 種氨基酸,組氨酸是第1限制性氨基酸,其中必需氨基酸含量為322.86 mg/g,非必需氨基酸含量為487.54 mg/g,必需氨基酸占總氨基酸的比例為39.84%,必需氨基酸和非必需氨基酸的比值為0.66,接近WHO/FAO標(biāo)準(zhǔn)值,表明氨基酸組成合理。
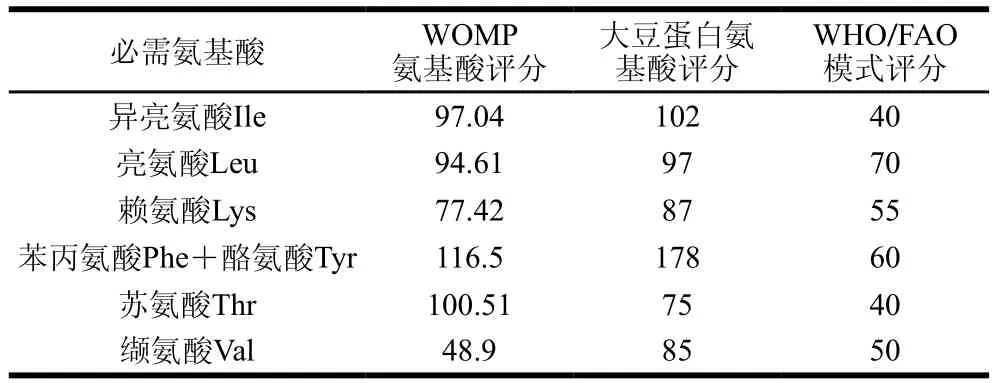
表5 氨基酸評分Table5 Amino acid scores
由表5可知,WOMP的異亮氨酸和亮氨酸評分與大豆蛋白這2 種氨基酸的氨基酸評分接近,蘇氨酸評分高于大豆蛋白,其他氨基酸評分低于大豆蛋白;白靈菇必需氨基酸含量與人體所需要量接近。
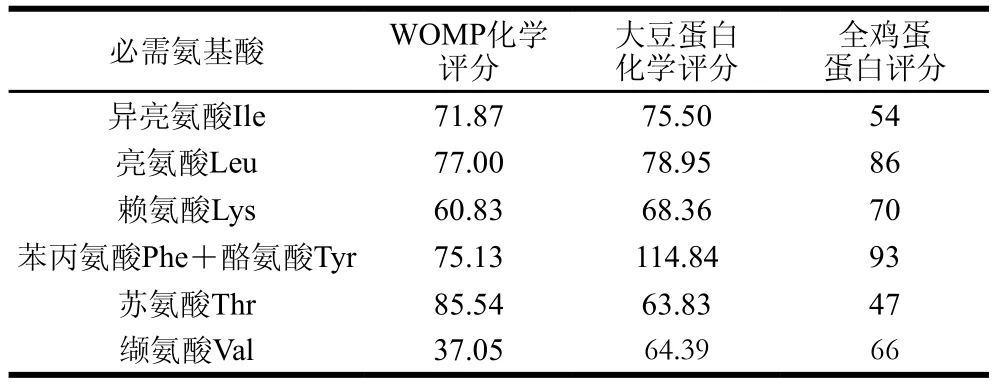
表6 化學(xué)評分Table6 Chemical scores
由表6可知,除纈氨酸和苯丙氨酸+酪氨酸化學(xué)評分略低于大豆和雞蛋蛋白評分外,WOMP氨基酸的化學(xué)評分與大豆、雞蛋等蛋白基本相近,說明其營養(yǎng)價值較高,有非常大的開發(fā)潛力。
2.5.2 二級結(jié)構(gòu)測定結(jié)果
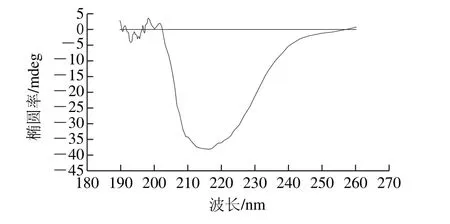
圖7 WOMP的圓二色光圖譜Fig.7 Far-UV CD spectrum of WOMP
圓二色性是指光學(xué)活性物質(zhì)對左旋(R)和右旋(L)2 種圓偏振光吸收程度不同的現(xiàn)象,它的存在使通過具有光學(xué)活性物質(zhì)的圓偏振光變?yōu)闄E圓偏振光,且在特定吸收波長處出現(xiàn)。根據(jù)這一原理設(shè)計的圓二色光譜儀可以測定光學(xué)活性物質(zhì)的圓二色光譜,通過圓二色光譜圖可以進(jìn)一步研究光學(xué)活性物質(zhì)的立體構(gòu)型[32],蛋白質(zhì)的肽鍵檢測波長在190~250 nm之間,該區(qū)間內(nèi)有圓二色性,因此可以通過圓二色光譜圖反映蛋白質(zhì)二級結(jié)構(gòu)[33-34]。對WOMP進(jìn)行圓二色光譜掃描結(jié)果見表7和圖7,通過蛋白質(zhì)二級結(jié)構(gòu)分析軟件CD-Pro計算得WOMP二級結(jié)構(gòu)中α-螺旋相對含量最高為53%,其次是無規(guī)卷曲相對含量為23%,然后是β-轉(zhuǎn)角相對含量為14%,最后是β-折疊相對含量為11%。
2.5.3 WOMP分子質(zhì)量測定結(jié)果
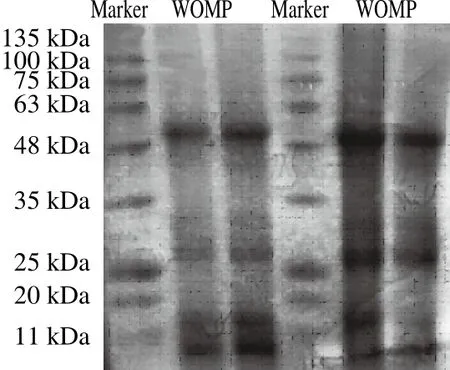
圖8 WOMP分子質(zhì)量電泳圖Fig.8 SDS-PAGE profile of WOMP
由圖8可以看出,WOMP在48~63、25~35、11~20 kDa以及小于11 kDa范圍內(nèi)有條帶,在48~63 kDa之間條帶染色程度很深,說明該分子質(zhì)量的蛋白含量較高[35]。WOMP的亞基分布主要在10~35 kDa之間,占亞基總數(shù)的75%,可見WOMP以小分子結(jié)構(gòu)蛋白居多。根據(jù)標(biāo)準(zhǔn)蛋白的遷移距離計算出標(biāo)準(zhǔn)蛋白的相對遷移率,以標(biāo)準(zhǔn)蛋白分子質(zhì)量的對數(shù)為縱坐標(biāo),相對遷移率為橫坐標(biāo),得回歸方程為:y=-0.606 2x+2.351 8,R2為0.984 6,線性范圍為0.51~2.09。根據(jù)標(biāo)準(zhǔn)曲線方程計算出WOMP分子質(zhì)量為48.9、26.3、16.4、10.9 kDa。
2.5.4 WOMP紅外光譜分析結(jié)果
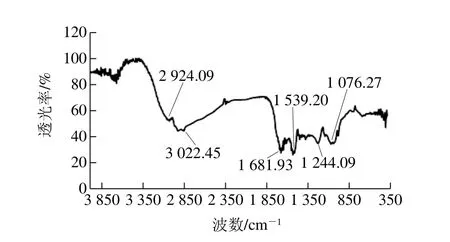
圖 9 WOMP紅外光譜圖Fig. 9 Infrared spectrum of WOMP
對于蛋白質(zhì)而言,傅里變換葉紅外光譜能夠提供蛋白質(zhì)分子中的氨基基團(tuán)、酰胺I帶(或H—O—H彎曲振動和C=O伸縮振動)、酰胺II帶(N—H彎曲)、酰胺III帶(或C—O和C—O—C振動)、蛋白質(zhì)環(huán)狀結(jié)構(gòu)中的C—C振動,以及C—O—O糖苷鍵振動波段信息[36]。由圖9可知,在3 022.45、2 924.09、1 681.93、1 539.20、1 244.09、1 076.27 cm-1處出現(xiàn)了蛋白質(zhì)特征吸收峰,分別是:烯烴類—C—H—伸縮振蕩吸收峰,烷烴類的—C—H—反對稱的伸縮振蕩吸收峰,酰胺I帶的C=O伸縮振蕩產(chǎn)生的特征吸收峰,酰胺II帶中NH2的面內(nèi)變形振蕩吸收峰,仲酰胺中C—N的伸縮振蕩和NH彎曲振蕩吸收峰,NH面內(nèi)彎曲振蕩吸收峰[37]。而且蛋白質(zhì)二級結(jié)構(gòu)信息重疊在酰胺I帶里[38],可以利用波段縮小技術(shù)將WOMP紅外光譜中的酰胺I帶細(xì)分,進(jìn)一步得到WOMP二級結(jié)構(gòu)的信息。
3 結(jié) 論
通過超聲波-微波輔助NaOH溶液法提取WOMP,結(jié)合單因素和正交試驗優(yōu)化出WOMP最佳提取工藝為:提取溫度50 ℃、微波功率24 W、超聲波功率500 W、NaOH溶液濃度0.09 mol/L、料液比1∶3 0(g/m L)、提取時間0.8 h,蛋白得率為(10.28±0.62)%。溫度和pH值均對WOMP溶解度、持水性、持油性、起泡性和起泡穩(wěn)定性以及乳化性和乳化穩(wěn)定性有影響,探究溫度和pH值對WOMP的影響為進(jìn)一步開發(fā)WOMP相關(guān)產(chǎn)品提供了理論基礎(chǔ)。探明WOMP中含有17 種氨基酸,而且必需氨基酸占總氨基酸的比例為39.84%,必需氨基酸和非必需氨基酸的比值為0.66,WOMP的氨基酸組成合理,可以作為氨基酸補(bǔ)充劑的原料來源。WOMP的二級結(jié)構(gòu)中α-螺旋相對含量為53%,β-折疊相對含量為11%,β-轉(zhuǎn)角相對含量為14%,無規(guī)卷曲相對含量為23%,分子質(zhì)量分布為48.9、26.3、16.4、10.9 kDa,探明WOMP的結(jié)構(gòu)基礎(chǔ)為進(jìn)一步的研究提供相應(yīng)的理論支持。
系統(tǒng)全面的研究WOMP的提取工藝、功能性質(zhì)和結(jié)構(gòu),可以為WOMP開發(fā)提供理論依據(jù),同時也為白靈菇的精深加工提供新的思路,為白靈菇產(chǎn)業(yè)的發(fā)展帶來新的契機(jī)。

