外源抗氧化劑α-生育酚在河蟹肌肉脂肪-蛋白質(zhì)氧化體系中的作用
劉小莉,彭歡歡,,夏秀東,周劍忠,劉 源,趙江濤,*
(1.江蘇省農(nóng)業(yè)科學(xué)院農(nóng)產(chǎn)品加工研究所,江蘇 南京 210014;2.上海海洋大學(xué)食品學(xué)院,上海 201306)
淡水水產(chǎn)品肉質(zhì)細(xì)嫩,營(yíng)養(yǎng)豐富,不易保鮮和貯藏。凍藏是保存水產(chǎn)品的有效方法,但也不可避免地造成品質(zhì)下降。這是由于水產(chǎn)品中含有大量高度不飽和脂肪酸和蛋白質(zhì),即使在低溫條件下也會(huì)氧化變質(zhì)[1]。越來(lái)越多的研究表明,脂肪在氧化的過(guò)程中會(huì)產(chǎn)生大量的自由基和活性次生氧化產(chǎn)物,進(jìn)一步與蛋白質(zhì)形成共價(jià)結(jié)合,從而誘導(dǎo)蛋白質(zhì)聚合反應(yīng)[2-3]。一方面,脂肪過(guò)氧化初級(jí)產(chǎn)物裂解產(chǎn)生脂質(zhì)自由基,自由基通過(guò)氫反應(yīng)充當(dāng)印發(fā)劑使蛋白質(zhì)分子變成自由基,蛋白質(zhì)自由基又引發(fā)聚合式鏈反應(yīng)最終導(dǎo)致蛋白質(zhì)聚合[4]。另外,脂質(zhì)氧化的次生產(chǎn)物,即醛類或酮類化合物的羰基能夠與蛋白分子中的氨基側(cè)鏈基團(tuán)反應(yīng),使多肽鏈發(fā)生鏈內(nèi)或鏈間交聯(lián)現(xiàn)象[5]。蛋白質(zhì)進(jìn)一步通過(guò)氫鍵、疏水鍵和二硫鍵等的作用進(jìn)行重排,形成高分子的蛋白質(zhì)聚合物,從而改變水產(chǎn)品的組織、顏色、水合能力和風(fēng)味等一系列營(yíng)養(yǎng)特性。
Laurizsen等[6]研究表明魚類產(chǎn)品在冷凍貯存過(guò)程中脂肪會(huì)發(fā)生氧化,氧化產(chǎn)物使魚肉質(zhì)構(gòu)發(fā)生變化,如組織蛋白變硬、聚集。此外,脂肪氧化還會(huì)使部分氨基酸,如組氨酸、賴氨酸、蛋氨酸和半胱氨酸損失,并損害其他色素蛋白質(zhì),如細(xì)胞色素C和血紅蛋白。Park等[7-8]比較了3 種模擬體系中豬肉肌原纖維蛋白的變化,發(fā)現(xiàn)在不同的氧化體系條件下肌原纖維蛋白發(fā)生不同程度的變化,主要表現(xiàn)為羰基的形成,蛋白熱穩(wěn)定性下降以及蛋白交聯(lián)聚集等。Faustman等[9]發(fā)現(xiàn)脂肪氧化的初級(jí)產(chǎn)物和次級(jí)產(chǎn)物對(duì)于蛋白質(zhì)氧化起促進(jìn)作用,脂溶性抗氧化劑α-生育酚能夠有效抑制脂肪氧化,亦可有效抑制水溶性蛋白的氧化。
河蟹是我國(guó)傳統(tǒng)特色的經(jīng)濟(jì)蟹類,但上市時(shí)間比較集中,大部分以鮮活河蟹進(jìn)行銷售,很容易造成供大于求而滯銷的局面,特別是小規(guī)格蟹價(jià)格低,嚴(yán)重影響了河蟹產(chǎn)業(yè)經(jīng)濟(jì)效益的提高[10]。因此有必要進(jìn)行河蟹精深加工的研究,其中原料的貯藏問(wèn)題是河蟹加工產(chǎn)業(yè)的瓶頸問(wèn)題。然而目前對(duì)凍藏過(guò)程中河蟹肌肉脂肪氧化導(dǎo)致蛋白質(zhì)變性方面的研究鮮見報(bào)道。α-生育酚是一種天然抗氧化物質(zhì),無(wú)毒性,目前廣泛應(yīng)用于多種食品的抗氧化研究[11]。本實(shí)驗(yàn)建立河蟹氧化脂肪-蛋白質(zhì)的模擬體系,探討氧化脂肪所引起的蛋白質(zhì)特性的改變,以及α-生育酚對(duì)氧化脂肪誘導(dǎo)蛋白質(zhì)發(fā)生變性的抑制作用,并以此為指導(dǎo),控制脂肪氧化而減少蛋白質(zhì)變性,為提高食品品質(zhì)提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
鮮活公河蟹由常熟市金唐市水產(chǎn)有限公司提供,體質(zhì)量(150±15)g,江蘇省淡水水產(chǎn)研究所鑒定為中華絨螯蟹(Eriocheir sinensis H. Milne-Edwards)。
α-生育酚、抗壞血酸(食品級(jí)) 鄭州思源食品添加劑有限公司;5,5’-二硫代雙-硝基苯甲酸 美國(guó)Sigma公司;BCA法蛋白定量測(cè)試盒、丙二醛測(cè)定試劑盒 南京建成生物工程研究所;過(guò)硫酸銨(ammonium persulphate,APS)、N,N,N’,N’-四甲基乙二胺(tetramethylethylenediamine,TEMED)、預(yù)混合分離膠、預(yù)混合濃縮膠、5×十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上樣緩沖液、快速蛋白染色液 新賽美生物科技有限公司;石油醚、氫氧化鉀、甲醇、三氟化硼、乙醚、氯化鈉、正己烷、磷酸氫二鈉、磷酸二氫鈉、三羥甲基氨基甲烷(2-amino-2-(hydroxymethyl)-1,3-propanediol,Tris)、氯化鉀、溴酚藍(lán)均為國(guó)產(chǎn)分析純。
1.2 儀器與設(shè)備
VK-6001絞肉機(jī) 德國(guó)歐諾華公司;RE-6000旋轉(zhuǎn)蒸發(fā)儀 上海亞榮生化儀器廠;T25勻質(zhì)分散機(jī) 德國(guó)IKA公司;TSQ 800 Evo氣相色譜-質(zhì)譜聯(lián)用儀 賽默飛世爾科技公司;DHG-9146A電熱恒溫鼓風(fēng)干燥箱 上海精宏實(shí)驗(yàn)設(shè)備有限公司;3K15高速離心機(jī) 北京五洲東方科技發(fā)展有限公司;UV-1600PC紫外分光光度計(jì)上海美譜達(dá)儀器有限公司;SynergyH1酶標(biāo)儀 美國(guó)柏騰儀器有限公司;GS-800垂直電泳槽 美國(guó)Bio-Rad公司;150型河蟹采肉機(jī) 山東省諸城市興和機(jī)械有限公司。
1.3 方法
1.3.1 蟹肉采集及預(yù)處理
采用河蟹采肉機(jī),通過(guò)擠壓方式采集蟹肉,-20 ℃保存?zhèn)溆谩?/p>
1.3.2 脂質(zhì)的提取及氧化指標(biāo)測(cè)定
采用Folch等[1]的方法提取蟹油。制備的蟹肉用20 倍體積的石油醚(沸程60~90 ℃)混合,室溫振搖40~60 min,收集有機(jī)溶劑相。下層水相樣品再加入有機(jī)溶劑提取2 次。合并有機(jī)相,40 ℃旋轉(zhuǎn)蒸發(fā)揮干有機(jī)溶劑,得到粗蟹油,待用。按照GB/T 5009.37—2003《食用植物油衛(wèi)生標(biāo)準(zhǔn)的分析方法》中第二法所述測(cè)定過(guò)氧化值。依據(jù)硫代巴比妥酸法原理采用試劑盒檢測(cè)丙二醛含量,結(jié)果以1 mg樣品蛋白質(zhì)中丙二醛含量(nmol/mg)表示。
1.3.3 氣相色譜-質(zhì)譜聯(lián)用分析脂肪酸組成
參照Liu Wei等[13]的方法對(duì)油脂進(jìn)行甲酯化處理。取所得蟹油0.2 mL,加入2 mL體積分?jǐn)?shù)為5%的氫氧化鉀-甲醇溶液,75 ℃水浴15 min,冷卻后加入2 mL體積分?jǐn)?shù)為14%的三氟化硼乙醚-甲醇溶液,75 ℃水浴2 min,加入飽和氯化鈉溶液2 mL和正己烷1 mL,混勻后靜置,取上清液,采用氣相色譜-質(zhì)譜聯(lián)用法檢測(cè)蟹油脂肪酸組成。
色譜條件:SLB-5MS毛細(xì)管色譜柱(30 m×0.25 mm,0.25 μm);升溫程序:120 ℃保持6 min,以3 ℃/min升溫到250 ℃,保持25 min;載氣(He)流速1.2 mL/min,壓力2.4 kPa,進(jìn)樣量1.0 μL;分流比30∶1。
質(zhì)譜條件:電子電離源;電子能量70 eV;燈絲發(fā)射電流200 μA;離子源溫度200 ℃;接口溫度250 ℃;檢測(cè)器電壓350 V;質(zhì)量掃描范圍m/z 33~800。
1.3.4 模擬反應(yīng)體系建立
將提取的油脂于90 ℃烘箱中分別放置12 h和24 h,得到氧化型蟹油。取未被氧化、氧化12 h、氧化24 h的蟹油各10 mL,分別加入到100 g蟹肉中,用勻漿機(jī)攪拌均勻,得到3 組蟹油-蛋白質(zhì)模擬體系(編號(hào)I、II、III)。將上述3 組模擬體系各分為2 份,其中一組分別加入0.015%的α-生育酚和0.02%的抗壞血酸(編號(hào)IV、V、VI)。共6 組處理進(jìn)行實(shí)驗(yàn)。將6 組樣品置于常溫條件下1周,定期取樣進(jìn)行蛋白質(zhì)氧化指標(biāo)的測(cè)定。
1.3.5 肌原纖維蛋白的提取
參照Fang Yang等[14]的方法進(jìn)行不同處理的樣品中肌原纖維蛋白的提取。稱取5 g蟹肉樣品加10 mL、4 ℃預(yù)冷的去離子水,12 000 r/min勻漿30 s,10 000 r/min、4 ℃離心20 min,棄去上清液,沉淀中加入去離子水,再重復(fù)提取1 次。沉淀中再加入20 mL、4 ℃預(yù)冷的0.05 mol/L磷酸緩沖液(pH 7.2)(其中補(bǔ)充0.6 mol/L的NaCl),12 000 r/min勻漿30 s,10 000 r/min、4 ℃離心20 min,收集上清液。沉淀用上述步驟再重復(fù)提取1 次,合并上清即為肌原纖維蛋白粗提取液,其濃度采用BCA試劑盒測(cè)定。
1.3.6 活性巰基的測(cè)定
參照Benjakul等[2]的方法進(jìn)行測(cè)定。1.3.5節(jié)中提取的蛋白溶液0.5 mL,加入4.5 mL 0.2 mol/L Tris-HCl緩沖液(pH 6.8)。取該混合液1 mL,加入0.1 mL 0.1% 5,5’-二硫代雙-硝基苯甲酸,40 ℃溫育25 min,測(cè)定波長(zhǎng)412 nm處的吸光度。空白樣用0.6 mol/L KCl(pH 7.0)代替樣品。活性巰基含量以1 mg蛋白質(zhì)中活性巰基的物質(zhì)的量計(jì),按公式(1)計(jì)算:
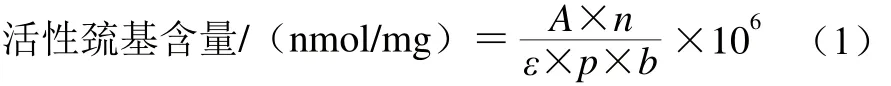
式中:A為412 nm波長(zhǎng)處的吸光度;n為稀釋倍數(shù);ε為摩爾吸光系數(shù)13 600/(L/(mol·cm));p為蛋白質(zhì)質(zhì)量濃度/(mg/mL);b為吸光池光程(1 cm)。
1.3.7 表面疏水性的測(cè)定
參考Chelh等[3]的方法,并稍作修改。將提取的肌原纖維蛋白溶液質(zhì)量濃度調(diào)整為1 mg/mL,取1 mL加入40 μL1 mg/mL的溴酚藍(lán)溶液,空白對(duì)照為1 mL提取緩沖液加入40 μL1 mg/mL的溴酚藍(lán)溶液,渦旋振蕩混勻10 min,于4 ℃、4 000×g離心15 min,取上清液稀釋10 倍后在波長(zhǎng)595 nm處測(cè)定吸光度。表面疏水性按公式(2)計(jì)算:

式中:S為表面疏水性/μg;Acontrol為空白的吸光度;Asample為樣品的吸光度;40為系數(shù)。
1.3.8 SDS-PAGE檢測(cè)
取10 mL的8%預(yù)混合分離膠加入100 μL 10% APS和5 μL TEMED,混勻后灌入制膠板內(nèi),加入適量的醇或水壓平分離膠,待20~30 min后凝聚成分離膠。取5 mL的預(yù)混合濃縮膠加入50 μL 10% APS和5 μL TEMED,混勻后灌入制膠板內(nèi),緩慢插入梳子,待20~30 min后凝聚即為濃縮膠。取12 μL的蛋白上樣液進(jìn)行電泳,全程150 V,待溴酚藍(lán)到達(dá)底部,即可完成電泳。結(jié)束后,用去離子水洗滌3 次,每次約5 min,再加入約20 mL快速蛋白染色液過(guò)夜,用去離子水脫色1 h后成像拍照。
1.3.9 傅里葉變換紅外光譜的測(cè)定
將提取的肌原纖維蛋白溶液放入真空冷凍干燥機(jī)中干燥得到粉末。將樣品粉末均勻地鋪滿在采樣器上,進(jìn)行紅外光譜掃描,掃描次數(shù)256,分辨率為4 cm-1。
1.4 數(shù)據(jù)處理
本實(shí)驗(yàn)數(shù)據(jù)為3 次重復(fù)的平均值。采用SPSS 13.0軟件進(jìn)行數(shù)據(jù)統(tǒng)計(jì)和方差顯著性分析。
2 結(jié)果與分析
2.1 蟹油氧化指標(biāo)及脂肪酸組成
過(guò)氧化值和丙二醛是常用的脂質(zhì)氧化評(píng)價(jià)指標(biāo),本研究中新鮮蟹油的過(guò)氧化值和丙二醛含量分別為(3.61±0.26) meq/kg、(11.64±1.26) nmol/mg,氧化12、24 h后過(guò)氧化值分別達(dá)到(5.50±0.47) meq/kg和(8.26±0.21) meq/kg,丙二醛含量分別達(dá)到(16.51±0.87) nmol/mg和(29.86±0.73) nmol/mg,可見在高溫條件下,蟹油快速發(fā)生氧化,導(dǎo)致酸敗。由表1可以看出,新鮮的蟹油飽和脂肪酸相對(duì)含量為15.21%,氧化12、24 h后分別達(dá)到29.83%、44.85%。蟹油脂肪酸中油酸相對(duì)含量最高,高溫氧化后,油酸相對(duì)含量顯著下降,分別僅為57.01%、43.87%。由于油脂在氧化過(guò)程中,自由基會(huì)連鎖攻擊不飽和脂肪酸,從而使得不飽和脂肪酸發(fā)生衰敗,蟹油中不飽和脂肪酸總量會(huì)隨氧化時(shí)間的延長(zhǎng)呈下降趨勢(shì),相應(yīng)飽和脂肪酸的含量升高。其他學(xué)者也報(bào)道過(guò)類似的研究結(jié)果[17]。研究表明,脂肪氧化與蛋白質(zhì)氧化之間是相互關(guān)聯(lián)的,且兩者中的任一種物質(zhì)氧化產(chǎn)生的化合物都會(huì)促進(jìn)另一種物質(zhì)的氧化[18-19]。脂肪氧化形成的羥自由基可以?shī)Z取蛋白質(zhì)分子的氫離子,使得蛋白質(zhì)發(fā)生與脂肪氧化類似的自由基鏈?zhǔn)椒磻?yīng)[20-21]。
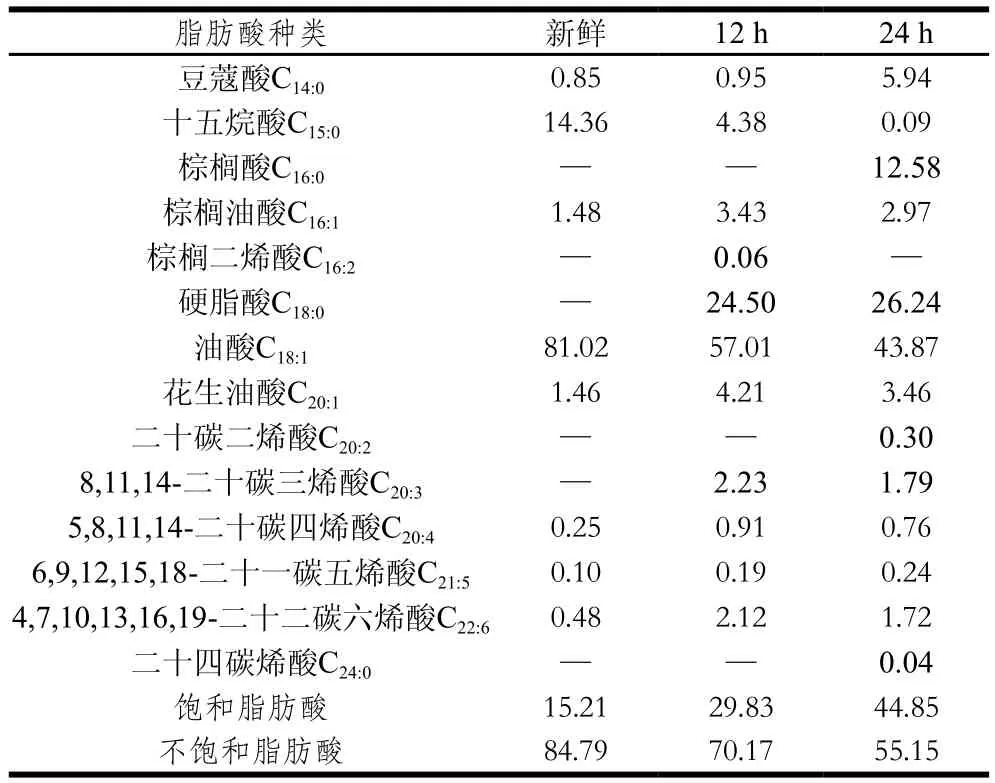
表1 新鮮與氧化蟹油中脂肪酸相對(duì)含量Table1 Contents of fatty acids in fresh and oxidized crab oils%
2.2 活性巰基含量的變化
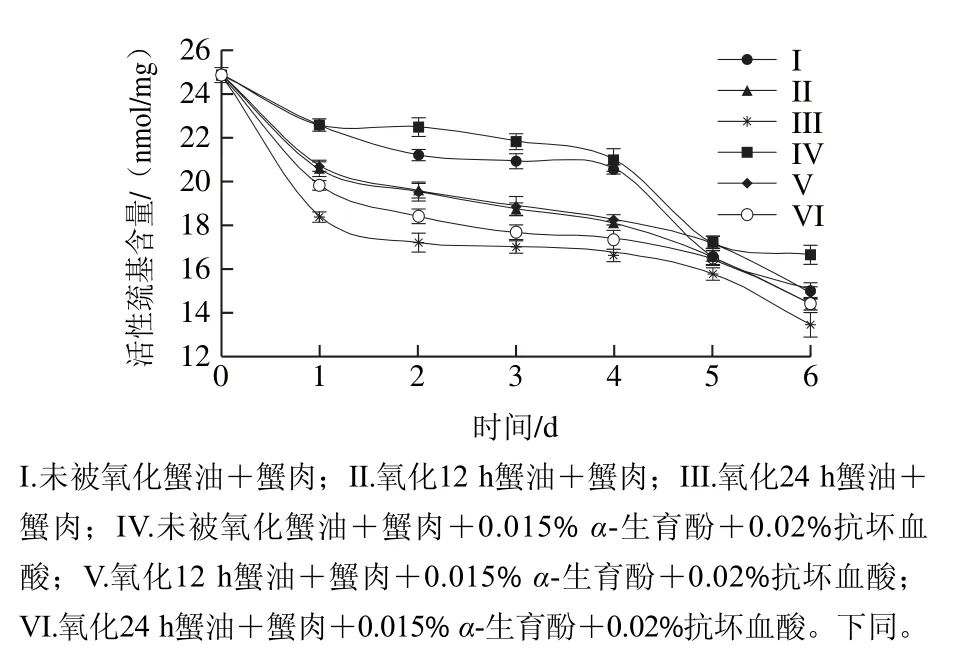
圖1 肌原纖維蛋白中巰基含量的變化Fig.1 Changes in active sulfhydryl content of myofibrillar protein
活性巰基含量的變化能夠反映出蛋白質(zhì)變性集合的程度,活性巰基含量下降的主要原因是巰基氧化形成二硫鍵所致[22]。由圖1可以看出,6 組樣品在貯藏期間活性巰基含量都不斷減少。未加抗氧化劑的3 組對(duì)比發(fā)現(xiàn),添加氧化蟹油,下降速度越快,這可能是經(jīng)人工氧化的蟹油產(chǎn)生大量的自由基,進(jìn)而誘導(dǎo)肌原纖維蛋白分子發(fā)生變性和蛋白質(zhì)結(jié)構(gòu)改變,而使得隱藏的分子內(nèi)部的巰基活性基團(tuán)暴露出來(lái),巰基易于氧化形成二硫鍵,導(dǎo)致活性巰基含量的不斷下降。添加抗氧化劑的活性巰基減少量低于未加抗氧化劑組,由于α-生育酚屬于酚類物質(zhì)使得羥基釋放活潑氫,與自由基的結(jié)合會(huì)抑制其對(duì)脂質(zhì)的攻擊。由此可以看出,α-生育酚對(duì)巰基具有一定的保護(hù)作用,從而抑制了蛋白質(zhì)分子的交聯(lián)、聚合現(xiàn)象的發(fā)生。
2.3 表面疏水性的變化
脂質(zhì)氧化還可能引起蛋白質(zhì)分子內(nèi)部結(jié)構(gòu)和性質(zhì)發(fā)生改變。其中表面疏水性是與外界極性水環(huán)境相連的蛋白質(zhì)表面疏水性基團(tuán)數(shù)量的一個(gè)重要標(biāo)志[23]。蛋白質(zhì)在降解發(fā)生變性的過(guò)程中,隱藏在蛋白質(zhì)內(nèi)部的分子暴露出來(lái),改變其疏水性,導(dǎo)致疏水性基團(tuán)的增加,因此蛋白質(zhì)表面疏水性可以在一定程度上衡量蛋白質(zhì)的變性程度。當(dāng)?shù)鞍踪|(zhì)分子空間結(jié)構(gòu)發(fā)生變化時(shí),分子內(nèi)部的疏水基團(tuán)和親水基團(tuán)相對(duì)位置也會(huì)發(fā)生改變,導(dǎo)致表面疏水性指數(shù)發(fā)生變化[24-25]。

圖2 肌原纖維蛋白中表面疏水性的變化Fig.2 Changes in surface hydrophobicity of myofibrillar protein
由圖2可以看出,在貯藏過(guò)程中,隨著蟹油氧化程度的增加,肌原纖維蛋白的表面疏水性顯著升高(P<0.05),可能是蛋白質(zhì)分子折疊,使肽鏈斷裂或結(jié)構(gòu)伸展,分子的內(nèi)部疏水基團(tuán)暴露導(dǎo)致表面疏水性的增加。說(shuō)明油脂的氧化在一定程度上可以促使肌原纖維蛋白疏水基團(tuán)的暴露,這與章銀良等[26]的研究結(jié)果一致。添加α-生育酚的樣品,表面疏水性都較相應(yīng)的未添加α-生育酚的對(duì)照樣品模擬體系少。α-生育酚抗氧化作用的機(jī)制主要是因?yàn)棣?生育酚可以首先替代其他的物質(zhì)被氧化,從而延緩不飽和脂肪酸的氧化作用,且以抗壞血酸為增效劑,可以提高其抗氧化效能[27-28]。在貯藏初期,表面疏水性隨著時(shí)間延長(zhǎng)不斷提高,從而誘導(dǎo)蛋白質(zhì)表面疏水性不斷增大,當(dāng)反應(yīng)到后期脂肪氧化趨于飽和。α-生育酚可以抑制微生物的生長(zhǎng),延緩蛋白質(zhì)的降解作用及蛋白變性,進(jìn)而延緩表面疏水性的增加;而且α-生育酚可能抑制了脂肪氧化體系對(duì)蛋白質(zhì)折疊的作用,而延緩表面疏水性的增加。
2.4 SDS-PAGE結(jié)果

圖3 河蟹肌肉肌原纖維蛋白的SDS-PAGE圖譜Fig.3 SDS-PAGE profiles of myofibrillar protein
由圖3可以看出,條帶從上到下分別是肌球蛋白重鏈、肌動(dòng)蛋白、原肌球蛋白和肌球蛋白輕鏈,其中肌球蛋白重鏈和肌動(dòng)蛋白是主要的蛋白質(zhì)條帶[29]。6 組樣品的肌原纖維蛋白條帶隨著貯藏時(shí)間延長(zhǎng),發(fā)生不同程度的變淡。貯藏1 d后蟹肉肌原纖維蛋白條帶清晰,可以清楚的辨別蛋白中的肌球蛋白重鏈、肌動(dòng)蛋白、原肌球蛋白和肌球蛋白輕鏈。蛋白質(zhì)在貯藏3 d后,肌球蛋白重鏈條帶明顯減弱,且氧化程度越高,條帶減弱程度越明顯,添加抗氧化劑的3 組IV、V、VI較相對(duì)應(yīng)的未添加抗氧化劑3 組I、II、III條帶降解相對(duì)緩慢,但Gel Image System軟件對(duì)條帶光密度分析結(jié)果顯示,除了貯藏1 d后的V、II組肌球蛋白重鏈、肌動(dòng)蛋白存在顯著差異,其他組間條帶差異不顯著。貯藏結(jié)束后,幾乎所有蛋白質(zhì)條帶變淺消失。結(jié)合2.2節(jié)和2.3節(jié)結(jié)果,貯藏過(guò)程中不同處理組間活性巰基含量和表面疏水性指標(biāo)差異顯著,可見SDS-PAGE用于檢測(cè)蛋白質(zhì)氧化程度不及活性巰基和表面疏水性指標(biāo)靈敏。
2.5 傅里葉變換紅外光譜測(cè)定
將肌原纖維蛋白溶液冷凍干燥,利用傅里葉變換紅外光譜儀進(jìn)行光譜掃描,選擇波數(shù)1 600~1 700 cm-1范圍經(jīng)Peakfit 4.12軟件分析得到自動(dòng)去卷積后的蛋白質(zhì)二級(jí)結(jié)構(gòu)。在蛋白質(zhì)的二級(jí)結(jié)構(gòu)中,α-螺旋結(jié)構(gòu)是蛋白質(zhì)分子的有序結(jié)構(gòu),具有高度的結(jié)構(gòu)穩(wěn)定性;而β-轉(zhuǎn)角和無(wú)規(guī)卷曲為蛋白質(zhì)分子的無(wú)序結(jié)構(gòu),因此可將α-螺旋結(jié)構(gòu)的相對(duì)含量用于判斷蛋白質(zhì)結(jié)構(gòu)的穩(wěn)定性[30-31]。如表2所示,蟹肉與氧化12 h的蟹油混合,貯藏期結(jié)束后蛋白質(zhì)β-轉(zhuǎn)角相對(duì)含量顯著增加,其他二級(jí)結(jié)構(gòu)沒有顯著差異;氧化24 h后的蟹油則對(duì)蟹肉中蛋白質(zhì)二級(jí)結(jié)構(gòu)影響顯著,與對(duì)照相比,除了無(wú)序結(jié)構(gòu)外其他結(jié)構(gòu)均有顯著變化,α-螺旋和β-折疊相對(duì)含量顯著減少,β-轉(zhuǎn)角相對(duì)含量顯著增加。本研究中添加0.015% α-生育酚和0.02%抗壞血酸的抗氧化劑處理組,很好地維持了蟹肉中蛋白質(zhì)的二級(jí)結(jié)構(gòu)穩(wěn)定,與對(duì)照相比只有氧化24 h蟹油組的β-轉(zhuǎn)角相對(duì)含量顯著增加,其他二級(jí)結(jié)構(gòu)無(wú)顯著差異,說(shuō)明添加抗氧化劑能很好地維持蟹肉蛋白質(zhì)的二級(jí)結(jié)構(gòu)穩(wěn)定。

表2 貯藏結(jié)束后不同樣品中蛋白質(zhì)二級(jí)結(jié)構(gòu)相對(duì)含量Table2 Protein secondary structures in diff erent samples after storage%
3 結(jié) 論
河蟹肌肉蟹油經(jīng)過(guò)高溫氧化后,脂肪酸組成發(fā)生變化,不飽和脂肪酸相對(duì)含量明顯下降。在氧化蟹油的作用下,河蟹肌肉蛋白質(zhì)中活性巰基含量下降,表面疏水性上升,且油脂氧化程度越高,所引起的蛋白質(zhì)變性越顯著。添加抗氧化劑的處理組對(duì)巰基具有保護(hù)作用,且減少表面疏水值的增加;SDS-PAGE結(jié)果顯示,隨著貯藏時(shí)間的延長(zhǎng),氧化程度越高,條帶減弱程度越明顯,添加抗氧化劑的3 組IV、V、VI較相對(duì)應(yīng)的未添加抗氧化劑3 組I、II、III條帶降解相對(duì)緩慢,但效果并不顯著,說(shuō)明SDS-PAGE法用于判定蛋白質(zhì)氧化不及活性巰基和表面疏水性指標(biāo)靈敏。傅里葉變換紅外光譜結(jié)果顯示,油脂氧化程度越高,相應(yīng)的處理組蛋白質(zhì)二級(jí)結(jié)構(gòu)中α-螺旋、β-折疊相對(duì)含量越少,β-轉(zhuǎn)角則越多,添加抗氧化劑能維持蟹肉蛋白質(zhì)相對(duì)穩(wěn)定的二級(jí)結(jié)構(gòu)。

